文章信息
- 食管胃结合部腺癌中HSP105b的表达与腹腔热灌注化疗疗效的关系
- Expression of Heat Shock Protein 105b in Adenocarcinoma of Esophagogastric Junction and Its Relation with Effect of Hyperthermic Intraperitoneal Chemotherapy
- 肿瘤防治研究, 2021, 48(4): 365-369
- Cancer Research on Prevention and Treatment, 2021, 48(4): 365-369
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0824
- 收稿日期: 2020-07-17
- 修回日期: 2020-09-25
2. 455000 安阳,安阳市肿瘤医院暨河南科技大学第四附属医院腹部肿瘤外科;
3. 455000 安阳,安阳市妇幼保健院腹部外科
2. Department of Abdominal Tumor Surgery, Anyang Tumor Hospital and The Fourth Affiliated Hospital of He'nan University of Science and Technology, Anyang 455000, China;
3. Department of Abdominal Surgery, Anyang Maternal and Child Health Care Hospital, Anyang 455000, China
进展期食管胃结合部腺癌(adenocarcinoma of esophagogastric junction, AEG)围手术期腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy, HIPEC)是减少腹腔复发转移进而提高存活率的有力措施[1],但其机制尚未完全明确。HIPEC的治疗疗效受到肿瘤细胞内热休克蛋白(heat shock proteins, HSPs)的负向调节[2]。HSP105b是唯一一种癌症中显性阴性突变的HSP,多中心研究结果显示HSP105b的低表达与肿瘤的良好预后之间存在直接联系[3]。HSP105b在胃癌组织中的表达水平与肿瘤的进展、不良预后及辅助化疗后的复发有关[4],但与HIPEC疗效的相关性未见报道。本研究对进展期AEG肿瘤组织中HSP105b的表达水平与临床病理特征的相关性及与围手术期HIPEC治疗疗效的关系进行分析,进而探讨HIPEC抗肿瘤的可能机制。
1 资料与方法 1.1 一般资料选择2015年1月—2017年6月安阳市肿瘤医院暨河南科技大学第四附属医院腹部肿瘤外科收治的行经腹R0根治性切除+D2淋巴结清除术的局部进展期Siewert Ⅱ型AEG患者。研究对象的纳入标准:(1)术前活检病理确诊为腺癌;(2)影像学排除远处转移;(3)年龄40~70岁;(4)无手术、化疗禁忌证;(5)无其他恶性肿瘤病史及放化疗史;(6)签署知情同意书,并要求手术治疗;(7)术中确诊侵及浆膜和(或)发现区域肿大淋巴结,而且未发现腹盆腔种植灶。
所有患者术前均签署HIPEC知情同意书、手术同意书、临床试验知情同意书,并获得河南科技大学第四附属医院暨安阳市肿瘤医院生命科学伦理审查委员会审查同意。术中探查后确定是否入组,共入组166例。入组患者按手术先后顺序随机分为2组(各83例):治疗组(术后24 h内开始给予HIPEC治疗,共2次,余给予常规处理)和对照组(术后仅给予常规处理)。治疗组和对照组患者在年龄、性别、BMI、并发症比率、临床分期、胃切除范围及消化道重建方式等方面的差异均无统计学意义(P > 0.05)。
1.2 诊断和分期所有病例术后检出淋巴结均≥20枚,手术标本均经病理学检查。根据2016年美国癌症联合会(American Joint Committee on Cancer, AJCC)第8版胃癌TNM分期标准[5]进行术后病理分期,分为Ⅱb期患者38例,Ⅲa~b期患者128例。
1.3 手术治疗所有患者均经腹行食管胃结合部腺癌R0切除+D2淋巴结清扫,治疗组术中留置腹腔灌注管4根。两组均无围手术期死亡病例。
1.4 预防性HIPEC治疗治疗组患者术后24 h内连接由广州保瑞医疗技术有限公司生产的BR-TRG-Ⅱ型体腔热灌注治疗系统进行治疗。所有患者均行2次国产紫杉醇注射液(术后第1天75 mg/m2, 术后第2天100 mg/m2)的HIPEC。
1.5 标本的处理及免疫组织化学染色所有标本用10%甲醛固定,石蜡包埋,4 µm厚连续切片。玻片用多聚-L-赖氨酸涂覆,常规苏木素-伊红(HE)染色,确定病理类型。免疫组织化学染色参照文献[6]所述,切片用1:100稀释的兔抗人HSP105b单克隆抗体(GeneTex, 美国)4℃孵育24 h。
使用免疫反应评分(IRS)对HSP105b染色进行评估,评估表达HSP105b的细胞比例及其相对染色强度。HSP105b染色强度分级如下:0,无染色;1+:浅黄色;2+:棕黄色;3+:棕褐色。根据五个代表性区域的至少1 000个癌细胞,计算HSP105b表达的AEG细胞百分比。阳性细胞百分比:无着色细胞计0分,1%~10%计1分,> 10%~50%计2分,> 50%~100%计3分。两项得分相乘,≤3为低表达,≥4为高表达。以上结果由2名病理学专家(副主任医师或主任医师)阅片判断,存在差异时由2位医师一起审查并协商达成一致。
1.6 术后辅助化疗及随访术后4周内开始给予辅助化疗(SOX三周方案共6周期),其中38例仅给予4~5周期化疗(治疗组20例,对照组18例)。术后以电话、短信及门诊相结合的方式进行随访,每3月1次。随访内容:患者的生活质量、并发症情况、反流性食管炎程度、进食量、肿瘤复发转移情况等。随访至≥36月或至确诊肿瘤复发和(或)转移或非肿瘤因素死亡之日。随访截至2019年6月30日。
1.7 统计学方法采用SPSS22.0统计软件进行分析。正态分布计量资料以(x±s)表示,组间比较采用t检验。计数资料采用χ2检验进行统计分析。采用Kaplan-Meier法绘制生存曲线,并使用Log rank检验比较组间差异。P < 0.05为差异有统计学意义。
2 结果 2.1 围手术期两组并发症的比较本研究中治疗组的消化道反应较轻,仅有5例患者恶心,无呕吐患者;骨髓抑制发生率也较低,仅4例出现Ⅰ度血小板减少(未做特殊处理,自行缓解)。未出现白细胞减少患者,也未出现高敏感患者,仅有3例出现皮肤一过性皮疹,治疗结束后自行缓解。治疗组切口感染3例(其中1例合并切口裂开)、吻合口瘘4例(其中1例形成腹腔脓肿)、肠梗阻1例;而对照组切口感染2例,吻合口瘘3例(其中1例形成腹腔脓肿),无肠梗阻患者。经积极治疗后患者均治愈。所有患者均未形成弥漫性腹膜炎。两组在腹腔并发症方面差异无统计学意义(χ2=0.751, P=0.386)。治疗组合并肺部感染者8例,发病比例较高,而对照组仅4例,但差异仍无统计学意义(χ2=1.437, P=0.231)。两组患者均未出现围手术期死亡病例。
2.2 进展期AEG癌组织中HSP105b蛋白表达的临床意义在癌组织中,HSP105b着色于细胞核中。166例患者中92例呈高表达(55.4%),而74例呈低表达(44.6%)。在进展期AEG组织中HSP105b蛋白表达水平与临床病理特征的关系,见表 1。HSP105b的蛋白表达水平与患者的年龄、性别、肿瘤分化程度、肿瘤的浸润深度、淋巴结转移情况无明显相关性,而仅与是否存在静脉浸润明显相关(t=4.002, P=0.045)。
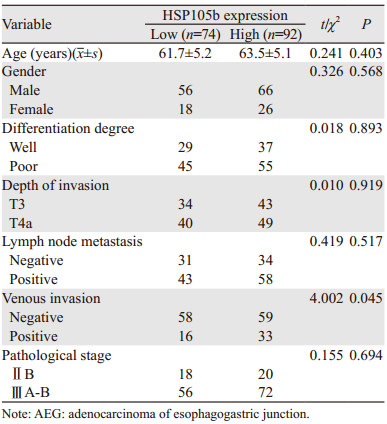
|
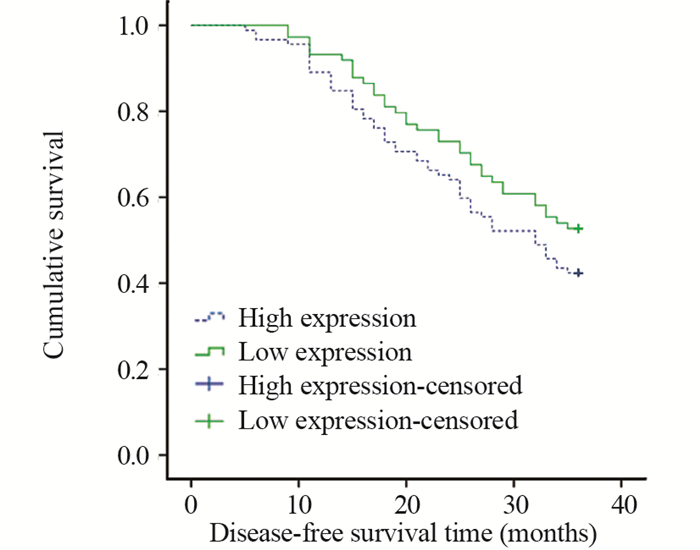
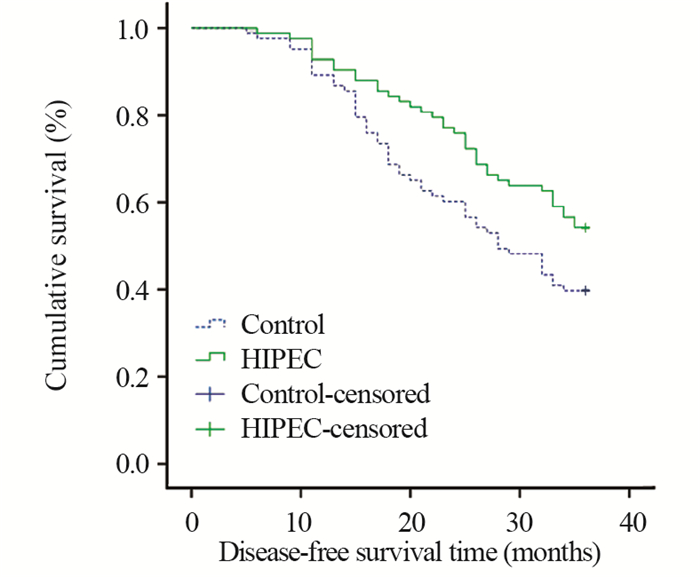
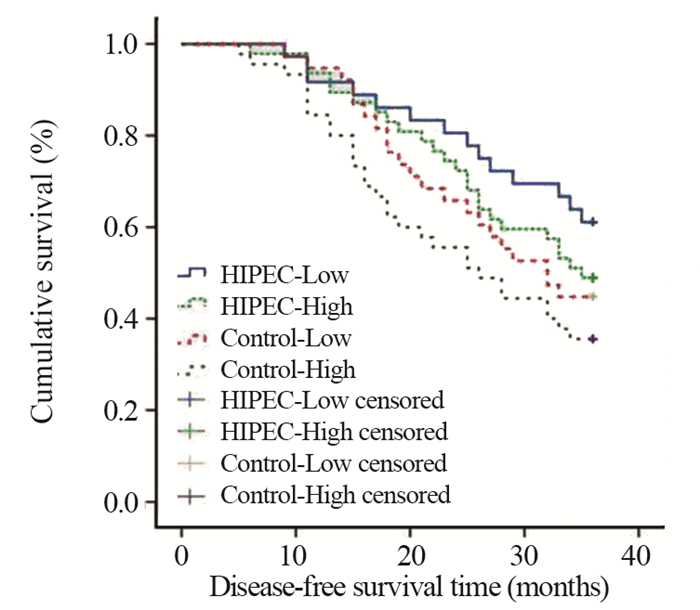
所有患者36月内非肿瘤死亡7例,其中HSP105b高表达者4例,HSP105b低表达者3例;治疗组4例,对照组3例。HSP105b高表达患者1、2年无瘤生存率分别为89.1%、65.2%,与低表达患者的93.2%、73.0%相比,差异无统计学意义(χ2=3.121, P=0.092; χ2=3.248, P=0.071);而HSP105b高表达患者的3年无瘤生存率为42.4%,明显低于低表达患者的52.7%,差异有统计学意义(χ2=35.508, P < 0.001),见图 1。治疗组及对照组各83例,治疗组3年无瘤生存率为54.2%,明显高于对照组的39.8%,差异有统计学意义(χ2=4.622, P=0.032),见图 2。在治疗组中,HSP105b高表达者47例,低表达者36例,而在对照组中,HSP105b高表达者45例,低表达者38例,其3年无瘤生存率见图 3。各组的3年无瘤生存率从高到低依次为治疗组-低表达(66.7%)、治疗组-高表达(49.8%)、对照组-低表达(47.4%)、对照组-高表达(35.6%),且均P < 0.05。
|
| 图 1 HSP105b高表达和低表达患者的3年无瘤生存率 Figure 1 Three-year disease-free survival rate between patients with high and low HSP105b expression |
|
| 图 2 治疗组与对照组3年无瘤生存率 Figure 2 Three-year disease-free survival rates between treatment group and control group |
|
| 图 3 HSP105b表达高低及HIPEC治疗对3年无瘤生存率的影响 Figure 3 Influence of HSP105b expression and HIPEC treatment on 3-year disease-free survival rate of patients |
AEG是中国常见的消化道恶性肿瘤之一,根治性手术切除是目前唯一可以治愈的方法[7]。进展期AEG最主要的播散途径是腹腔种植转移。由于手术前/中腹腔微转移的存在,即使行根治性切除,仍有较多患者术后会出现腹腔复发转移[8]。而围手术期给予HIPEC可通过热化疗的协同作用和大容量灌注冲刷作用有效杀灭和清除腹腔内残留的癌细胞和微小转移灶、预防腹膜转移癌,对提高进展期AEG患者的整体疗效具有重要意义[9]。但HIPEC的具体机制尚未明了。
热休克蛋白是一组高度保守的分子伴侣蛋白,可以防止蛋白质结构的错误折叠[10]。本研究结果显示肿瘤组织中的HSP105b蛋白表达水平高低与患者的年龄、性别、肿瘤的分化程度、浸润深度、淋巴结转移情况无明显相关,而仅与是否存在静脉浸润明显相关。说明HSP105b的表达水平与肿瘤的静脉浸润能力密切相关,这与在胃腺癌中的研究结果相一致[4]。
与低表达组相比,进展期AEG患者HSP105b高表达组1年、2年无瘤生存率无明显差异,而3年无瘤生存率则明显下降,这与既往在肺腺癌[11]、结直肠癌[12]、胃癌[13]中的研究结果相一致。因此,可以确定进展期AEG癌组织中HSP105b的高表达与患者的远期预后不良有关。
我们对进展期AEG患者随机分组,分别给予围手术期HIPEC治疗(治疗组)和仅给予常规处理(对照组)。结果显示治疗组的2年、3年无瘤生存率均明显高于对照组。可以看出进展期AEG患者根治术后给予围手术期HIPEC治疗可以减少术后腹腔复发转移的机率,减缓肿瘤复发转移速度,充分证实了HIPEC治疗的必要性。根据是否给予了HIPEC治疗和肿瘤组织中HSP105b表达的高低分成4组,计算其3年无瘤生存率。结果显示,HSP105b低表达患者给予HIPEC治疗可以获得最佳的治疗疗效(3年无瘤生存率最高)。说明HSP105b低表达可以加强HIPEC治疗的疗效,而高表达可以增加肿瘤细胞热化疗抵抗[13],但其具体分子机制有待后继研究。本试验不良反应较少,且未出现严重不良反应,与前期的研究结果一致,具有较高安全性[14]。
综上所述,HSP105b蛋白的高表达预示着不良预后,而且HSP105b高表达增加了癌细胞的热化疗抵抗。因此,癌组织中HSP105b的蛋白表达水平可作为进展期AEG患者预后因素及预测HIPEC疗效的有效生物标志物:HSP105b低表达的进展期AEG患者应优选围手术期HIPEC治疗,而对于HSP105b高表达患者将在后继的研究中结合其他分子表型选择敏感的个体化治疗方案。
作者贡献:
苏文中:课题设计、论文撰写
李守淼:设计指导、审校
周光辉:质量管控、实验操作
王虎:实验统筹、统计学处理
胡广杰、黄艳玲、李黎、马华兵:病例管理
| [1] |
Murata S, Yamamoto H, Naitoh H, et al. Feasibility and safety of hyperthermic intraperitoneal chemotherapy using 5-fluorouracil combined with cisplatin and mitomycin C in patients undergoing gastrectomy for advanced gastric cancer[J]. J Surg Oncol, 2017, 116(8): 1159-1165. DOI:10.1002/jso.24771 |
| [2] |
Pelz JO, Vetterlein M, Grimmig T, et al. Hyperthermic intraperitoneal chemotherapy in patients with peritoneal carcinomatosis: role of heat shock proteins and dissecting effects of hyperthermia[J]. Ann Surg Oncol, 2013, 20(4): 1105-1113. DOI:10.1245/s10434-012-2784-6 |
| [3] |
Kim JH, Kim KJ, Rhee YY, et al. Expression status of wild-type HSP110 correlates with HSP110 T17 deletion size and patient prognosis in microsatellite-unstable colorectal cancer[J]. Mod Pathol, 2014, 27(3): 443-453. DOI:10.1038/modpathol.2013.160 |
| [4] |
Kimura A, Ogata K, Altan B, et al. Nuclear heat shock protein 110 expression is associated with poor prognosis and hyperthermo-chemotherapy resistance in gastric cancer patients with peritoneal metastasis[J]. World J Gastroenterol, 2017, 23(42): 7541-7550. DOI:10.3748/wjg.v23.i42.7541 |
| [5] |
刘光艺, 黄镇, 王子卫. 第8版国际抗癌联盟和美国癌症联合委员会胃癌TNM分期系统简介及解读[J]. 腹部外科, 2017, 30(4): 241-245. [Liu GY, Huang Z, Wang ZW. The 8th edition of the Union for International Cancer Control and the American Joint Committee on Cancer gastric cancer TNM staging system: explanation and elaboration[J]. Fu Bu Wai Ke, 2017, 30(4): 241-245. DOI:10.3969/j.issn.1003-5591.2017.04.002] |
| [6] |
Altan B, Yokobori T, Mochiki E, et al. Nuclear karyopherin-α2 expression in primary lesions and metastatic lymph nodes was associated with poor prognosis and progression in gastric cancer[J]. Carcinogenesis, 2013, 34(10): 2314-2321. DOI:10.1093/carcin/bgt214 |
| [7] |
李守淼, 李军扩, 刘志强, 等. P53和Ki-67及人表皮生长因子受体2蛋白检测对进展期食管胃结合部腺癌新辅助化疗疗效的预测价值[J]. 中华胃肠外科杂志, 2015, 18(9): 901-904. [Li SM, Li JK, Liu ZQ, et al. Predictive value of P53, Ki-67, HER2 protein in neoadjuvant chemotherapy for adenocarcinoma of gastroesophageal junction[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2015, 18(9): 901-904. DOI:10.3760/cma.j.issn.1671-0274.2015.09.013] |
| [8] |
Takaya S, Saito H, Ikeguchi M. Upregulation of Immune Checkpoint Molecules, PD-1 and LAG-3, on CD4+ and CD8+ T Cells after Gastric Cancer Surgery[J]. Yonago Acta Med, 2015, 58(1): 39-44. |
| [9] |
张志忠, 李守淼, 李保中, 等. 进展期食管胃交界部腺癌患者术后腹腔热灌注化疗对血清肿瘤标志物的影响[J]. 中华普通外科杂志, 2018, 33(1): 65-67. [Zhang ZZ, Li SM, Li BZ, et al. The influence of postoperative hyperthermic intraperitoneal perfusion chemotherapy on serum tumor markers in advanced adenocarcinoma of esophagogastric junction[J]. Zhonghua Pu Tong Wai Ke Za Zhi, 2018, 33(1): 65-67. DOI:10.3760/cma.j.issn.1007-631X.2018.01.019] |
| [10] |
Saini J, Sharma PK. Clinical, Prognostic and Therapeutic Significance of Heat Shock Proteins in Cancer[J]. Curr Drug Targets, 2018, 19(13): 1478-1490. DOI:10.2174/1389450118666170823121248 |
| [11] |
Oda T, Morii E, Inoue M, et al. Prognostic significance of heat shock protein 105 in lung adenocarcinoma[J]. Mol Med Rep, 2009, 2(4): 603-607. |
| [12] |
Slaby O, Sobkova K, Svoboda M, et al. Significant overexpression of HSP110 gene during colorectal cancer progression[J]. Oncol Rep, 2009, 21(5): 1235-1241. |
| [13] |
Kimura A, Ogata K, Altan B, et al. Nuclear heat shock protein 110 expression is associated with poor prognosis and hyperthermo-chemotherapy resistance in gastric cancer patients with peritoneal metastasis[J]. World J Gastroenterol, 2017, 23(42): 7541-7550. DOI:10.3748/wjg.v23.i42.7541 |
| [14] |
刘志强, 李守淼, 张志忠, 等. 食管胃交界部腺癌术后紫杉醇腹腔热灌注化疗的安全性分析[J]. 中华普通外科杂志, 2017, 32(4): 359-360. [Liu ZQ, Li SM, Zhang ZZ, et al. Security Analysis of hyperthermic intraperitoneal perfusion chemotherapy with paclitaxel on adenocarcinoma of esophagogastric junction after radical operation[J]. Zhonghua Pu Tong Wai Ke Za Zhi, 2017, 32(4): 359-360. DOI:10.3760/cma.j.issn.1007-631X.2017.04.024] |
 2021, Vol. 48
2021, Vol. 48


