文章信息
- 原发星形细胞瘤中TP53、PDGF、EGFR的表达及与临床病理特征和预后的相关性
- Expressions of TP53, PDGF and EGFR in Primary Astrocytomas and Their Correlation with Clinicopathological Features and Prognosis
- 肿瘤防治研究, 2021, 48(2): 154-158
- Cancer Research on Prevention and Treatment, 2021, 48(2): 154-158
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0818
- 收稿日期: 2020-07-16
- 修回日期: 2020-12-07
原发星形细胞瘤(primary astrocytoma, PA)由星形胶质细胞所形成,是一种发生于中枢神经系统,呈浸润性生长的恶性肿瘤,其病因尚不明确,多缓慢进行性发展,病程可长达数年,常以癫痫为首发症状,大多数患者预后欠佳[1]。因此,早期诊断和预后判断的相关性研究对于疾病的转归具有重要作用。研究显示TP53基因、血小板源性生长因子(PDGF)、表皮生长因子受体(EGFR)是临床比较常用的癌症检测指标,对原发星形细胞瘤的起始和进展均有一定程度的影响[2-3]。但是对原发性星形细胞瘤的影响程度国内外研究尚不一致,且均未阐述TP53、PDGF及EGFR与原发性星形细胞瘤病理特征及预后的相关性[4-7]。为进一步完善患者预后判断指标,制定辅助治疗方案,本研究对90例原发星形细胞瘤患者临床病理资料进行回顾性分析,探讨TP53、PDGF、EGFR的表达与临床病理特征和预后的相关性。
1 资料与方法 1.1 一般资料根据排除标准,选取2000年1月—2015年1月衡水市人民医院收治的90例经病理确诊为原发性星形细胞瘤患者进行回顾性分析,记录患者入院时相关信息。其中男53例,女37例;≥60岁24例,< 60岁66例;依据2016年WHO指南中枢神经系统肿瘤分类第4版修订方案分为:Ⅰ期28例,Ⅱ期47例,Ⅲ期12例,Ⅳ期3例。KPS评分≥70分31例,< 70分59例。采用门诊和电话的方式随访五年,统计患者生存时间及生存率。选取20例正常脑组织样本作为对照组。排除标准:(1)患脑血管疾病(如脑缺血,脑出血、脑梗死等)者;(2)其他脑肿瘤(脑膜瘤)及癫痫等患者;(3)肝、肺、肾功能不全者;(4)未按时随访者;(5)交流障碍者;(6)患者细胞瘤组织未保存于本院病理科者;(7)经化学和放射治疗等患者。WHO分级标准: Ⅰ级:以毛细胞型星形细胞瘤为主;Ⅱ级:星形细胞瘤或星形-少突细胞瘤;Ⅲ级:间型星形细胞瘤;Ⅳ级:胶质母细胞瘤。
1.2 病理形态学观察及分级 1.2.1 制备组织切片90例星形细胞瘤患者手术切除后的肿瘤组织,用4%中性甲醛固定4~6 h后,取1.5 cm×1.5 cm×0.3 cm大小的组织块,5~10倍固定液中固定3~24 h,脱水、过夜(水洗、脱水、透明、浸蜡),石蜡包埋,3~5 μm切片,展平、烘烤。
1.2.2 免疫组织化学检测免疫组织化学SP染色,每例均选取肿瘤病例典型的蜡块,选取4 μm厚切片4张。切片经过脱蜡、水化、抗原修复后,滴加4种不同的第一抗体(GFAP、TP53、PDGF、EGFR)。按试剂盒说明书操作,温浴30~60 min后加二抗,DAB显色,苏木精对比染色,常规脱水、透明、封片。以已知含有和不含有待测抗原的组织作对照。
1.2.3 结果判读选择肿瘤组织内阳性染色密集区,400倍镜下计数500个细胞,计算阳性百分率。未发现阳性细胞为-;≤10%为+;10%~50%为++;> 50%的细胞阳性为+++。阳性标准:+或++或+++。以已知阳性表达的蛋白和阴性表达的蛋白作为阳性对照和阴性对照。
1.3 统计学方法采用SPSS19.0统计软件进行统计学处理,计数资料用百分比表示,将所有病理材料分为原发星形细胞瘤组和正常脑组织组,采用χ2检验比较两组间TP53、PDGF、EGFR阳性表达率差异性。两组间生存期比较采用Log rank检验,采用Cox回归分析分析预后的影响因素,检验水准为α=0.05。
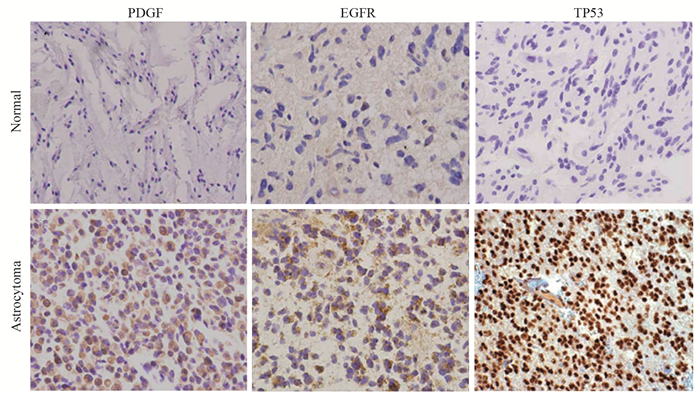
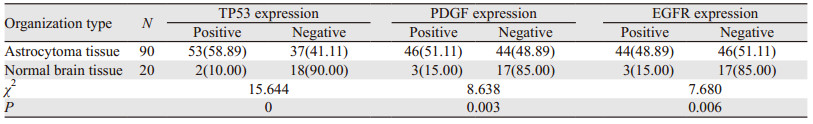
2 结果 2.1 TP53、PDGF、EGFR在原发星形细胞瘤中的表达TP53表达在细胞核,PDGF、EGFR表达在细胞质和细胞膜,TP53、PDGF、EGFR星形细胞瘤组织中阳性表达率分别为58.89%、51.11%和48.89%,阳性表达率显著高于正常脑组织,差异有统计学意义(均P < 0.05),见图 1、表 1。
|
| 图 1 TP53、PDGF、EGFR在原发星形细胞瘤和正常脑组织中的表达(IHC ×200) Figure 1 Expression of TP53, PDGF and EGFR in primary astrocytoma and normal brain tissue (IHC ×200) |
|
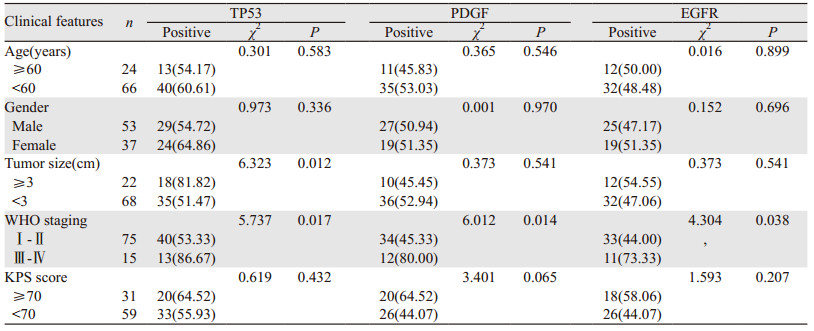
肿瘤大小≥3 cm患者TP53阳性表达率高于肿瘤大小 < 3 cm患者,WHO分期Ⅲ~Ⅳ患者TP53、PDGF、EGFR阳性表达率高于分期Ⅰ~Ⅱ患者,差异均有统计学意义(均P < 0.05),见表 2。
|
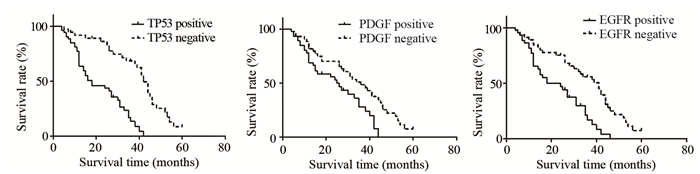
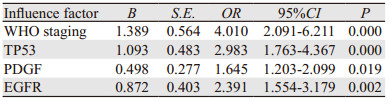
2020年1月为末次随访时间,所有患者均获得5年的随访,随访率100%。随访时间为60~89月,中位随访时间65月。分别绘制TP53、PDGF、EGFR阳性和阴性患者生存曲线并比较,TP53、PDGF、EGFR阳性表达患者的生存期均短于阴性表达患者(均P < 0.05)。进一步进行Cox回归分析,结果发现,WHO分期、TP53、PDGF、EGFR均是原发星形细胞瘤预后的影响因素,见图 2、表 3。
|
| 图 2 TP53、PDGF、EGFR阳性和阴性患者5年生存曲线 Figure 2 Five-year survival curves of patients with positive or negative expression of TP53, PDGF and EGFR |
|
原发星形细胞瘤是一种恶性程度较高的神经上皮肿瘤,预后差,并发症严重,手术切除不完全者五年生存率仅为12%[8]。而据相关国内外文献报道:原发星形细胞瘤发生率占颅内肿瘤的13%~14%,其具有高度侵袭性,常常因为与周围正常脑组织边界不清,使手术无法完整切除[9-10]。常规治疗为药物治疗、手术、放射治疗等。相关学者虽然在化学疗法、放射疗法方面获得了一定的进展,但是患者的五年生存率仍然较低[11]。TP53功能失活、PDGF受体和配体过表达、EGFR扩增等对于原发星形细胞瘤起始、进展阶段均有一定程度的影响。
3.1 TP53、PDGF、EGFR在原发星形细胞瘤中的表达研究表示,TP53激活了一个具有高度分布的肿瘤抑制功能的基因强大的转录程序,在不同的细胞环境中发挥作用,是一个重要的抑癌基因,该基因失活可导致细胞周期失调,促进原发星形细胞瘤、胃癌、乳腺癌等发生[12-13]。TP53突变可见于大部分星形细胞瘤[12]。PDGF及其受体在包括神经元祖细胞、神经元、星形胶质细胞和少突胶质细胞在内的多种细胞类型中均有表达。PDGF介导的信号转导在中枢神经系统中调节多种功能,如神经发生、细胞存活等,且在血管生成中起关键作用,在原发星形细胞瘤中大多过表达[14]。EGFR基因在很多恶性肿瘤中呈明显的扩增、突变和过表达。EGFR扩增在星形细胞瘤中也是比较常见的,近期研究表明这是原发性胶质母细胞瘤的标志[15]。本研究结果显示:TP53表达在细胞核,PDGF、EGFR表达在细胞质和细胞膜。原发性星形细胞瘤组织中TP53、PDGF和EGFR阳性表达率均显著高于正常脑组织。三者的变化可能与原发性星形细胞瘤的发生、增殖和侵袭等相关。
3.2 TP53、PDGF、EGFR表达与原发星形细胞瘤临床病理特征的关系通过观察患者样本临床病理特征和TP53、PDGF、EGFR的阳性表达,结果显示:肿瘤大小≥3 cm患者TP53阳性表达率高于肿瘤大小 < 3cm患者。WHO分期Ⅲ~Ⅳ患者TP53、PDGF、EGFR阳性表达率高于分期Ⅰ~Ⅱ患者。根据研究报告, 40%~60%的原发性星形细胞瘤存在TP53基因突变[16]。TP53突变主要通过影响细胞周期促进癌细胞增殖和侵袭。因此,TP53突变在肿瘤大小和分级中存在差异性。PDGF通过PI-3K和PLC-γ通路诱导胶质瘤细胞的侵袭和扩散,生长因子及其受体的高表达可能刺激血管生成[17],对肿瘤扩增、侵袭等有较大影响,因此PDGF阳性表达率在不同肿瘤分期间具有差异性。EGFR主要作用于胞外信号调节激酶以及三磷酸肌醇激酶途径, 是细胞增殖和存活的促进剂,与患者肿瘤分期息息相关,因而EGFR阳性表达率在不同肿瘤分期间具有差异性[18]。
3.3 TP53、PDGF、EGFR表达与原发星形细胞瘤预后的关系随访5年后发现,入院时TP53、PDGF、EGFR阳性表达患者的生存期均短于阴性表达患者。进一步进行Cox回归分析,结果发现,WHO分期、TP53、PDGF、EGFR均是原发星形细胞瘤预后的影响因素。据相关文献报道:TP53阳性表达通常为原发性星形细胞瘤预后不良的标志,但是对于复发性星形细胞瘤预后较好,目前机制不明[19]。PDGF、EGFR阳性表达对原发星形细胞瘤进展期有较大的影响,因此,通常PDGF、EGFR高表达与预后有一定的影响。而WHO分期是对肿瘤恶性程度的综合判断,分期越高,恶性程度越高,预后越差。
综上所述,TP53、PDGF、EGFR在原发星形细胞瘤中高表达,且与肿瘤进展密切相关。且TP53、PDGF、EGFR阳性表达、WHO分期均是影响患者预后的因素。临床上可以通过TP53、PDGF、EGFR检测和WHO分期判断患者预后,计划适宜的治疗方案。然而,关于TP53、PDGF、EGFR是否存在关联还有待进一步研究。
作者贡献:
孙晓玲:实验设计、实验实施、文章写作
张晓娟、张清泉、邱雷、王林娜:实验评估
侯素平:文章审校
| [1] |
中国脑胶质瘤协作组, 中国医师协会脑胶质瘤专业委员会. 唤醒状态下切除脑功能区胶质瘤手术技术指南(2018版)[J]. 中国微侵袭神经外科杂志, 2018, 23(8): 383-388. [Chinese Glioma Collaboration Group, Glioma Professional Committee of Chinese Medical Association. Surgical technical guidelines for resection of gliomas in functional areas of the brain under wakefulness (2018 edition)[J]. Zhongguo Wei Qin Xi Shen Jing Wai Ke Za Zhi, 2018, 23(8): 383-388.] |
| [2] |
孙晓玲, 张晓娟, 张清泉, 等. TP53、EGFR、PDGF在星形胶质细胞瘤进展中的表达及意义[J]. 广东医学, 2019, 40(12): 1750-1753. [Sun XL, Zhang XJ, Zhang QQ, et al. Expression and significance of TP53, EGFR and PDGF in the progression of astrocytoma[J]. Guangdong Yi Xue, 2019, 40(12): 1750-1753.] |
| [3] |
Christians A, Adel-Horowski A, Banan R, et al. The prognostic role of IDH mutations in homogeneously treated patients with anaplastic astrocytomas and glioblastomas[J]. Acta Neuropathol Commun, 2019, 7(1): 156. DOI:10.1186/s40478-019-0817-0 |
| [4] |
Azar S, Leventoux N, Ripoll C, et al. Cellular and molecular characterization of IDH1-mutated diffuse low grade gliomas reveals tumor heterogeneity and absence of EGFR/PDGFRα activation[J]. Glia, 2018, 66(2): 239-255. DOI:10.1002/glia.23240 |
| [5] |
李乐, 何正文. 胶质瘤预后相关分子遗传学研究进展[J]. 肿瘤学杂志, 2017, 23(10): 858-862. [Li L, He ZW. Progress on Genetic and molecular Researches related to prognosis of glioma[J]. Zhong Liu Xue Za Zhi, 2017, 23(10): 858-862.] |
| [6] |
Donovan M, Colomer A, Puig P, et al. MC13-0051 Molecular characterization of anaplastic astrocytoma and glioblastoma multiforme: PTEN loss in conjunction with EGFR alterations predicts response to therapy[J]. European J Cancer, 2013, 49(supp 4): S26. |
| [7] |
邓春娥. EGFR、PI3K、PTEN在人脑胶质瘤中的表达及临床意义分析[D]. 昆明医科大学, 2016. [Deng CE. Expression and clinical significance of EGFR, PI3K and PTEN in human glioma[D]. Kunming Yi Ke Da Xue, 2016.]
|
| [8] |
付强, 陈培培, 李绍山, 等. p-AKT和PI3K与星形细胞瘤患者的临床病理学特征及预后的关系[J]. 川北医学院学报, 2018, 33(6): 828-831. [Fu Q, Chen PP, Li SS, et al. Relationship between p-Akt and PI3K and clinicopathological characteristics and prognosis of astrocytoma patients[J]. Chuan Bei Yi Xue Yuan Xue Bao, 2018, 33(6): 828-831.] |
| [9] |
孔德生, 夏晴, 李凯, 等. 脊髓毛细胞型星形细胞瘤的临床特点和治疗效果[J]. 华西医学, 2018, 33(6): 709-713. [Kong DS, Xia Q, Li K, et al. Clinical characteristics and therapeutic effect of spinal cord pilocytic astrocytoma[J]. Hua Xi Yi Xue, 2018, 33(6): 709-713.] |
| [10] |
Basheer A, Rammo R, Kalkanis S, et al. Multifocal Intradural Extramedullary Pilocytic Astrocytomas of the Spinal Cord: A Case Report and Review of the Literature[J]. Neurosurgery, 2017, 80(2): E178-E184. DOI:10.1093/neuros/nyw029 |
| [11] |
张治元, 王汉东, 樊友武, 等. 多形性黄色星形细胞瘤的诊断与治疗(附22例分析)[J]. 中国临床神经外科杂志, 2017, 22(12): 801-803. [Zhang ZY, Wang HD, Fan YW, et al. Diagnosis and treatment of pleomorphic xanthocytoma: a report of 22 cases[J]. Zhongguo Lin Chuang Shen Jing Wai Ke Za Zhi, 2017, 22(12): 801-803.] |
| [12] |
Andrysik Z, Galbraith MD, Guarnieri AL, et al. Identification of a core TP53 transcriptional program with highly distributed tumor suppressive activity[J]. Genome Res, 2017, 27(10): 1645-1657. DOI:10.1101/gr.220533.117 |
| [13] |
Mukhopadhyay UK, Oturkar CC, Adams C, et al. TP53 Status as a Determinant of Pro- vs. Anti-Tumorigenic Effects of Estrogen Receptor-Beta in Breast Cancer[J]. J Natl Cancer Inst, 2019, 111(11): 1202-1215. DOI:10.1093/jnci/djz051 |
| [14] |
Sil S, Periyasamy P, Thangaraj A, et al. PDGF/PDGFR axis in the neural systems[J]. Mol Aspects Med, 2018, 62: 63-74. DOI:10.1016/j.mam.2018.01.006 |
| [15] |
Mishra R, Hanker AB, Garrett JT. Genomic alterations of ERBB receptors in cancer: clinical implications[J]. Oncotarget, 2017, 8(69): 114371-114392. DOI:10.18632/oncotarget.22825 |
| [16] |
魏书洋, 蒋广元, 李瑛. 脑胶质瘤基因诊断的研究进展[J]. 世界最新医学信息文摘, 2018, 18(3): 21-22, 25. [Wei SY, Jiang GY, Li Y. Research progress in gene diagnosis of glioma[J]. Shi Jie Zui Xin Yi Xue Xin Xi Wen Zhai, 2018, 18(3): 21-22, 25.] |
| [17] |
武明花, 王洁如, 李桂源. 原发性脑瘤的分子遗传学研究进展[J]. 国际病理科学与临床杂志, 2007, 27(3): 223-226. [Wu MH, Wang JR, Li GY. Molecular genetics of primary brain tumors[J]. Guo Ji Bing Li Ke Xue Yu Lin Chuang Za Zhi, 2007, 27(3): 223-226.] |
| [18] |
Randriarimanana T, Chateau A, Faivre B, et al. Sensitivity of glioma initiating cells to a monoclonal anti-EGFR antibody therapy under hypoxia[J]. Life Sci, 2015, 137: 74-80. DOI:10.1016/j.lfs.2015.07.024 |
| [19] |
Patil Vikas, Mahalingam Kulandaivelu. Comprehensive analysis of Reverse Phase Protein Array data reveals characteristic unique proteomic signatures for glioblastoma subtypes[J]. Gene, 2019, 685: 85-95. DOI:10.1016/j.gene.2018.10.069 |
 2021, Vol. 48
2021, Vol. 48
