文章信息
- 大波斯菊苷抗肝癌活性及作用机制
- Anti-hepatocellular Carcinoma Activity and Related Mechanism of Apigenin-7-O-Glucoside
- 肿瘤防治研究, 2021, 48(3): 248-254
- Cancer Research on Prevention and Treatment, 2021, 48(3): 248-254
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0796
- 收稿日期: 2020-07-13
- 修回日期: 2020-10-20
2. 130012 长春,吉林大学生命科学学院;
3. 130021 长春,吉林大学第一医院发育行为儿科
2. School of Life Sciences, Jilin University, Changchun 130012, China;
3. Department of Pediatrics of Developmental Behavior, First Hospital of Jilin University, Changchun 130021, China
肝癌是一种常见的恶性肿瘤,具有高患病率和高死亡率的特点。2018年,肝癌已成为全球癌症相关死亡的主要原因,每年约有841 000例新增确诊患者和782 000例死亡患者[1]。目前,早期预防手段主要是接种乙肝疫苗,而发病后的治疗手段主要包括手术切除、放射疗法和化学疗法等,但未能从根本上预防和阻止肝癌的发展[2]。
大波斯菊苷(Apigenin-7-O-Glucoside, AGL)是一种具有黄酮类结构的化合物,可从贡菊、律草等多种药用植物中分离得到[3]。目前的研究表明,AGL具有抗氧化、抗菌和抗病毒等作用,还能够抑制HepG2细胞的增殖[4-5],但其抗肝癌活性的相关机制未见报道。AGL虽未被应用于临床治疗,但从植物中分离得到的天然活性成分具有药理作用强、毒副作用小的特点。因此,本研究在体外探究AGL对Huh7肝癌细胞增殖和凋亡的影响及其作用机制,同时,在体内进一步验证AGL对Huh7细胞荷瘤小鼠肿瘤进展的影响,拟为AGL用于肝癌的临床治疗提供思路和实验依据。
1 材料与方法 1.1 材料和试剂AGL(578-74-5)购自上海纯优生物科技有限公司;Huh7细胞(YB-ATCC-2811)购自上海钰博生物科技有限公司;BALB/c裸鼠(SPF级,雄性)购自北京维通利华实验动物技术有限公司,实验动物伦理批号为SYXK-(JI)20190012;Dulbecco改良的Eagle培养基(DMEM),胎牛血清(FBS)购自美国Gibco公司;细胞计数试剂盒(CCK-8,40203ES60)购自上海翊圣生物科技有限公司;线粒体膜电位检测试剂盒(JC-1, T4069)、2', 7'-二氯荧光黄双乙酸盐(DCFH-DA, D6883)购自美国Sigma公司;Muse® Oxidative Stress Kit购自美国Millipore公司;细胞组织裂解液(RIPA, P0013B)购自上海碧云天生物技术有限公司;BCA蛋白定量试剂盒(23225)购自美国Thermo Scientific公司;辣根过氧化物酶化学发光剂(ECL, WBKlS0100)购自美国Millipore公司;B淋巴瘤-2基因(Bcl-2, ab32124)、Bcl-2关联X蛋白(Bax, ab32503)、Bcl-2关联死亡启动子(Bad, ab129192)、重组人B细胞淋巴瘤因子2-xL(Bcl-xL, ab32370)、裂解的(Cleaved)含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3(ab2302)、Cleaved Caspase-9(ab2324)、磷酸化的(p)-NF-κB(ab86299)、总(T)-NF-κB(ab7970)、p-IKKα/β(ab195907)、T-IKKα/β(ab178870)、p-核因子κB的抑制蛋白α(IκBα, ab12135)、T-IκBα(ab32518)及3-磷酸甘油醛脱氢酶(GAPDH, ab8245)均购自美国Abcam公司;小鼠IL-2(MM-0701M1)、IL-6(MM-0163M1)、IL-10(MM-0176M1)、肿瘤坏死因子-α(TNF-α, MM-0132M1)ELISA试剂盒购自江苏科特生物科技有限公司。
1.2 仪器与设备多功能酶标仪(SYNERGY4)购自美国BIOTEK公司;高速离心机(MiniSpin)购自德国Eppendorf公司;荧光倒置显微镜(CKX41)购自日本OLYMPUS公司;Muse细胞分析仪(Muse)购自美国MIILLIPORE;凝胶成像系统(BioSpectrum 600)购自美国UVP公司。
1.3 细胞培养Huh7细胞采用含有10% FBS的DMEM培养基、于37℃、含5%CO2的培养箱中培养。当细胞长至80%时进行传代。
1.4 细胞活力检测细胞长至80%时传代,收集细胞悬液,并将Huh7细胞以8×103个/孔的密度接种于96孔板,于培养箱中培养24 h后,更换培养液。将细胞分为空白对照组(CTRL)、10、20、40、60、80和100 μmol/L AGL处理组,每组设置6个复孔。空白对照组加入含0.1% DMSO的DMEM基础培养基,AGL处理组使用DMSO溶解并用DMEM基础培养基稀释(DMSO浓度不高于0.1%),将稀释后的药品加入96孔板中,孵育24 h。每孔中加入10 μl的CCK-8试剂,培养箱中孵育2 h后,450 nm波长下使用酶标仪测定吸光度值,并计算细胞存活率。
1.5 线粒体膜电位检测细胞长至80%时传代,收集细胞悬液,并将Huh7细胞以2×105个/孔的密度接种在6孔板中,培养24 h后,将细胞分为空白对照组(CTRL)、25和50 μmol/L AGL处理组。孵育12 h后,弃去培养液,并使用温育后的磷酸盐缓冲溶液(PBS)清洗细胞,在避光条件下加入10 μg/ml的JC-1染液,培养箱中孵育10 min,PBS清洗,荧光显微镜观察荧光强度。
1.6 活性氧水平检测细胞长至80%时传代,收集细胞悬液,并将Huh7细胞以2×105个/孔接种在6孔板中,培养24 h后,细胞分组及处理方案同1.5。孵育12 h后,弃培养液,PBS清洗,在避光条件下加入2 μmol/L的DCFH-DA探针溶液,培养箱中孵育15 min,PBS清洗。在荧光酶标仪上使用488 nm的激发波长和525 nm的发射波长,检测各组细胞的活性氧(ROS)含量。
细胞长至80%时传代,收集细胞悬液,并将Huh7细胞以将2×105个/孔的密度接种在6孔板中,培养24 h。细胞分组及处理方案同1.5。孵育12 h后,收集细胞,PBS冲洗沉淀2次,避光加入Muse®氧化应激染液(Muse® Oxidative Stress Reagent),室温孵育20 min,Muse细胞分析仪分析细胞内ROS含量变化。
1.7 细胞凋亡检测细胞长至80%时传代,收集细胞悬液,并将Huh7细胞以5×104个/孔的密度接种在24孔板,培养24 h。细胞分组及处理方案同1.5。孵育12 h后,收集细胞,PBS冲洗细胞沉淀2次,避光加入含有碘化丙啶(PI)和膜联蛋白V(Annexin)的染液,室温孵育20 min后,Muse细胞分析仪进行分析。
1.8 蛋白质印迹法细胞长至80%时传代,收集细胞悬液,并将Huh7细胞以2×105个/孔的密度接种在6孔板中,培养24 h后,以1.5中的方案进行分组给药。孵育24 h后,加入100 μl含有1%蛋白酶抑制剂和2%苯甲基磺酰氟(PMSF)的RIPA裂解液,在冰上裂解10 min。BCA蛋白检测试剂盒对各组别的蛋白含量进行检测,并将蛋白定量至40 μg。12%的聚丙烯酰胺凝胶电泳分离不同分子量的蛋白,并将其转移至PVDF膜上。5%牛血清白蛋白(BSA)4℃封闭4 h,将膜分别与Bax、Bad、Bcl-xL、Bcl-2、Cleaved Caspase-3、Cleaved Caspase-9、p-NF-κB、T-NF-κB、p-IKKα/β、T-IKKα/β、p-IκBα、T-IκBα和GAPDH抗体孵育过夜,再与辣根过氧化物酶偶联的二抗孵育4 h。使用ECL检测试剂盒和凝胶成像仪对条带进行显色,并使用Image J软件进行定量分析。
1.9 异种移植肿瘤小鼠模型的建立将30只5周龄雄性BALB/c裸鼠于无菌环境中饲养。适应性饲养一周后,将8×107/ml的Huh7细胞接种至裸鼠的背部右后方。当接种的肿瘤体积达到150 mm3左右时,将小鼠随机分为三组,分别为空白对照组(n=10,腹腔注射含0.1%DMSO的0.9%氯化钠溶液)、低剂量给药组(n=10,腹腔注射含0.1%DMSO的10 mg/kg AGL)和高剂量给药组(n=10,腹腔注射含0.1%DMSO的20 mg/kg AGL)。给药共持续14天,每两天给药一次并测量体重和瘤体积。在最后一次给药后,麻醉小鼠并拍照。待小鼠苏醒后,眼眶静脉丛取血,随后使小鼠安乐死,收集肿瘤组织进行拍照,收集肝脏、脾脏和肾脏组织固定于福尔马林液体中,用于后续的组织病理学检查。
1.10 组织病理学检测将固定后的肝脏、脾脏和肾脏包埋在石蜡中,使用切片机切割5 μm厚的石蜡切片,采用苏木精-伊红染液进行染色,并在显微镜下进行观察。
1.11 酶联免疫吸附测定(ELISA)收集小鼠外周血,3 000 r/min离心10 min,将吸取的上清液再次3 000 r/min离心5 min,收集上清液。按照ELISA说明书对血清中IL-2、IL-6、IL-10和TNF-α的水平进行检测。
1.12 统计学方法实验数据使用SPSS 16.0软件进行ANOVA分析和Tukey’s检测,结果采用均值±标准差。P < 0.05为差异有统计学意义。
2 结果 2.1 AGL通过影响Huh7细胞的线粒体功能诱导肝癌细胞凋亡 2.1.1 AGL对Huh7细胞活力的影响AGL处理24 h后,Huh7细胞的半数抑制浓度约为50 μmol/L(P < 0.001),随着AGL浓度的增加,细胞活力下降,表明大波斯菊苷具有抑制肝癌Huh7细胞增殖的能力,见图 1。
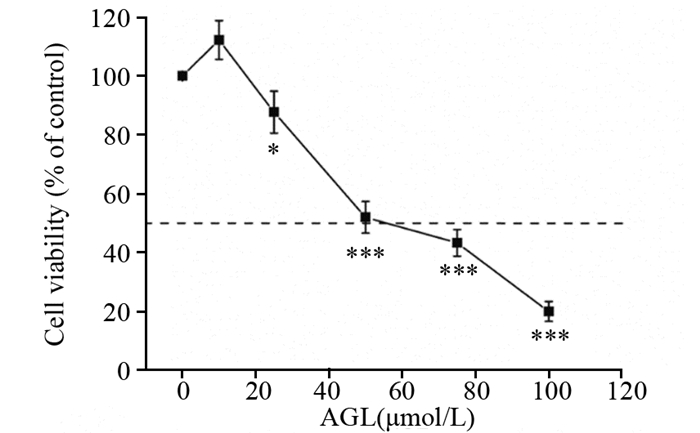
|
| AGL: apigenin-7-O-glucoside; *: P < 0.05, ***: P < 0.001, compared with control group. 图 1 大波斯菊苷对Huh7细胞活力的影响 Figure 1 Effects of AGL on viability of Huh7 cells |
与空白对照组相比,不同浓度的AGL处理后,Huh7细胞开始出现绿色荧光,尤其在50 μmol/L AGL处理后,绿色荧光的比例显著增加,荧光定量分析结果也显示,不同浓度的AGL处理能够显著降低红/绿荧光的比率(P < 0.001),见图 2。说明AGL可以降低Huh7细胞的线粒体膜电位,促进细胞凋亡。

|
| ***: P < 0.001, compared with Control group. 图 2 大波斯菊苷对Huh7细胞线粒体膜电位的影响 Figure 2 Effects of AGL on mitochondrial membrane potential of Huh7 cells |
荧光酶标仪检测结果显示,与空白对照组相比,AGL处理组的吸光度值显著升高,即Huh7细胞内ROS的水平显著升高(P < 0.001)。随着给药浓度的增加,荧光强度逐渐增强,见图 3A;进一步通过流式细胞术检测细胞内ROS的积累情况,不同浓度AGL处理后均能显著升高Huh7肝癌细胞内的ROS积累(P < 0.001),见图 3B。说明大波斯菊苷能够促进细胞凋亡。

|
| ***: P < 0.001, compared with Control group. 图 3 荧光酶标仪(A)和流式细胞术(B)分析大波斯菊苷对Huh7细胞内ROS水平的影响 Figure 3 Effects of AGL on ROS levels in Huh7 cells analyzed via fluorescence microplate reader (A) and flow cytometry (B) |
空白对照组的细胞凋亡率为7.78%,经过25和50 μmol/L的AGL处理后,Huh7肝癌细胞的凋亡率分别增加至12.94%和25.23%(均P < 0.001),说明AGL能够明显增加Huh7细胞的凋亡率,促进肝癌细胞凋亡,见图 4。

|
| ***: P < 0.001, compared with Control group. 图 4 大波斯菊苷对Huh7细胞凋亡的影响 Figure 4 Effects of AGL on apoptosis of Huh7 cells |
与空白对照组相比,AGL能够增加促凋亡蛋白Bax和Bad的水平,降低抗凋亡蛋白Bcl2和Bcl-xL的水平,同时增加了Cleaved Caspase-3和Cleaved Caspase-9的水平,说明大波斯菊苷能够调控细胞中抗凋亡和促凋亡蛋白的表达水平,进而促进Huh7细胞凋亡,见图 5A。
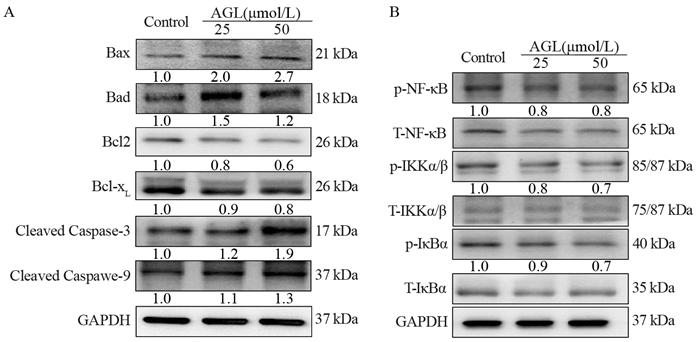
|
| T: total; p: phosphorylated. 图 5 大波斯菊苷对Huh7细胞内蛋白表达的影响 Figure 5 Effects of AGL on protein expression of Huh7 cells |
与空白对照组相比,不同浓度的AGL处理均能够降低NF-κB、IKKα/β和IκBα的磷酸化水平,延缓肿瘤的发展,见图 5B。
2.3 AGL对Huh7荷瘤小鼠生理病理状态的影响 2.3.1 对小鼠肿瘤生长的影响与空白对照组相比,AGL处理后能够降低Huh7荷瘤小鼠肿瘤的增长速度,肿瘤体积显著减小(P < 0.05)。而在空白对照组和AGL处理组之间,小鼠的体重并无显著变化,见图 6。
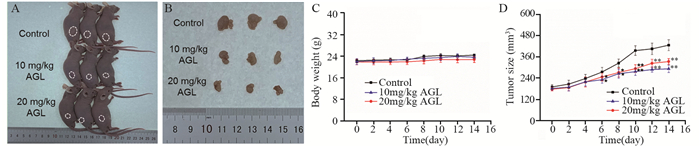
|
| *: P < 0.05, **: P < 0.01, compared with Control group. 图 6 大波斯菊苷对Huh7细胞荷瘤裸鼠体重和瘤体积的影响 Figure 6 Effects of AGL on body weight and tumor volume of Huh7-xenograft tumor nude mice |
进一步通过HE染色观察小鼠的肝脏、脾脏和肾脏的病理变化。在空白对照组与AGL处理组小鼠的肝脏和脾脏中均未见水肿和炎性浸润,肾脏中无肾小球病变,各脏器中的细胞排列整齐、状态良好且未发现炎性浸润,说明AGL对小鼠的脏器组织无明显的毒副作用,见图 7。

|
| 图 7 大波斯菊苷对Huh7细胞荷瘤裸鼠肝脏、脾脏和肾脏的影响(HE ×200) Figure 7 Effects of AGL on liver, spleen and kidney of Huh7-xenograft tumor nude mice (HE ×200) |
与空白对照组小鼠相比,AGL处理组小鼠血清中IL-6和TNF-α的含量显著降低(P < 0.05),同时IL-2和IL-10的含量升高(P < 0.01),其中20 mg/kg AGL对这四种因子的调节作用更加显著(P < 0.01),见表 1。
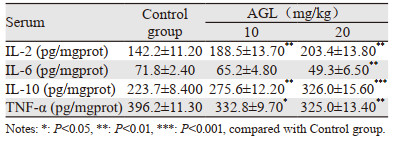
|
大波斯菊苷是一类具有黄酮类葡糖苷结构的单体药物,研究报道其可抑制癌细胞生长、真菌生长、细胞内和细胞外活性氧的生成,引起细胞停滞和质膜损伤[6]。在民间医学中,大波斯菊苷常被用于治疗肝功能异常(肝炎和黄疸)的患者[7]。据报道,大波斯菊苷能够通过TLR4/NF-κB的失活和Nrf2信号通路的增强来阻断炎性反应和氧化应激,改善脂多糖诱导的小鼠急性中耳炎[8]。大波斯菊苷能够通过PI3K/AKT/mTOR途径诱导AGS胃癌细胞的G2/M期细胞周期停滞、外源性凋亡和自噬细胞死亡,这可能会抑制胃癌的发展[9]。但是,大波斯菊苷在Huh7肝癌细胞中的作用以及机制鲜见报道。因此,本研究旨在探索大波斯菊苷在肝癌发展中的作用及其机制,以期发现新的治疗肝癌的药物。
细胞的死亡主要分为两种类型:坏死和凋亡。诱导肿瘤细胞凋亡被认为是治疗癌症的有效策略。大量研究表明,细胞的凋亡可以由聚集在线粒体上的多种促凋亡因子刺激而触发,从而引起线粒体去极化、细胞色素c的释放以及胱天蛋白酶的激活[10]。在线粒体介导的凋亡内在途径中,细胞色素c从受损的线粒体中释放出来,使Caspase-9活化,随后激活下游Caspase-3蛋白,起到级联放大作用,最终使多聚ADP核糖聚合酶(PARP)失活,诱导细胞凋亡[11]。在活细胞中,Bcl-2和Bcl-xL与促细胞凋亡家族成员的BH3结构域结合,从而抑制细胞凋亡[12]。Bad基因编码的蛋白质与Bcl-xL和Bcl-2形成异源二聚体,并逆转它们的死亡抑制活性,因此启动细胞凋亡[13]。本研究证实,大波斯菊苷能够引起线粒体上的多种促凋亡刺激来触发Huh7细胞的凋亡。
肝癌与由不同病因引起的慢性炎性反应和肝脏的纤维化有关。IL-6是参与肝脏炎性反应的关键因素之一,在炎性反应中,IL-6通过控制肝急性期反应而充当激活剂,可以激活多种途径,包括Janus激酶(JAK)/信号转导和转录激活剂(STAT)、p38丝裂原活化蛋白激酶(MAPK)、细胞外信号调节激酶(ERK)和磷酸肌醇3激酶[14]。IL-10能够抑制TNF-α和IL-23的富集,可以通过抑制T细胞和巨噬细胞促炎细胞因子的表达来限制炎性反应的程度[15]。IL-2可以诱导自然杀伤细胞并增强其溶细胞作用,促进去除自身反应性细胞和维持体内平衡所需的许多其他免疫系统成分,激活单核-巨噬细胞,增强对肿瘤的杀伤作用[16]。TNF-α能够通过调节E-钙黏蛋白和波形蛋白的表达增强肿瘤细胞的上皮-间质转化,促进肿瘤细胞的增殖[17]。本研究结果显示,大波斯菊苷能够增加小鼠血清中IL-2和IL-10的水平,同时降低IL-6和TNF-α的水平,减缓炎性反应的发展。
肝脏的慢性炎性反应会损伤肝上皮细胞,引起脱氧核糖核酸(DNA)的损伤,增加基因组DNA突变的频率。当高细胞增殖率和DNA突变结合在一起时,肝脏炎性反应的恶性转化率便会大大增加[18]。促炎细胞因子的自分泌和旁分泌引起的慢性炎性反应会激活IκB激酶(IKK)的活性并导致核因子-κB(NF-κB)的组成性激活[19]。现有证据表明,NF-κB的活化可能是肝癌发生过程中的主要致癌驱动因素,这为选择肝癌治疗的分子靶标提供了思路[19]。NF-κB作为一种核转录因子,可以被多种刺激激活,包括生长因子、细胞因子、淋巴因子、紫外线等,被认为是应激反应的一部分[20]。在正常情况下,NF-κB以无活性的状态与IκB结合,广泛存在于细胞质中[21]。在TNF-α和IL-1β等因子的异常存在下,IKK复合物被激活,IKK作为IκB的激酶,能够进一步磷酸化IκB蛋白并触发IκB的泛素化和降解,从而释放p50/p65异二聚体,使NF-κB易位至细胞核,引起下游基因的转录[22]。NF-κB在肝癌中激活后,能够促进癌症的发展和化学抗性,因此,寻找抑制NF-κB活性的药物可能为抗癌治疗提供新的思路[23-24]。
综上所述,在Huh7细胞中,大波斯菊苷能够通过影响线粒体功能进而诱导肝癌细胞的凋亡,该过程可能与NF-κB途径相关;同时大波斯菊苷抑制肝癌发展的效果也进一步在Huh7细胞荷瘤裸鼠中得到证实,本研究结果将为开发大波斯菊苷作为抗肝癌药物提供思路和一定的数据支持。
作者贡献
胡馨予:实验设计和实施,数据整理,撰写文章
董睿陶:协助实验的实施及数据整理
李志平:协助实验的实施
杜琳:对数据和结果进行分析
刘艳:提供基金支持,指导实验设计,修改文章
| [1] |
Liu Z, Mao X, Jiang Y, et al. Changing trends in the disease burden of primary liver cancer caused by specific etiologies in China[J]. Cancer Med, 2019, 8(12): 5787-5799. DOI:10.1002/cam4.2477 |
| [2] |
Tang B, Tang F, Wang Z, et al. Upregulation of Akt/NF-κB-regulated inflammation and Akt/Bad-related apoptosis signaling pathway involved in hepatic carcinoma process: suppression by carnosic acid nanoparticle[J]. Int J Nanomedicine, 2016, 11: 6401-6420. DOI:10.2147/IJN.S101285 |
| [3] |
陈再兴, 陈佳琪, 朱旭, 等. 不同季节的葎草中木犀草素-7-O-β-D-葡萄糖苷和大波斯菊苷的含量测定[J]. 天津中医药, 2010, 27(1): 74-76. [Chen ZX, Chen JQ, Zhu X, et al. Determination of Luteolin-7-O-β-D-glucoside and cosmosiin in Humulus scandens in different seasons[J]. Tianjin Zhong Yi Yao, 2010, 27(1): 74-76.] |
| [4] |
甘秀海, 梁志远, 姜金仲. 冷水花抗菌活性成分研究[J]. 中国药学杂志, 2014, 49(23): 2069-2072. [Gan XH, Liang ZY, Jiang JZ. Antibacterial Constituents of Pilea notata C. H. Wright[J]. Zhongguo Yao Xue Za Zhi, 2014, 49(23): 2069-2072.] |
| [5] |
陈再兴, 祝妍, 王星, 等. 葎草中黄酮类成分的分离鉴定及对HepG2细胞的抑制作用[J]. 中国药师, 2016, 19(2): 267-270. [Chen ZX, Zhu Y, Wang X, et al. Determination of Luteolin-7-O-β-D-glucoside and cosmosiin in Humulus scandens in different seasons[J]. Zhongguo Yao Shi, 2016, 19(2): 267-270. DOI:10.3969/j.issn.1008-049X.2016.02.018] |
| [6] |
Abugri DA, Witola WH. Interaction of apigenin-7-O-glucoside with pyrimethamine against Toxoplasma gondii growth[J]. J Parasit Dis, 2020, 44(1): 221-229. DOI:10.1007/s12639-019-01185-5 |
| [7] |
Lucas BB, Joicy SD, Denise BS, et al. Apigenin-7-O-glucoside oxidation catalyzed by P450-bioinspired systems[J]. J Inorg Biochem, 2017, 170: 117-124. DOI:10.1016/j.jinorgbio.2017.02.016 |
| [8] |
Guo H, Li M, Xu LJ. Apigetrin treatment attenuates LPS-induced acute otitis media though suppressing inflammation and oxidative stress[J]. Biomed Pharmacother, 2019, 109: 1978-1987. DOI:10.1016/j.biopha.2018.07.022 |
| [9] |
Seong MK, Preethi V, Sang EH, et al. Apigetrin induces extrinsic apoptosis, autophagy and G2/M phase cell cycle arrest through PI3K/AKT/mTOR pathway in AGS human gastric cancer cell[J]. J Nutr Biochem, 2020, 83: 108427. DOI:10.1016/j.jnutbio.2020.108427 |
| [10] |
Li P, Nijhawan D, Budihardjo I, et al. Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates an apoptotic protease cascade[J]. Cell, 1997, 91(4): 479-489. DOI:10.1016/S0092-8674(00)80434-1 |
| [11] |
Zhang C, Jia X, Bao J, et al. Polyphyllin Ⅶ induces apoptosis in HepG2 cells through ROS-mediated mitochondrial dysfunction and MAPK pathways[J]. BMC Complement Altern Med, 2016, 16: 58. |
| [12] |
Naseri MH, Mahdavi M, Davoodi J, et al. Up regulation of Bax and down regulation of Bcl2 during 3-NC mediated apoptosis in human cancer cells[J]. Cancer Cell Int, 2015, 15: 55. DOI:10.1186/s12935-015-0204-2 |
| [13] |
Borhani N, Manoochehri M, Gargari SS, et al. Decreased Expression of Proapoptotic Genes Caspase-8- and BCL2-Associated Agonist of Cell Death (BAD) in Ovarian Cancer[J]. Clin Ovar Other Gynecol Cancer, 2015, 7(1-2): 18-23. |
| [14] |
Kong L, Zhou Y, Bu H, et al. Deletion of interleukin-6 in monocytes/macrophages suppresses the initiation of hepatocellular carcinoma in mice[J]. J Exp Clin Cancer Res, 2016, 35(1): 131. DOI:10.1186/s13046-016-0412-1 |
| [15] |
Li X, Lu P, Li B, et al. Interleukin 2 and interleukin 10 function synergistically to promote CD8(+) T cell cytotoxicity, which is suppressed by regulatory T cells in breast cancer[J]. Int J Biochem Cell Biol, 2017, 87: 1-7. DOI:10.1016/j.biocel.2017.03.003 |
| [16] |
曲洪林, 李笑岩, 袁文丹, 等. 大鼠肝癌发生过程中血清白细胞介素-2的检测及意义[J]. 黑龙江科技信息, 2015(33): 93-94. [Qu HL, Li XY, Yuan WD, et al. Detection and significance of serum interleukin-2 during the development of liver cancer in rats[J]. Heilongjiang Ke Ji Xin Xi, 2015(33): 93-94. DOI:10.3969/j.issn.1673-1328.2015.33.089] |
| [17] |
Yamauchi Y, Kohyama T, Takizawa H, et al. Tumor necrosis factor-alpha enhances both epithelial-mesenchymal transition and cell contraction induced in A549 human alveolar epithelial cells by transforming growth factor-beta1[J]. Exp Lung Res, 2010, 36(1): 12-24. DOI:10.3109/01902140903042589 |
| [18] |
Yang YM, Kim SY, Seki E. Inflammation and Liver Cancer: Molecular Mechanisms and Therapeutic Targets[J]. Semin Liver Dis, 2019, 39(1): 26-42. DOI:10.1055/s-0038-1676806 |
| [19] |
Czauderna C, Castven D, Mahn FL, et al. Context-Dependent Role of NF-κB Signaling in Primary Liver Cancer-from Tumor Development to Therapeutic Implications[J]. Cancers(Basel), 2019, 11(8): 1053. |
| [20] |
Liu T, Wei R, Zhang Y, et al. Association between NF-κB expression and drug resistance of liver cancer[J]. Oncol Letters, 2019, 17(1): 1030-1034. |
| [21] |
Zhu W, Zhao Y, Zhou J, et al. Monoacylglycerol lipase promotes progression of hepatocellular carcinoma via NF-κB-mediated epithelial-mesenchymal transition[J]. J Hematol Oncol, 2016, 9(1): 127. DOI:10.1186/s13045-016-0361-3 |
| [22] |
Zhang X, Wang Y, Li X, et al. The anti-carcinogenesis properties of erianin in the modulation of oxidative stress-mediated apoptosis and immune response in liver cancer[J]. Aging (Albany NY), 2019, 11(22): 10284-10300. |
| [23] |
朱亚玲, 易峰涛, 丁梦南, 等. 冻融治疗后肝癌库普弗细胞分泌功能的变化[J]. 肿瘤防治研究, 2020, 47(1): 20-24. [Zhu YL, Yi FT, Ding MN, et al. Secretory Function of Kupffer Cells in Liver Cancer After Cryoablation[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(1): 20-24.] |
| [24] |
Zhu W, Li W, Geng Q, et al. Silence of Stomatin-Like Protein 2 Represses Migration and Invasion Ability of Human Liver Cancer Cells via Inhibiting the Nuclear Factor Kappa B (NF-κB) Pathway[J]. Med Sci Monit, 2018, 24: 7625-7632. DOI:10.12659/MSM.909156 |
 2021, Vol. 48
2021, Vol. 48


