文章信息
- LncRNA-MEG3和KLF4在鼻咽癌发生发展中的作用及可能机制
- Role and Possible Mechanism of LncRNA-MEG3 and KLF4 in Carcinogenesis and Progression of Nasopharyngeal Carcinoma
- 肿瘤防治研究, 2021, 48(3): 234-238
- Cancer Research on Prevention and Treatment, 2021, 48(3): 234-238
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0790
- 收稿日期: 2020-07-13
- 修回日期: 2020-12-04
2. 352100 宁德,宁德市医院耳鼻咽喉头颈外科
2. Department of Otolaryngology & Head and Neck Surgery, Ningde Municipal Hospital, Ningde 352100, China
鼻咽癌(nasopharyngeal carcinoma, NPC)是咽上皮细胞癌,好发于中国南部地区且有家族聚集倾向,提示遗传易感性在鼻咽癌的发生中起着关键作用[1]。癌症的发生发展随着时间推移会发生累积表观遗传的变化,主要表现为癌基因的激活和(或)抑癌基因的抑制。调控性非编码RNA(ncRNAs)按其功能可分为两类:管家ncRNAs和监管ncRNAs,其中大于200个核苷酸的称为长链非编码RNAs(LncRNAs)[2]。研究表明LncRNA靶点与多种癌症的发展及预后相关,如LncRNA MEG3可作为多种miRNAs的竞争性内源RNA(ceRNA)而发挥作用,通过下调MEG3的表达导致miRNAs的变化,从而影响目标mRNAs的表达水平[3-4]。MEG3位于人类染色体14q32.3上,研究显示MEG3可通过调节抑癌基因、抑制血管生成及控制miRNA而发挥抑癌作用[5]。同时研究还发现MEG3序列中有与miR-543互补的miRNA应答元件(MRE),而miR-543与癌症发生发展关系密切已得到证实,其中Krüppel样因子4(KLF4)作为miR-543的靶基因在其中发挥重要作用[6-7]。
近年来也不乏关于MEG3、miR-543在鼻咽癌发生发展过程中所起作用的研究[8-9],但具体机制的阐述仍不够清晰,本研究拟通过检测MEG3与miR-543在鼻咽癌细胞中的表达情况,分析MEG3、miR-543和KLF4与鼻咽癌的关系,以揭示他们在鼻咽癌发生发展过程中的具体作用,旨在为未来鼻咽癌的治疗中将MEG3作为一个可能靶点提供一些思路。
1 材料与方法 1.1 细胞培养鼻咽癌细胞株(CNE-2、C666-1和TW03)和人正常鼻咽上皮细胞株NP69均购自上海中国科学院。细胞在含10%胎牛血清的RPMI1640培养基中37℃、5%CO2饱和湿度的培养箱中培养。
1.2 实时定量聚合酶链反应(qRT-PCR)采用NucleoZOL(德国Machery Nagel GmbH公司)从细胞中分离总RNA、评估其完整性,ABI7500系统行qRT-PCR检测MEG3、miR-543和KLF4的表达情况。引物序列如下:MEG3-F: 5'-GGGAAGGGACCTCGAATGTG-3', MEG3-R: 5'-CTGTCCCGTGGGAATAGGTG-3';miR-543-F: 5'-CGAAACATTCGCGGTGCA-3';miR-543-R: 5'-AGTGCAGGGTCCGAGGTATT-3'和miR-543-RT: 5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAAGAAG-3'。以GAPDH和U6为内参对照,特异性引物如下:GAPDH-F: 5'-GTCAAGGCTGAGAACGGGAA-3', GAPDH-R: 5'-AAATGAGCCCCAGCCTTCTC-3';U6-F: 5'-CTCGCTTCGGCAGCACATATACT-3',U6-R: 5'-ACGCTTCACGAATTTGCGTGTC-3'和RT引物5'-AAAATATGGAACGCTTCACGAATTTG-3'。用2-ΔΔCt法计算相对基因表达量。
1.3 细胞转染与分组si-MEG3、pcDNA-MEG3、miR-543模拟物、miR-543抑制剂、si-KLF4和pcDNA-KLF4购自中国上海基因制药公司。取培养至对数期的鼻咽癌细胞和鼻咽上皮细胞参照Lipofectamine2000试剂盒(Invitrogen公司,美国)进行转染,并分成空白对照组(NC)、阴性转染组和实验组。
1.4 CCK-8检测细胞增殖将细胞接种到96孔板中,分别于转染后0、24、48、72、96 h加入10%CCK8溶液(CK04Dojindo)100 μl,37℃孵育2 h,微板仪测450 nm处的吸光度值。
1.5 流式细胞仪检测细胞凋亡细胞培养过夜、80%~90%融合时转染,在5%CO2环境中用胰蛋白酶消化、离心后收获细胞,用PBS洗涤,再与结合缓冲液混合后,在Annexin V-FITC和PI染色液室温黑暗条件下孵育15 min。
1.6 双荧光素酶测定法使用TargetScan数据库(http://www.targetscan.org/vert_71/)预测miR-543靶基因。将MEG3-WT(5‘-GAGUAAUGGUAGUGAAUGUU-3’)和MEG3-MUT(5‘-GAGUAAUG-GUAGUCAGAUCAU-3’)可能的结合序列克隆至pcDNA3.1载体上,与miR-543模拟或阴性对照共转染C666-1细胞,36 h后双荧光素酶报告分析系统(Promega公司,美国)分析萤火虫和雷尼拉信号。荧光素酶活性用微量平板阅读器定量。
1.7 Western blot法检测蛋白表达用RIPA缓冲液分离总蛋白、10%SDS-PAGE分离并转移到聚偏二氟乙烯(PVDF)膜上,蛋白质定量分析采用Bradford法,用皮尔斯ECL试剂盒显示PVDF膜上的靶蛋白条带。抗体稀释如下:抗KLF(1:1 000)、抗Bcl-2(1:1 000)和抗bax(1:1 000);以抗β-肌动蛋白(1:1 000)作为内参。
1.8 统计学方法所有数据均用均值±标准差(x±s)表示,并用SPSS20.0统计软件行数据分析,采用方差分析(ANOVA)确定各组数据差异的统计学意义。P < 0.05为差异有统计学意义。
2 结果 2.1 人鼻咽癌细胞系中MEG3与miR-543的表达qRT-PCR检测结果显示,与正常鼻咽上皮细胞系NP69相比,CNE-2、C666-1和TW03中MEG3表达水平降低,miR-543表达水平升高,差异均有统计学意义(F=58.137, P < 0.001),见图 1。
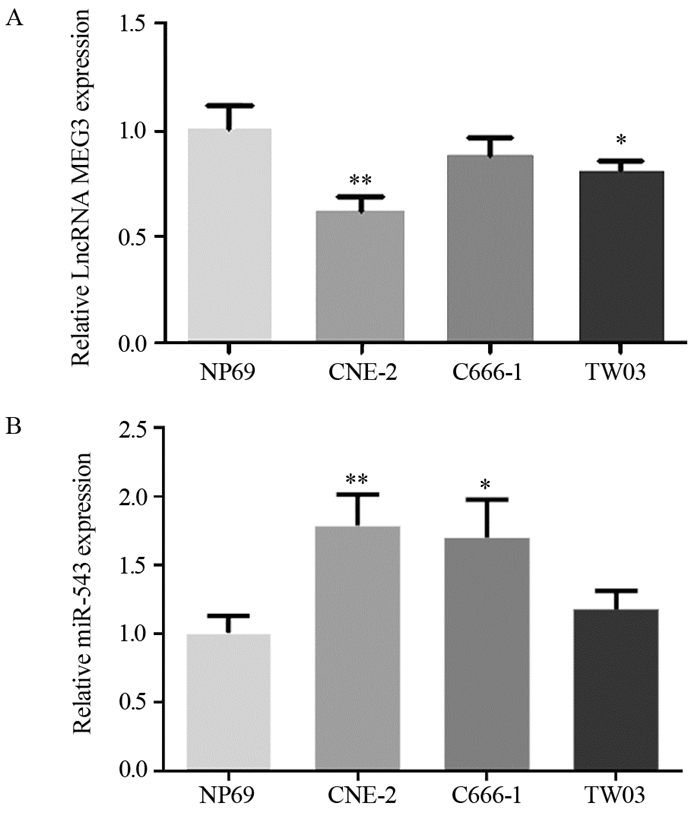
|
| *: P < 0.05, **: P < 0.01, compared with NP69 cell line. 图 1 qRT-PCR检测鼻咽癌细胞与正常鼻咽上皮细胞中MEG3(A)和miR-543(B)的表达 Figure 1 Expression of MEG3(A) and miR-543(B) in NPC cells and normal nasopharyngeal epithelial cells determined by qRT-PCR |
生物信息学预测显示MEG3以miR-543为靶点,于是构建了MEG3野生型和突变型荧光素酶报告载体并转染细胞。荧光素酶活性测定结果表明:与NC组相比,miR-543模拟物明显降低了MEG3野生型报告基因组的荧光素酶活性(F=18.824, P=0.001),而对MEG3突变型报告基因组中的荧光素酶活性没有可检测到的影响(F=1.337, P=0.310),见图 2,提示鼻咽癌细胞中MEG3以miR-543为调控靶点,且二者间存在负调节关系。
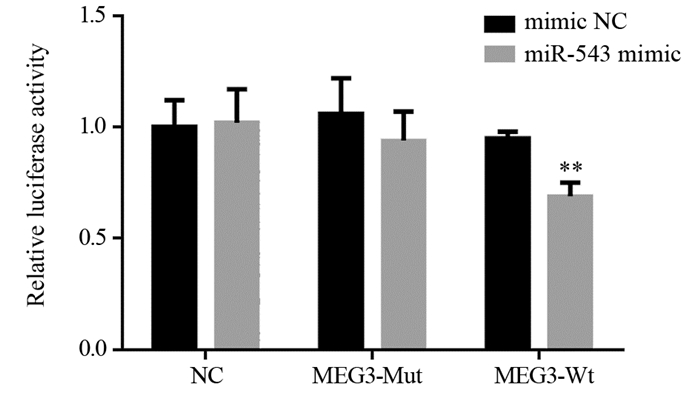
|
| **: P < 0.01, compared with NC group. 图 2 MEG3野生型和突变型为载体在miR-543模拟物结合位点上共转染鼻咽癌细胞的双荧光素酶报告分析 Figure 2 Dual luciferase reporter analysis of MEG3 wild- and mutant-types as vectors co-transfected with nasopharyngeal carcinoma cells at miR-543 mimetic binding site |
结果显示,MEG3过表达可显著降低miR-543的表达水平,而pcDNA-MEG3与miR-543的共转染模拟质粒可逆转pcDNA-MEG3对miR-543表达的抑制作用,与NC组、阴性转染组相比,组间差异均有统计学意义(F=4333.00, P < 0.001),见图 3A;MEG3过表达显著促进KLF4的表达,而与pcDNA-MEG3共转染的miR-543模拟质粒可逆转pcDNA-MEG3对KLF4表达的促进作用,与NC组、阴性转染组相比,组间差异均有统计学意义(F=3739.947, P < 0.001),见图 3B;下调MEG3可显著降低KLF4表达水平,而将miR-543抑制剂与si-MEG3共转染可缓解si-MEG3对KLF4表达的抑制作用,与NC组、阴性转染组相比,组间差异均有统计学意义(F=13056.846, P < 0.001),见图 3C。
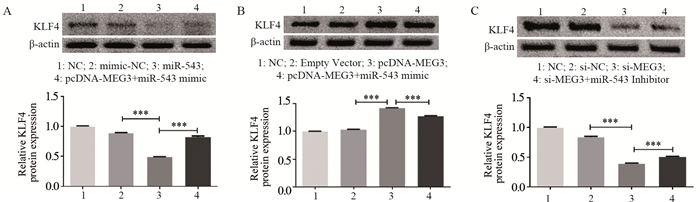
|
| A: the effect of MEG3 on miR-543 expression; B: the overexpression of MEG3 promoted the expression of KLF4, but could be reversed by miR-543; C: the downregulation of MEG3 decreased KLF4 expression, miR-543 inhibitor upregulated KLF4 expression. ***: P < 0.001. 图 3 MEG3吸附转染miR-543可提高KLF4的表达水平 Figure 3 MEG3 could regulate KLF4 expression by absorptively transfecting miR-543 |
研究结果显示si-MEG3促进鼻咽癌细胞增殖、pcDNA-MEG3抑制鼻咽癌细胞增殖,但pcDNA-KLF4共转染可逆转si-MEG3对C666-1细胞增殖的促进作用,而与si-KLF4共转染可解除pcDNA-MEG3对细胞增殖的抑制作用,与NC组、阴性转染组相比,差异均有统计学意义(F=8.886, P=0.007; F=5.778, P=0.024),见图 4A;si-MEG3抑制细胞凋亡,而si-MEG3和pcDNA-KLF4共转染减轻了其对细胞凋亡的抑制作用,与此同时pcDNA-MEG3诱导细胞凋亡,而pcDNA-MEG3和si-KLF4共转染抑制了其对细胞凋亡的促进作用,与NC组、阴性转染组相比,差异均有统计学意义(F=545.042, P < 0.01; F=1114.926, P < 0.001),见图 4B。
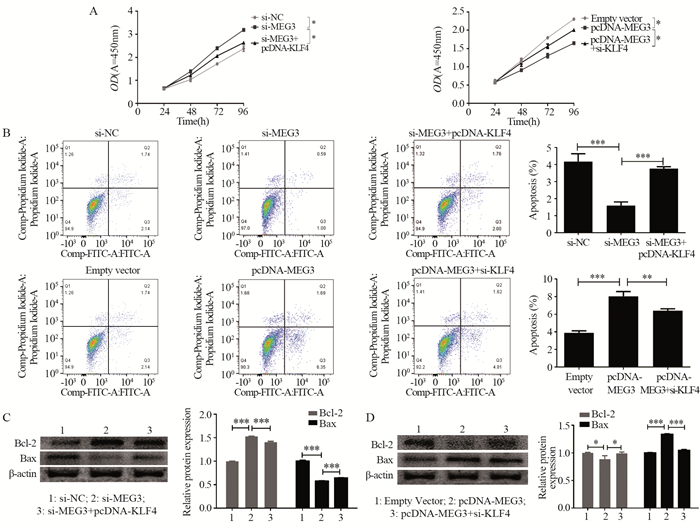
|
| A: si-MEG3 promoted the proliferation of NPC cells, while pcDNA-KLF4 cotransfection could reverse the effect; pcDNA-MEG3 inhibited the proliferation of NPC cells, while si-KLF4 cotransfection could relieve this effect; B: si-MEG3 inhibited cell apoptosis, while co-transfection of si-MEG3 and pcDNA-KLF4 alleviated the effect; pcDNA-MEG3 induced apoptosis, while co-transfection of pcDNA-MEG3 and si-KLF4 inhibited this effect; C: the expression of Bcl-2 was increased and the expression of Bax was decreased in NPC cells after MEG3 gene knock-out, and this effect was reversed by KLF4 forced expression; D: the overexpression of MEG3 decreased the expression of Bcl-2 and increased the expression of Bax, while the down-regulation of KLF4 reversed this effect; ***: P < 0.001; **: P < 0.01; *: P < 0.05. 图 4 MEG3可通过影响KLF4的表达来调控鼻咽癌细胞的增殖与凋亡 Figure 4 MEG3 could regulate proliferation and apoptosis of NPC cells by affecting KLF4 expression |
Western blot检测结果显示,MEG3敲除后Bcl-2的表达增高、Bax的表达降低,而提高KLF4的表达可逆转此效应,与NC组、阴性转染组相比,差异均有统计学意义(F=2191.592, P < 0.001; F=9548.143, P < 0.001),见图 4C;反之,MEG3过表达降低Bcl-2的表达、升高Bax的表达,但KLF4的表达下调可逆转此效应,与NC组、阴性转染组相比,差异均有统计学意义(F=37.781, P < 0.05; F=15183, P < 0.001),见图 4D。
因此,MEG3可通过调控KLF4蛋白的表达进而调控鼻咽癌细胞C666-1的增殖与凋亡。
3 讨论鼻咽癌是发生在鼻咽部的上皮源性恶性肿瘤,在我国南部及东南亚地区高发,其病理类型多为低分化鳞癌(98%),恶性程度高,转移早,晚期鼻咽癌即便经积极治疗但总体预后仍较差[10]。因此,寻求新的疗法以改善鼻咽癌患者总体治疗效果显得尤为必要。
LncRNAs已被证实可通过调节靶基因的表达参与多种疾病的发生发展,越来越多的研究表明LncRNAs在细胞癌变过程中可作为癌基因或抑癌因子而存在[11]。而MEG3作为LncRNAs中的重要成员之一在多数正常组织中表达,但在许多恶性肿瘤中显示表达下调甚至缺失,如在非小细胞肺癌中低表达,表达水平与肿瘤TNM分期、总体预后关系密切[12];在乳腺癌动物移植瘤模型中也观察到MEG3可抑制肿瘤生长、转移及瘤内血管的生成[13];还有研究发现胃癌中MEG3的表达明显下降,且下降程度与肿瘤进展及转移呈负相关[14]。但MEG3在鼻咽癌中的作用及相关机制目前仍不清楚,故本研究旨在通过探讨鼻咽癌发生发展的分子生物基础,寻找到可靠的新型生物标志物,最终为临床开展鼻咽癌分子靶向治疗提供有益的思路及实验基础。
有研究发现一些LncRNAs可通过与miRNAs直接结合来抑制其表达而充当ceRNAs(即“miRNA海绵”)的作用[15];而既往研究显示在不同癌细胞中miR-543的作用存在差异,且KLF4作为miR-543的靶基因可通过参与细胞增殖并在肿瘤发生发展中作为肿瘤抑制因子及预后指标而发挥作用[6]。本研究发现MEG3在鼻咽癌细胞中的表达水平明显降低,并观察到MEG3对癌细胞生物学行为的多效性调节:MEG3过表达能够抑制癌细胞的增殖、迁移和侵袭,促进细胞凋亡,还可通过靶向调节miR-543并作为KLF4的ceRNA而发挥肿瘤抑制作用。此外,本研究进一步验证了KLF4为鼻咽癌细胞miR-543的靶基因,miR-543可通过下调KLF4表达从而抑制细胞增殖、诱导细胞凋亡以进一步达到抑制肿瘤发生发展的目的。同时本研究还发现KLF4在鼻咽癌细胞中可通过调节Bcl-2与Bax蛋白的表达来发挥抑癌作用,提示KLF4可能是鼻咽癌预后的重要预测指标。
综上,本研究发现上调MEG3表达可抑制鼻咽癌细胞的增殖、促进肿瘤细胞凋亡,与miR-543的表达呈负相关,而miR-543又可通过下调KLF4的表达来发挥抑癌作用,揭示了MEG3在鼻咽癌细胞可通过MEG3-miR-543-KLF4轴的反馈调节达到抑制肿瘤发生发展的目的,提示MEG3可能会成为鼻咽癌靶向治疗的一种新型生物标志物。但本研究仅处于鼻咽癌的细胞层面上,MEG3-miR-543-KLF4反馈系统在鼻咽癌发生发展中的确切机制及可能的临床应用还有待进一步的研究来揭示。
作者贡献
宁佳羽:实验实施、结果整理及论文撰写
包伟晶:细胞培养、质粒转染及协助实验操作
周素娟:细胞增殖及凋亡检测
魏日富:数据收集及分析
朱忠寿:实验设计及文稿修改
| [1] |
Huang SF, Hsiao JH, Young CK, et al. Familial aggregation of nasopharyngeal carcinoma in Taiwan[J]. Oral Oncol, 2017, 73: 10-15. DOI:10.1016/j.oraloncology.2017.07.020 |
| [2] |
Li Z, Shen J, Chan MT, et al. TUG1: a pivotal oncogenic long non-coding RNA of human cancers[J]. Cell Prolif, 2016, 49(4): 471-475. DOI:10.1111/cpr.12269 |
| [3] |
Calle AS, Kawamura Y, Yamamoto Y, et al. Emerging roles of long non-coding RNA in cancer[J]. Cancer Sci, 2018, 109(7): 2093-2100. DOI:10.1111/cas.13642 |
| [4] |
Moradi MT, Fallahi H, Rahimi Z. Interaction of long noncoding RNA MEG3 with miRNAs: a reciprocal regulation[J]. J Cell Biochem, 2019, 120(3): 3339-3352. DOI:10.1002/jcb.27604 |
| [5] |
Al-Rugeebah A, Alanazi M, Parine NR. MEG3: an oncogenic long non-coding RNA in different cancers[J]. Pathol Oncol Res, 2019, 25(3): 859-874. DOI:10.1007/s12253-019-00614-3 |
| [6] |
Zhai F, Cao C, Zhang L, et al. miR-543 promotes colorectal cancer proliferation and metastasis by targeting KLF4[J]. Oncotarget, 2017, 8(35): 59246-59256. DOI:10.18632/oncotarget.19495 |
| [7] |
Du Y, Liu XH, Zhu HC, et al. MiR-543 promotes proliferation and epithelial-mesenchymal transition in prostate cancer via targeting RKIP[J]. Cell Physiol Biochem, 2017, 41(3): 1135-1146. DOI:10.1159/000464120 |
| [8] |
Jiang X, Dai B, Feng L. miR-543 promoted the cell proliferation and invasion of nasopharyngeal carcinoma by targeting the JAMA[J]. Hum Cell, 2019, 32(4): 477-486. DOI:10.1007/s13577-019-00274-0 |
| [9] |
Wang Y, Guo Z, Zhao Y, et al. Genetic polymorphisms of lncRNA-p53 regulatory network genes are associated with concurrent chemoradiotherapy toxicities and efficacy in nasopharyngeal carcinoma patients[J]. Sci Rep, 2017, 7(1): 8320. DOI:10.1038/s41598-017-08890-2 |
| [10] |
张力. 鼻咽癌的综合治疗进展[J]. 肿瘤防治研究, 2019, 46(8): 667-671. [Zhang L. Progress on Comprehensive Treatment of Nasopharyngeal Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(8): 667-671. DOI:10.3971/j.issn.1000-8578.2019.19.0636] |
| [11] |
Uttam S, Barwal TS, Malhotra A, et al. Long non-coding RNA TINCR as potential biomarker and therapeutic target for cancer[J]. Life Sci, 2020, 257: 118035. DOI:10.1016/j.lfs.2020.118035 |
| [12] |
Lu KH, Li W, Liu XH, et al. Long non-coding RNA MEG3 inhibits NSCLC cells proliferation and induces apoptosis by affecting p53 expression[J]. BMC Cancer, 2013, 13: 461. DOI:10.1186/1471-2407-13-461 |
| [13] |
Zhang CY, Yu MS, Li X, et al. Overexpression of long non-coding RNA MEG3 suppresses breast cancer cell proliferation, invasion, and angiogenesis through AKT pathway[J]. Tumour Biol, 2017, 39(6): 1010428317701311. |
| [14] |
Peng W, Si S, Zhang Q, et al. Long non-coding RNA MEG3 functions as a competing endogenous RNA to regulate gastric cancer progression[J]. J Exp Clin Cancer Res, 2015, 34(1): 79. DOI:10.1186/s13046-015-0197-7 |
| [15] |
Huang Y. The novel regulatory role of lncRNA-miRNA-mRNA axis in cardiovascular diseases[J]. J Cell Mol Med, 2018, 22(12): 5768-5775. DOI:10.1111/jcmm.13866 |
 2021, Vol. 48
2021, Vol. 48


