文章信息
- 肿瘤突变负荷对PD-1/PD-L1抑制剂治疗非小细胞肺癌临床疗效预测的Meta分析
- Predictive Value of Tumor Mutation Burden for PD-1/PD-L1 Inhibitors Treatment on Non-small Cell Lung Cancer: A Meta-analysis
- 肿瘤防治研究, 2021, 48(3): 281-287
- Cancer Research on Prevention and Treatment, 2021, 48(3): 281-287
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0765
- 收稿日期: 2020-07-03
- 修回日期: 2021-01-22
2. 650500 昆明,昆明医科大学研究生院;
3. 650021 昆明,昆明医科大学第四附属医院血管外科
2. Graduate School of Kunming Medical University, Kunming 650500, China;
3. Department of Vascular Surgery, The Fourth Affiliated Hospital of Kunming Medical University, Kunming 650021, China
肺癌是人类常见的恶性肿瘤之一,发病率和死亡率分别居恶性肿瘤的第三和第一位,而非小细胞肺癌(NSCLC)在肺癌中占很大比例,NSCLC在恶性肿瘤中的发病率和死亡率大约为9.3%和14.6%[1-2]。目前NSCLC的治疗主要以手术、化疗、放疗、生物治疗、免疫治疗等综合治疗为主[3],但结果却难以令人满意,5年生存率仅约为17.4%[4]。
随着研究的深入,PD-1/PD-L1通路的生物学活性逐渐被阐明并应用于肿瘤领域的治疗。但不是所有NSCLC患者的疗效都令人满意,有关PD-1/PD-L1抑制剂治疗实体瘤的预测标志物成为研究的热点。
基因突变致癌已经成为整个肿瘤领域的共识,此时在所评估基因的外显子编码区每兆碱基中发生置换和插入/缺失突变的总数即肿瘤突变负荷(tumor mutation burden, TMB)开始进入研究者们的视野。但TMB对于NSCLC患者选用PD-1/PD-L1抑制剂治疗的结局评估仍是一个有争议的生物标志物。因此,我们通过Meta分析比较在高TMB组和低TMB组的NSCLC患者中使用PD-1/PD-L1抑制剂的临床疗效。以期为晚期NSCLC患者使用PD-1/PD-L1抑制剂提供指导。
1 资料与方法本研究在国际前瞻性系统综述注册中心(PROSPERO)中注册,注册号为CRD42020162264。
1.1 文献检索对PubMed、Web of Science、Cochrane Library、中国生物医药数据库(CBM)、Embase、中国知网(CNKI)等电子数据库进行了全面的文献检索。检索时间均为建库至2020年3月25日。检索词为:("Nivolumab" or "Opdivo" or "ONO-4538" or "Tecentriq" or "MPDL-3280A" or "RG-7446" or "Pembrolizumab" or "Keytruda" or "Lambrolizumab" or "MK-3475" or "PEMBRO" or "Durvalumab" or "MEDI-4736" or "Imfinzi" or "Pidilizumab" or "CT-011" or "PD-1" or "PD-L1" or "PD-1/PD-L1" or "programmed cell death 1" or "programmed cell death ligand 1")and("tumor mutation burden" or "tumor mutation load" or "TMB" or "TML") and (" non-small-cell lung cancer" or "NSCLC")及对应的中文检索词。另手动检索所选文章和评论的参考文献,以获得所有可能相关的研究。所有检索文献不限语种。
1.2 文献纳入、排除标准纳入标准:(1)经病理证实为NSCLC;(2)临床试验或队列研究采用具有截断值的TMB评估NSCLC患者经PD-1/PD-L1抑制剂(nivolumab、pembrolizumab、atezolizumab、durvalumab、avelumab)治疗后的结局;(3)文章中给出了客观缓解率/总缓解率(ORR)的比值比(OR),无进展生存期(PFS)或总生存期(OS)的风险比(HR)及其95%CIs,或有足够的信息提取数据;(4)可评估患者人数不少于20人。排除标准:非原创性研究(如Meta分析、综述)、会议摘要、病例报告、重复研究、无法提取TMB与使用PD-1/PD-L1抑制剂治疗NSCLC结局指标关系数据的研究、数据不完整或无法检索全文的研究。
1.3 数据提取数据提取和评估由两名研究人员独立完成,意见不统一时通过与第三名研究人员讨论解决。提取的数据包括:试验名称/作者、发表年份、试验阶段、治疗线、试验药物、高TMB和低TMB患者人数和PFS、ORR、OS及95%CI。
1.4 文献质量评价采用New castle-Ottawa Scale(NOS)质量评估量表来评估纳入研究或队列的质量。根据总分(0~9分)分为三组:研究质量差(0~3分)、中等质量(4~6分)和高质量(7~9分)。
1.5 统计学方法及数据分析风险比(HR)及其95%CI来评价TMB与PD-1/PD-L1抑制剂治疗非小细胞肺癌PFS、OS的关系,比值比(OR)及其95%CI用于评估ORR。若卡方检验P<0.1或I2>50%则认为有异质性。假如观察到异质性,利用随机效应模型来减少异质性对结果的影响,反之使用固定效应模型。Egger's和Begg's检验用于评估发表偏倚。RevMan5.3和STATA15.0软件进行统计分析。
2 结果 2.1 文献检索和筛选结果从PubMed、Embase和Cochrane Library、CNKI、中国生物医学数据库(Chinese Biomedical Literature Database, CBM)和万方数据库检索了676条记录。排除了93项重复研究。筛选标题和摘要后,495项研究被排除。剩下的88篇文章通过阅读全文,共有1 209例患者的11篇文献(12项队列研究)被纳入[5-15],见图 1。
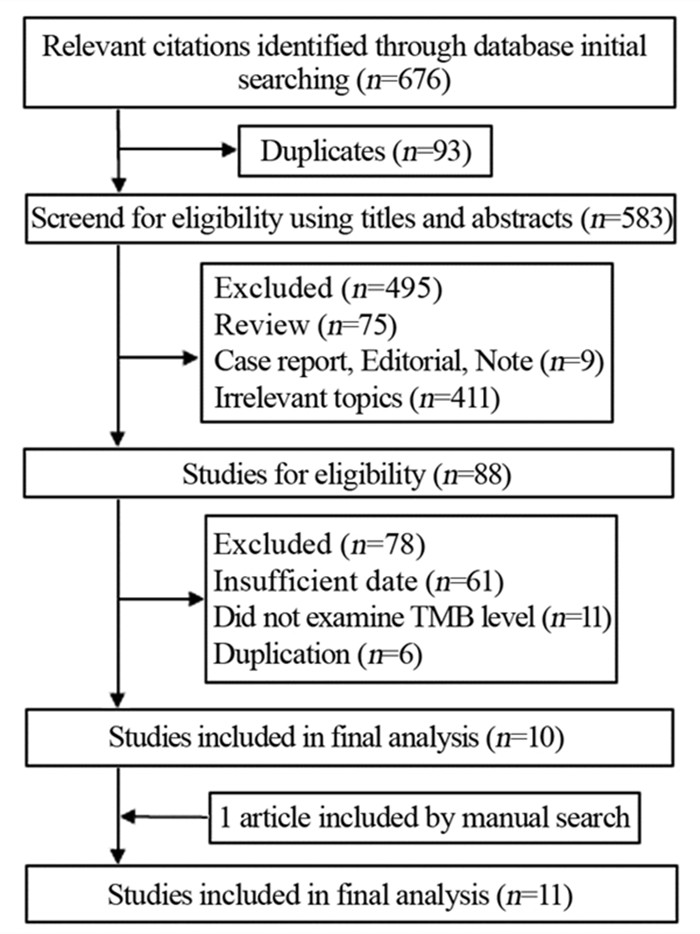
|
| 图 1 文献检索及筛选流程图 Figure 1 Flow diagram of literature retrieval and screening |
本研究纳入文献的主要特征和每个研究的截断值,见表 1。纳入研究的质量通过NOS进行评估,见表 2。其中10项研究质量较高,其余研究评价为中等质量,确保了纳入研究的相对质量较高,增强了Meta分析的可靠性。
本研究结果显示,高TMB显著提高PD-1/PD-L1抑制剂治疗的NSCLC患者的PFS,却降低ORR。共12项研究报道了TMB与PFS的关系,高TMB组PFS明显优于低TMB组,差异有统计学意义(HR=0.54, 95%CI: 0.42~0.70; P<0.001),见图 2;共5项研究637例患者评估了经PD-1/PD-L1抑制剂治疗的NSCLC患者中TMB与OS的关系,高TMB组与低TMB组OS比较差异无统计学意义(HR=0.68, 95%CI: 0.40~1.19, P=0.18),见图 3;有5项研究332例患者评估了经PD-1/PD-L1抑制剂治疗的NSCLC患者中TMB与ORR的相关性,高TMB患者的ORR明显低于低TMB患者,差异有统计学意义(HR=4.41, 95%CI: 2.54, 7.63; P<0.001),见图 4。PFS(I2=66%, P<0.00001)和OS(I2=71%, P=0.18)分析中观察到异质性,故采用随机效应模型,而关于ORR(I2=0, P<0.00001)的分析中无异质性,则采用固定效应模型。

|
| 图 2 TMB与PFS的相关性森林图 Figure 2 Forest plot of association between TMB and PFS |
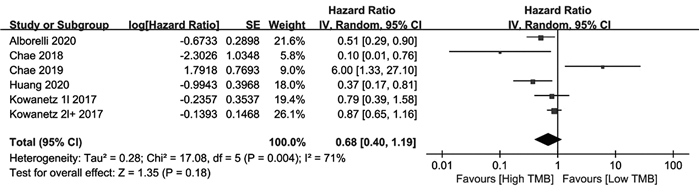
|
| 图 3 TMB与OS的相关性森林图 Figure 3 Forest plot of association between TMB and OS |

|
| 图 4 TMB与ORR的相关性森林图 Figure 4 Forest plot of association between TMB and ORR |
本研究通过分析Egger's检验、Begg's漏斗图对文献的发表性偏倚进行评估。TMB与PFS、OS、ORR相关性Begg's漏斗图基本对称,分别见图 5A~C,Egger's检验P值分别为0.305、0.703、0.823,表明对此项内容研究的相关文献未出现发表性偏倚。

|
| 图 5 TMB与PFS(A)、OS(B)、ORR(C)的相关性Begg's漏斗图 Figure 5 Funnel plot of association between TMB and PFS(A), OS(B), ORR(C) |
通过敏感度分析发现异质性主要来自于Chae[5]和Rizvi等[11]。去除这两篇文献后,I2下降到45%,P值异质性增加到0.06,HR=0.54(95%CI 0.46, 0.62)。对TMB测序方法和患者来自地区进行亚组分析,结果显示TMB测序方法和地域在治疗NSCLC的PFS方面无显著相关性。对PD-1/PD-L1抑制剂治疗或联合其他治疗进行亚组分析,与高TMB组相比,PD-1/PD-L1抑制剂联合其他治疗组显示了OS的优势(HR=0.46, 95%CI: 0.29, 0.72, P<0.01)。NSCLC中PD-1/PD-L1抑制剂治疗TMB相关性亚组分析结果,见表 3。

|
有研究表明,在没有使用PD-1/PD-L1抑制剂的情况下,高TMB患者的生存率更差,充分说明PD-1/PD-L1抑制剂对于提高生存率和克服预后不良特点的临床价值[11]。此外,一些研究表明,在多种癌症中TMB水平在NSCLC中几乎最高,并且TMB正在成为预测PD-1/PD-L1抑制治疗的潜在生物标志物[16-17]。本结果表明高TMB与免疫治疗的PFS正相关,但与ORR负相关。笔者认为出现这种情况可能提示TMB确实与免疫治疗的疗效相关,并且在部分患者中的疗效十分好,但并非所有TMB高的患者都可以从中获益。此外,符合条件的生物标志物如程序性细胞死亡配体1(PD-L1)的表达[18]、肿瘤浸润淋巴细胞(TILs)[19]、致癌驱动突变[20]、错配修复缺陷(dMMR)[21]和微卫星不稳定(MSI)[22]与PD-1/PD-L1抑制剂治疗NSCLC疗效的研究越来越明确,如果能将TMB与这些生物标志物结合可能会更加精确的筛选出真正能从PD-1/PD-L1抑制剂中获益的NSCLC患者。
TMB是指肿瘤细胞基因组中,所评估基因的外显子编码区每兆碱基中发生置换和插入/缺失突变的总数[23]。一方面驱动基因突变可以导致肿瘤的发生;另一方面大量的细胞突变可以产生新抗原,这些新抗原可以激活CD8+的细胞毒性T细胞,从而发挥T细胞介导的抗肿瘤效应[24]。因此,当基因变异数目累积增多时,会产生更多的新抗原,进而被免疫系统识别的可能性越大。而PD-1/PD-L1通路被激活后,可抑制T淋巴细胞增殖和抑制T细胞的免疫功能[25]。所以很多学者认为TMB也许能预测PD-1/PD-L1抑制剂的临床疗效并进行了大量研究。
本研究在合并PFS和OS中存在显著异质性,通过亚组分析发现显著的异质性集中在靶向NGS组。TMB预测PD-1/PD-L1抑制剂治疗效果的最佳截断值和检测模式有待进一步研究。Goodman等[26]报告了将TMB分为三层的策略:低(1~5 mut/Mb)、中(6~19 mut/Mb)和高(≥20 mut/Mb)。在临床实践中,将TMB的高表达和低表达划分为界限似乎更有意义。大多数研究[6-7, 9-10, 12, 14]大约有10 mut/Mb或150个突变,这似乎在非小细胞肺癌中具有相对稳定的预测价值。实际上,由于在不同的检测方式下TMB的变化很大,可能没有一个通用的TMB截断值能应对不同的检测方式[27-28]。目前还不能将WES作为检查PD-1/PD-L1抑制剂治疗反应的预测因子,主要是因为难度大、成本高、耗时长,在日常临床实践中有一定的局限性[29]。相比之下,使用靶向性NGS检测法比WES更方便、更经济[17, 30-31]。有研究表明,在基因组覆盖率为0.5 Mb的面板中,靶向NGS测定的TMB的准确性有所下降[17],而靶向NGS和WES检测法量化的TMB需要大量的肿瘤组织标本,不仅是侵袭性创伤,而且部分患者的肿瘤太小无法获得标本。一种省时又方便的经血液检测TMB方法被报道[32]。此外,一些关于实体肿瘤TMB评估的临床试验正在进行,这些试验有望提供更多高质量的结果,帮助我们确定合适的TMB截断值和检测模式[33-34]。
本研究以ORR、PFS和OS作为终点,评估PD-1/PD-L1抑制剂治疗的短期和长期效益,使其更加全面和有说服力。其次,本研究从不同面进行亚组分析,发现与高TMB组相比,PD-1/PD-L1抑制剂联合其他治疗组显示了OS的优势,并通过TMB检测方法的亚组分析发现了大部分异质性的来源。灵敏度分析表明我们的结果具有良好的稳定性。
本研究也存在一些局限性,首先,纳入研究的样本量存在差异,导致不同亚组间样本量差异较大,样本量较小的研究可能是Meta分析发表偏倚的主要来源。加之,一些重要的临床特征,如生活方式[35]、年龄和性别[36-37]等已被报道是影响PD-1/PD-L1抑制剂治疗效果的重要因素,由于数据不足而被忽视。Conforti等[36]报道了男性使用这些PD-1/PD-L1抑制剂治疗比女性有更大的治疗效果。Wallis等[37]最近更新的一项较早的荟萃分析显示,PD-1/PD-L1抑制剂治疗的疗效没有性别差异。
有研究有报道称TMB可以独立预测PD-1/PD-L1抑制剂的疗效[16, 38],本结果提示这一观点有待进一步研究。本荟萃分析中,大多数研究中招募的患者都来自西方,这些研究显示高TMB和免疫治疗效果的提高之间有很强的相关性。在亚洲和其他地区需要更多的平行研究,但在探讨抗PD-1/PD-L1抑制剂联合抗CTLA-4治疗或化疗等联合治疗还需进一步证实上述结果,还需在生活方式、年龄、性别等方面进行更多研究分析。
综上所述,高TMB可以预测PD-1/PD-L1抑制剂治疗非小细胞肺癌PFS的提高,但其对OS、ORR及长期生存的预测价值尚需进一步研究,需要更多大样本量和标准化设计的研究来进一步探讨TMB在某些亚组中的预测价值。其次,寻找最佳截断值和检测方式迫切需要解决。此外,将TMB与符合条件的生物标志物结合可能会扩大受益于免疫检查点抑制剂患者的选择。
作者贡献
沈仕俊:选题、文献检索、文献筛选、数据分析、论文撰写
王巧丽:数据分析
杨金江:文献检索
李国剑:指导选题
李孟丽:文献筛选
张小丽:文献检索
甘平:指导选题、论文质控及审核
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Herbst RS, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer[J]. Nature, 2018, 553(7689): 446-454. DOI:10.1038/nature25183 |
| [3] |
Ettinger DS, Wood DE, Aggarwal C, et al. NCCN Guidelines Insights: Non-Small Cell Lung Cancer, Version 1.2020[J]. J Nat Compr Canc Netw, 2019, 17(12): 1464-1472. DOI:10.6004/jnccn.2019.0059 |
| [4] |
Khanna P, Blais N, Gaudreau PO, et al. Immunotherapy Comes of Age in Lung Cancer[J]. Clin Lung Cancer, 2017, 18(1): 13-22. DOI:10.1016/j.cllc.2016.06.006 |
| [5] |
Chae YK, Davis AA, Agte S, et al. Clinical Implications of Circulating Tumor DNA Tumor Mutational Burden (ctDNA TMB) in Non-Small Cell Lung Cancer[J]. Oncologist, 2019, 24(6): 820-828. DOI:10.1634/theoncologist.2018-0433 |
| [6] |
Huang D, Zhang F, Tao H, et al. Tumor Mutation Burden as a Potential Biomarker for PD-1/PD-L1 Inhibition in Advanced Non-small Cell Lung Cancer[J]. Target Oncol, 2020, 15(1): 93-100. DOI:10.1007/s11523-020-00703-3 |
| [7] |
Alborelli I, Leonards K, Rothschild SI, et al. Tumor mutational burden assessed by targeted NGS predicts clinical benefit from immune checkpoint inhibitors in non-small cell lung cancer[J]. J Pathol, 2020, 250(1): 19-29. DOI:10.1002/path.5344 |
| [8] |
Wang Z, Duan J, Cai S, et al. Assessment of Blood Tumor Mutational Burden as a Potential Biomarker for Immunotherapy in Patients With Non-Small Cell Lung Cancer With Use of a Next-Generation Sequencing Cancer Gene Panel[J]. JAMA Oncol, 2019, 5(5): 696-702. DOI:10.1001/jamaoncol.2018.7098 |
| [9] |
Ready N, Hellmann MD, Awad MM, et al. First-Line Nivolumab Plus Ipilimumab in Advanced Non-Small-Cell Lung Cancer (CheckMate 568): Outcomes by Programmed Death Ligand 1 and Tumor Mutational Burden as Biomarkers[J]. J Clin Oncol, 2019, 37(12): 992-1000. DOI:10.1200/JCO.18.01042 |
| [10] |
Fang W, Ma Y, Yin JC, et al. Comprehensive genomic profiling identifies novel genetic predictors of response to anti-PD-(L)1 therapies in non-small cell lung cancer[J]. Clin Cancer Res, 2019, 25(16): 5015-5026. DOI:10.1158/1078-0432.CCR-19-0585 |
| [11] |
Rizvi H, Sanchez-Vega F, La K, et al. Molecular determinants of response to anti-programmed cell death (PD)-1 and anti-programmed death-ligand 1 (PD-L1) blockade in patients with non-small-cell lung cancer profiled with targeted next-generation sequencing[J]. J Clin Oncol, 2018, 36(7): 633-641. DOI:10.1200/JCO.2017.75.3384 |
| [12] |
Hellmann MD, Nathanson T, Rizvi H, et al. Genomic Features of Response to Combination Immunotherapy in Patients with Advanced Non-Small-Cell Lung Cancer[J]. Cancer Cell, 2018, 33(5): 843-852.e4. DOI:10.1016/j.ccell.2018.03.018 |
| [13] |
Chae YK, Davis AA, Raparia K, et al. Association of Tumor Mutational Burden With DNA Repair Mutations and Response to Anti-PD-1/PD-L1 Therapy in Non-Small-Cell Lung Cancer[J]. Clin Lung Cancer, 2019, 20(2): 88-96.e6. DOI:10.1016/j.cllc.2018.09.008 |
| [14] |
Kowanetz M, Zou W, Shames D, et al. Tumor mutation burden (TMB) is associated with improved efficacy of atezolizumab in 1L and 2L+ NSCLC patients[J]. J Thoracic Oncol, 2017, 12(1): S321-S322. DOI:10.1016/j.jtho.2016.11.343 |
| [15] |
Rizvi NA, Hellmann MD, Snyder A, et al. Cancer immunology. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer[J]. Science, 2015, 348(6230): 124-128. DOI:10.1126/science.aaa1348 |
| [16] |
Chan TA, Yarchoan M, Jaffee E, et al. Development of tumor mutation burden as an immunotherapy biomarker: utility for the oncology clinic[J]. Ann Oncol, 2019, 30(1): 44-56. DOI:10.1093/annonc/mdy495 |
| [17] |
Chalmers ZR, Connelly CF, Fabrizio D, et al. Analysis of 100, 000 human cancer genomes reveals the landscape of tumor mutational burden[J]. Genome Med, 2017, 9(1): 34. DOI:10.1186/s13073-017-0424-2 |
| [18] |
Chen Y, Liu Q, Chen Z, et al. PD-L1 expression and tumor mutational burden status for prediction of response to chemotherapy and targeted therapy in non-small cell lung cancer[J]. J Exp Clin Cancer Res, 2019, 38(1): 193. DOI:10.1186/s13046-019-1192-1 |
| [19] |
Kurtulus S, Madi A, Escobar G, et al. Checkpoint Blockade Immunotherapy Induces Dynamic Changes in PD-1(-)CD8(+) Tumor-Infiltrating T Cells[J]. Immunity, 2019, 50(1): 181-194. DOI:10.1016/j.immuni.2018.11.014 |
| [20] |
Ng TL, Liu Y, Dimou A, et al. Predictive value of oncogenic driver subtype, programmed death-1 ligand (PD-L1) score, and smoking status on the efficacy of PD-1/PD-L1 inhibitors in patients with oncogene-driven non-small cell lung cancer[J]. Cancer, 2019, 125(7): 1038-1049. DOI:10.1002/cncr.31871 |
| [21] |
Le DT, Durham JN, Smith KN, et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade[J]. Science, 2017, 357(6349): 409-413. DOI:10.1126/science.aan6733 |
| [22] |
Dudley JC, Lin MT, Le DT, et al. Microsatellite Instability as a Biomarker for PD-1 Blockade[J]. Clin Cancer Res, 2016, 22(4): 813-820. DOI:10.1158/1078-0432.CCR-15-1678 |
| [23] |
Ritterhouse LL. Tumor mutational burden[J]. Cancer Cytopathol, 2019, 127(12): 735-736. DOI:10.1002/cncy.22174 |
| [24] |
Gubin MM, Artyomov MN, Mardis ER, et al. Tumor neoantigens: building a framework for personalized cancer immunotherapy[J]. J Clin Invest, 2015, 125(9): 3413-3421. DOI:10.1172/JCI80008 |
| [25] |
Sharpe AH, Pauken KE. The diverse functions of the PD1 inhibitory pathway[J]. Nat Rev Immunol, 2018, 18(3): 153-167. DOI:10.1038/nri.2017.108 |
| [26] |
Goodman AM, Kato S, Bazhenova L, et al. Tumor mutational burden as an independent predictor of response to immunotherapy in diverse cancers[J]. Mol Cancer Ther, 2017, 16(11): 2598-2608. DOI:10.1158/1535-7163.MCT-17-0386 |
| [27] |
Galuppini F, Dal Pozzo CA, Deckert J, et al. Tumor mutation burden: From comprehensive mutational screening to the clinic[J]. Cancer Cell Int, 2019, 19: 209. DOI:10.1186/s12935-019-0929-4 |
| [28] |
Fancello L, Gandini S, Pelicci PG, et al. Tumor mutational burden quantification from targeted gene panels: Major advancements and challenges[J]. J Immunother Cancer, 2019, 7(1): 183. DOI:10.1186/s40425-019-0647-4 |
| [29] |
Johnson DB, Frampton GM, Rioth MJ, et al. Targeted Next Generation Sequencing Identifies Markers of Response to PD-1 Blockade[J]. Cancer Immunol Res, 2016, 4(11): 959-967. DOI:10.1158/2326-6066.CIR-16-0143 |
| [30] |
Zehir A, Benayed R, Shah RH, et al. Mutational landscape of metastatic cancer revealed from prospective clinical sequencing of 10, 000 patients[J]. Nat Med, 2017, 23(6): 703-713. DOI:10.1038/nm.4333 |
| [31] |
Jordan EJ, Kim HR, Arcila ME, et al. Prospective Comprehensive Molecular Characterization of Lung Adenocarcinomas for Efficient Patient Matching to Approved and Emerging Therapies[J]. Cancer Discov, 2017, 7(6): 596-609. DOI:10.1158/2159-8290.CD-16-1337 |
| [32] |
Gandara DR, Paul SM, Kowanetz M, et al. Blood-based tumor mutational burden as a predictor of clinical benefit in non-small-cell lung cancer patients treated with atezolizumab[J]. Nat Med, 2018, 24(9): 1441-1448. DOI:10.1038/s41591-018-0134-3 |
| [33] |
Zhang Y, Wang L, Li R, et al. The emerging development of tumor mutational burden in patients with NSCLC[J]. Future Oncol, 2020, 16(9): 469-481. |
| [34] |
Heeke S, Hofman P. Tumor mutational burden assessment as a predictive biomarker for immunotherapy in lung cancer patients: Getting ready for prime-time or not?[J]. Transl Lung Cancer Res, 2018, 7(6): 631-638. |
| [35] |
Carrera C, Potrony M, Puig S. Sex as a predictor of response to cancer immunotherapy[J]. Lancet Oncol, 2018, 19(8): e375. DOI:10.1016/S1470-2045(18)30443-1 |
| [36] |
Conforti F, Pala L, Bagnardi V, et al. Cancer immunotherapy efficacy and patients' sex: a systematic review and meta-analysis[J]. Lancet Oncol, 2018, 19(6): 737-746. DOI:10.1016/S1470-2045(18)30261-4 |
| [37] |
Wallis CJD, Butaney M, Satkunasivam R, et al. Association of Patient Sex With Efficacy of Immune Checkpoint Inhibitors and Overall Survival in Advanced Cancers: A Systematic Review and Meta-analysis[J]. JAMA Oncol, 2019, 5(4): 529-536. DOI:10.1001/jamaoncol.2018.5904 |
| [38] |
Tafe LJ. Non-Small Cell Lung Cancer as a Precision Oncology Paradigm: Emerging Targets and Tumor Mutational Burden (TMB)[J]. Adv Anat Pathol, 2020, 27(1): 3-10. DOI:10.1097/PAP.0000000000000244 |
 2021, Vol. 48
2021, Vol. 48




