文章信息
- GP方案治疗局部晚期鼻咽癌患者的急性不良反应及预后Meta分析
- Acute Adverse Effects and Prognosis of Locally Advanced Nasopharyngeal Carcinoma Patients Treated with GP Regimen: A Meta-analysis
- 肿瘤防治研究, 2021, 48(2): 145-153
- Cancer Research on Prevention and Treatment, 2021, 48(2): 145-153
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0757
- 收稿日期: 2020-07-03
- 修回日期: 2020-12-09
鼻咽癌尽管全球发病率低[1],但在中国多发,尤其在湖南及两广地区[2-4]。鼻咽癌发生部位隐蔽,早期症状不典型,易发生淋巴结转移,多数患者初诊时即为局部晚期[5]。远处转移和局部复发是影响鼻咽癌患者预后的两个主要因素[6],虽然IMRT能使5年局部控制率达到76%~90%,OS提高到65%~80%,但复发率仍达20%[7]。局部晚期鼻咽癌(locally advanced nasopharyngeal carcinoma, LANC)的标准治疗是同步放化疗。近几年来,诱导化疗在LANC的治疗上取得了进展。GP方案(吉西他滨+铂类)诱导化疗加同步放化疗较单纯同步放化疗提高了LANC疗效,3年无复发生存率分别为85.3%和76.5%[8]。但目前LANC的诱导化疗方案尚无统一意见,PF方案(5-氟尿嘧啶+顺铂)是LANC较为经典的化疗方案,临床还常常采用TP方案(紫杉醇类+铂类)、TPF方案(紫杉醇类+5-氟尿嘧啶+铂类)等以铂类为基础的双药或三药诱导化疗方案。近几年,有小样本的研究发现GP方案在治疗LANC方面效果可观,且不良反应比三药诱导化疗TPF方案低[9-11],也有研究认为两种化疗方案并没有太大的区别[12-13]。由于各研究样本量较少,且结论不完全一致,本研究将进行GP方案对比其他化疗方案在LANC中的不良反应及预后的Meta分析,从而为临床选择LANC的化疗方案提供更科学可靠的循证医学证据。
1 资料与方法 1.1 检索策略从PubMed、Web of Science,Elsevier Science Direct、中国知网、维普和万方数据库中检索相关文献,检索时间截至2020年4月16号。采用主题词和关键词相结合,根据每个数据库特点使用特定的检索方式。英文检索词为:advanced nasopharyngeal carcinoma, advanced nasopharyngeal cancer, gemcitabine;中文为:局部晚期鼻咽癌,吉西他滨。排除评论文章、病例报告、综述以及重复文章。文献由EndNote软件(版本X9)管理。
1.2 纳入和排除标准 1.2.1 纳入标准(1)病理确诊的鼻咽癌患者,分期为局部晚期;无第二原发肿瘤;ECOG评分0~2分或KPS评分≥70分;血常规、肝肾功能、心肺功能未见明显异常,可耐受化疗;(2)研究设计为队列研究或随机对照研究;(3)试验组予以GP方案化疗;对照组予以FP、TPF或TP方案;(4)预后指标为总生存率(overall survival, OS)、无进展生存率(progression-free survival, PFS)、无局部复发率(local recurrence-free survival, LRFS)和无远处转移生存率(distant metastasis-free survival, DMFS)。不良反应包括血液学毒性和非血液学毒性。不良反应评价标准采用美国国立癌症研究所常见不良反应分级标准(National Cancer Institute Common Toxicity Criteria, NCICTC)分为0~Ⅳ级,Ⅲ~Ⅳ度为重度。核查每项研究中患者的就诊机构和时间段,避免重复。Zeng[12]与Zhu[9]等两篇文献来自同一单位,时间段有部分重复,Zeng等[12]的文献未提供不良反应数据,因此进行不良反应分析时不包括这篇;Zhu等[9]的文章未提供预后统计分析结果风险比(hazard ratio, HR),因此预后分析不含此篇。
1.2.2 排除标准(1)文献类型为评论文章、病例报告、综述等非实验类研究;(2)重复发表的文献;(3)文章结果中无法获得本研究所需的相关数据。
1.3 数据提取与文献质量评估提取文献中以下信息:第一作者姓名、出版年份、患者就诊医院、患者例数、肿瘤分期、化疗方案、化疗剂量、放疗技术、放疗剂量、急性不良反应,并从多变量分析结果中提取OS、PFS、LRFS、DMFS的HR及95%可信区间。采用NOS(the Newcastle-Ottawa scale criteria)队列研究标准对文献进行方法学质量评分[13],包括研究人群的选择、两组的可比性、结果的测量。大于7分为优质文献。
1.4 统计学方法相关数据采用EXCEL表收集、整理,RevMan5.3软件分析合并研究数据及构建森林图。进行异质性判断时,若I2>50%,认为研究间存在异质性,使用随机效应模型合并数据;若I2≤50%,则使用固定效应模型。相对危险度(relative risk, RR)及其95%CI用于描述不良反应的结果,P < 0.05为差异有统计学意义。HR及其95%CI用于评估预后,α=0.05为检验水准。我们改变分析模型以及每次删除纳入文献中的一篇文献,通过对比改变前后结果的大小及方向变化来进行敏感度分析。Stata15构建漏斗图及进行Begg’s和Egger’s检验来评价发表偏倚。
2 结果 2.1 文献检索结果共检索出190篇相关文献,去除重复文献53篇、综述13篇、评论7篇、研究对象不是LANC的75篇及研究内容不含吉西他滨的文献19篇。通过阅读剩余的23篇文献全文,最终有11篇文献符合纳入标准,包括6篇英文文献经、5篇中文文献。研究筛选流程见图 1。
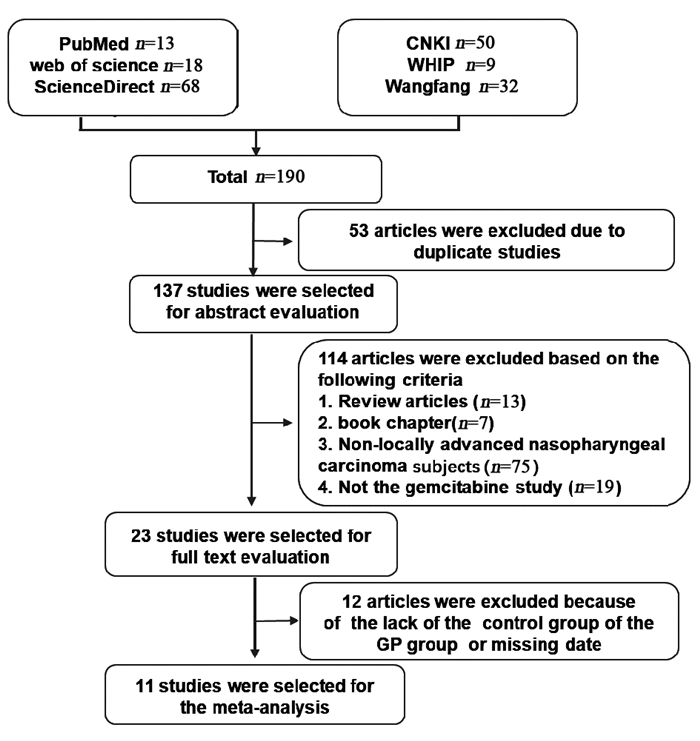
|
| 图 1 文献筛选流程图 Figure 1 Flow diagram of literature selection |
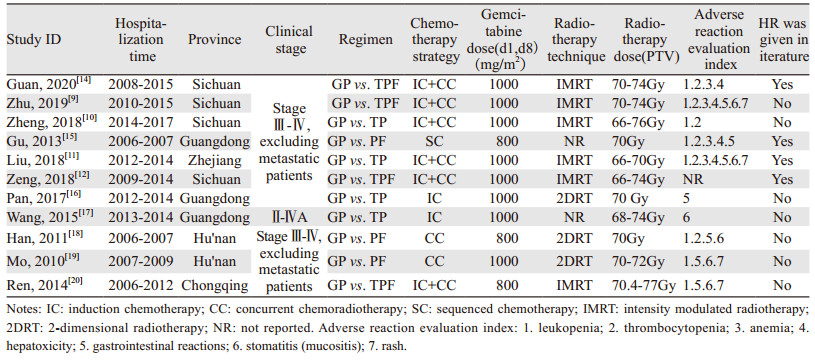
纳入文献的基本特征,见表 1。纳入的11篇文献回顾性队列研究较多,发表时间为2010—2020年。病例数据来自于10家不同省份/直辖市的医院,4篇[9-10, 12, 14]来自四川,3篇[15-17]来自广东,2篇[18-19]来自湖南,1篇[11]来自浙江,1篇[20]来自重庆。病例均为华人,共1 141例,其中试验组采用GP方案化疗的患者555例,对照组586例。除1项研究[17]包含Ⅱ期患者,其余10项均为Ⅲ期及以上非远处转移患者。3项研究[16, 18, 20]试验组使用的化疗方案为吉西他滨加奈达铂,其余8项研究试验组化疗方案为吉西他滨加顺铂。只有一项研究[12]未统计不良反应结果,但提供了两组预后的HR,其余10项研究均描述了实验组与对照组的不良反应。纳入的11篇文献均为7分及以上。
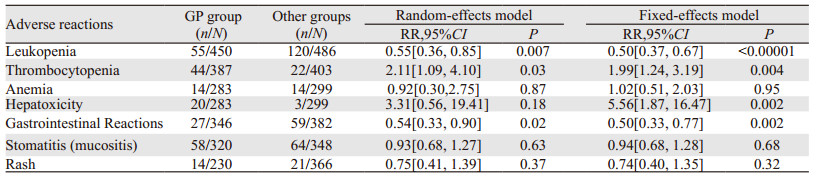
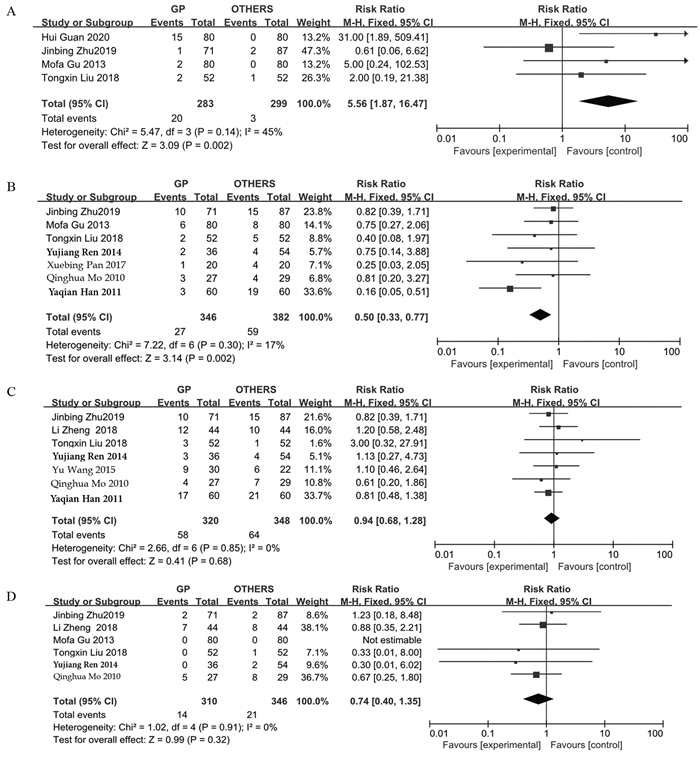
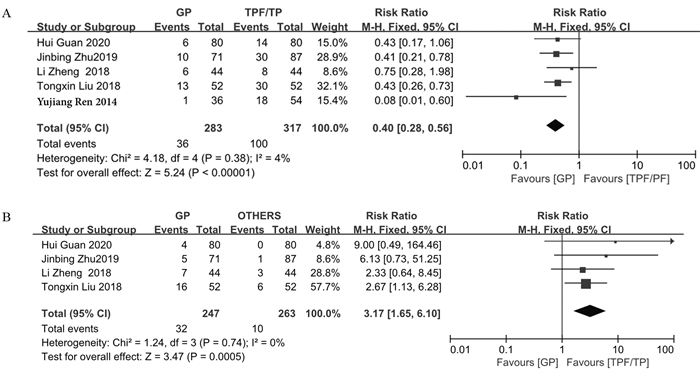
结果发现GP、TPF、TP、PF方案常见的不良反应为骨髓抑制、血小板减少、贫血、恶心呕吐、肝功能异常、口腔黏膜炎、皮疹等。RevMan5.3将以上不良反应相关数据绘制成森林图。在血液系统中不良反应方面,GP方案较其他含铂类方案重度白细胞下降相对较少(RR=0.50, 95%CI: 0.37~0.67, P < 0.00001),但重度血小板下降GP方案较其他方案严重(RR=1.99,95%CI: 1.24~3.19, P=0.004)。而重度贫血GP方案与其他方案差异无统计学意义(RR=1.02, 95%CI: 0.51~2.03, P=0.95),见图 2。在非血液系统中不良反应方面,GP方案所致重度恶心、呕吐的消化道反应较其他方案少(RR=0.50, 95%CI: 0.33~0.77, P=0.002),而重度肝功能损伤较其他方案多(RR=5.56, 95%CI: 1.87~16.47, P=0.002),差异均有统计学意义。在重度口腔炎(RR=0.94, 95%CI: 0.68~1.28, P=0.68)和重度皮疹方面(RR=0.74, 95%CI: 0.40~1.35,P=0.32)差异无统计学意义,见图 3。剔除化疗方式不是诱导化疗的三篇文献后,同样得出GP诱导化疗比TPF/TP诱导方案更易引起血小板下降,不易引起白细胞下降,见图 4。
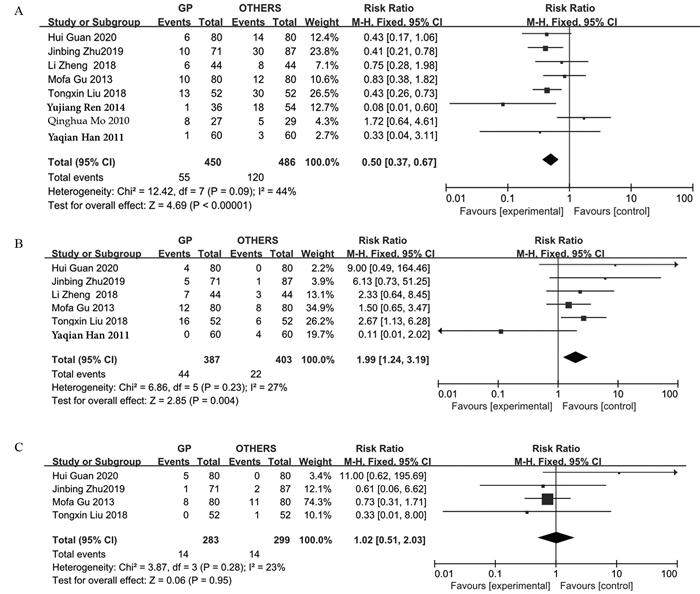
|
| A: leukopenia; B: thrombocytopenia; C: anemia. 图 2 在血液系统中不良反应的森林图 Figure 2 Forest plot of hematologic adverse reaction |
|
| A: hepatoxicity; B: gastrointestinal reactions; C: stomatitis/mucositis; D: rash. 图 3 非血液系统中不良反应的森林图 Figure 3 Forest plot of non-hematologic adverse reaction |
|
| 图 4 白细胞下降(A)及血小板下降(B)不良反应的森林图 Figure 4 Forest plot of leukopenia(A) and thrombocytopenia(B) |
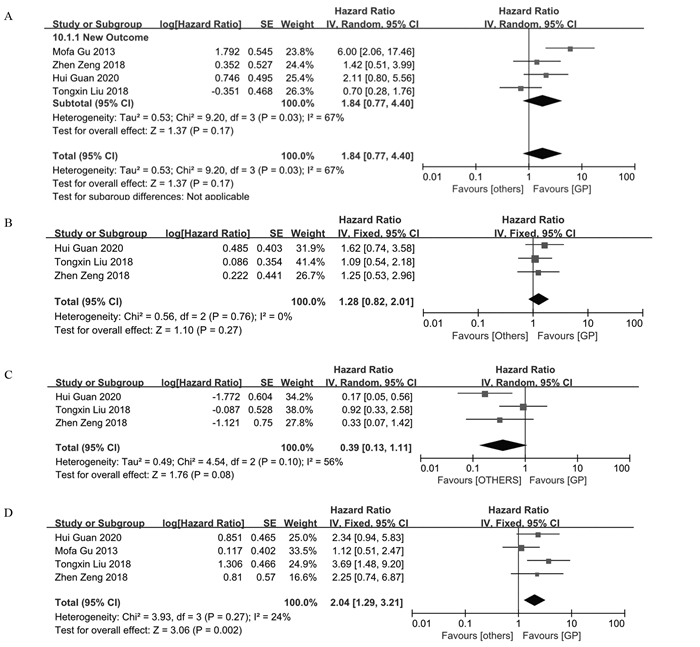
纳入提供HR的文献并对文献中描述预后的相关数据进行提取。通过比较其他组与GP组的HR,HR > 1提示GP组预后更好。RevMan5.3软件进行异质性检验,合并OS数据得出异质性I2=67%,可能与各研究方案间的化疗方式、化疗剂量等不完全相同有一定的关系,遂使用随机效应模型进行分析,结果显示:尚不能认为治疗局部晚期鼻咽癌患者使用GP方案比其他含铂类方案的患者OS更高(HR=1.84, 95%CI: 0.77~4.40, P=0.17);合并PFS的相关数据后得出异质性I2=0,使用固定效应模型进行分析,结果尚不能认为GP方案比其余含铂类方案PFS更好(HR=1.28, 95%CI: 0.82~2.01, P=0.27);合并数据LRFS得出异质性I2=56%,采用随机效应模型,结果显示:局部晚期鼻咽癌患者使用GP方案不比其他含铂类方案LRFS好,差异无统计学意义(HR=0.39, 95%CI: 0.13~1.11, P=0.08);合并数据DMFS得出异质性I2=24%,采用固定效应模型,结果显示:局部晚期鼻咽癌患者使用GP方案比其他含铂类方案DMFS好,差异有统计学意义(HR=2.04, 95%CI: 1.29~3.21, P=0.002)。同样剔除非诱导化疗文献,依然得出局部晚期鼻咽癌患者使用GP诱导方案比其他含铂类诱导方案DMFS好(HR=2.75, 95%CI: 1.57~4.81, P=0.004),见图 5。
|
| A: overall survival; B: progression-free survival; C: local recurrence-free survival; D: distant metastasis-free survival. 图 5 关于预后的Meta分析 Figure 5 Meta-analysis of prognosis |
7项不良反应的I2均小于50%,提示异质性低,采用了固定效应模型。改变分析模型为随机模式,结果大小和方向均无明显变化,敏感度低,稳定性可。通过逐一排除文献进行异质性分析,结果方向和大小均无明显变化,同样提示敏感度较低,说明稳定性尚可。在预后分析中由于纳入文献只有4篇,结果本身可能会不稳定,但通过逐一排除文献进行异质性分析,结果方向和大小均没有明显变化,见表 3。
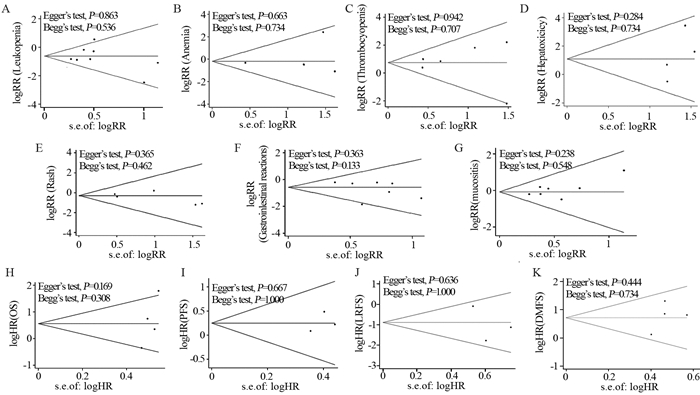
使用Stata15制作漏斗图没有明显的不对称性,进一步通过Begg’s和Egger’s法进行检验,P > 0.05,认为没有发表偏倚,见图 6。
|
| A: leukopenia; B: anemia; C: thrombocytopenia; D: hepatoxicity; E: rash; F: gastrointestinal reactions; G: Stomatitis; H: overall survival; I: progression-free survival; J: local recurrence-free survival; K: distant metastasis-free survival. 图 6 漏斗图及Begg's和Egger's检验结果 Figure 6 Results of Begg's and Egger's tests and funnel plots |
吉西他滨是一种胞嘧啶核苷衍生物,属于抗代谢类抗肿瘤药,主要通过控制细胞周期调控位点,阻止细胞从G1期到S期,影响DNA链合成从而导致肿瘤细胞死亡。紫杉醇是细胞周期M期特异性化疗药物,它可以直接作用于组成纺锤体的微蛋白,影响细胞分裂,从而抑制肿瘤细胞增殖[21]。5-氟尿嘧啶也是抗代谢类抗肿瘤药,作用于细胞周期S期,抑制DNA合成。PF方案诱导化疗联合同步放化疗与单纯同步放化疗相比,PF方案可提高LANC的局部控制率,降低远处转移率,且不良反应多数患者可耐受,但未提高总生存率,PF诱导化疗为治疗LANC的较为经典的治疗方案[22]。TP诱导化疗加同步放化疗较单纯同步放化疗可提高LANC患者的OS和PFS,TP方案为LANC可选的化疗方案之一。用TPF诱导化疗方案治疗LANC,患者OS及LRFS均优于PF方案[23-25]。GP诱导方案对复发或转移性鼻咽癌患者有生存益获,现已广泛用于其一线治疗[26]。关于GP方案在局部晚期鼻咽癌的治疗效果及安全性的研究结论不完全一致。我们首次行Meta分析对GP方案治疗局部晚期鼻咽癌的不良反应及预后进行阐述。
化疗不良反应的低级反应(Ⅰ~Ⅱ级)被认为是可耐受、易控制的,而重度反应(Ⅲ~Ⅳ级)常常会威胁生命[27]。本Meta分析发现GP方案比TPF/TP/PF方案具有相对低的致Ⅲ~Ⅳ级白细胞下降和消化道反应,但是致血小板下降与肝功能损害较其他方案风险要高。虽然改变分析模型后,合并结果的大小及方向没有明显变化,但是在随机效应模型下的肝功能损伤的结果差异无统计学意义,这可能与改变分析模型后纳入文献的所在权重也有所改变相关。但纳入文献间无明显异质性,我们仍可相信固定效应模型下的合并结果。结合临床,吉西他滨易引起短暂肝功能升高,但也有病例报告显示它可以造成严重的肝损害。这可能与吉西他滨引起乙肝病毒再激活[28]、肝纤维化[29]相关。因此,从药物安全性角度考虑,对于本身存在肝炎、肝功能异常的患者应该慎重选择GP方案化疗并严密监测肝功能。GP方案治疗鼻咽癌时较易引起血小板下降,用于肺癌、胰腺癌等的治疗,血小板减少症的患者也很常见[30],在非小细胞肺癌第一周期GP方案化疗后有近65%的患者出现血小板下降[31]。血小板的下降与骨髓抑制生成过少和血小板破坏过多相关,但为何吉西他滨更易引起血小板下降的机制尚不清楚。当发生严重化疗药物所致血小板下降时,患者出血风险增加、住院时间延长、医疗费用增加,常常还需化疗减量或者延迟化疗,还有可能需要停止化疗,影响疗效与预后。因此当患者存在出血高风险因素时应谨慎选择GP方案,若化疗结束后有明显血小板下降趋势应及时预防性用药。进一步分析预后发现GP方案能减少远处转移的发生率,OS与PFS虽然倾向于GP方案更好,但是差异无统计学意义,这可能与纳入研究偏少有关,因此需要更多的前瞻性临床试验去验证。LRFS方面GP方案似乎没有优势,但结果亦无统计学意义,而且文献间存在异质性,遗憾的是文献偏少,不能再进一步行亚组分析,放疗主要作用于局部区域,因此还需更多同质性的前瞻性研究证实GP方案是否真的在LRFS无优势。我们认为吉西他滨可作为局部晚期鼻咽癌诱导化疗可选方案,不仅减少远处转移,消化道反应与白细胞下降的化疗毒性比TP/TPF/PF方案低,且相应的治疗费用也较低[32],但应选择合适人群进行个体化治疗。
本研究存在一些局限:(1)研究数据都是从已发表的文献中直接提取,不是第一手病例资料。关于预后的资料提取,我们为减少提取生存分析图时造成计算错误,仅纳入了文章直接提供了HR数据的文献,因此文献数量有限,其本身就可能存在发表偏倚。(2)纳入的文献中研究对象均为中国人,样本量较小且多为回顾性研究。而且纳入文献的对照组化疗方案、剂量不一,研究组的化疗剂量也不完全一致,与GP对比的方案有多种,这些可能都会给结论带来一定的影响。(3)Meta分析是对现有的二手资料进行综合分析,不能取代大规模、多中心的随机双盲对照试验,因此Meta分析本身存在一定局限性,本研究的分析结果仅供参考,还有待高质量的前瞻性随机对照研究进一步证实。
作者贡献:
彭丽娟:论文构思与设计,收集、整理及分析数据并撰写论文
曾勇:收集、整理及分析数据并审校论文
王晖:提出研究、对研究结果进行分析与解释、审校论文
| [1] |
Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386. DOI:10.1002/ijc.29210 |
| [2] |
中国抗癌协会肿瘤标志专业委员会鼻咽癌标志物专家委员会. 鼻咽癌标志物临床应用专家共识[J]. 中国癌症防治杂志, 2019, 11(3): 183-193. [Nasopharyngeal Cancer Marker Expert Committee of China Anti-cancer Association Professional Committee. Expert consensus on the clinical application of nasopharyngeal carcinoma biomarkers[J]. Zhonghua Ai Zheng Fang Zhi Za Zhi, 2019, 11(3): 183-193.] |
| [3] |
许可葵, 王静, 廖先珍, 等. 2015年湖南省肿瘤登记地区恶性肿瘤的发病与死亡分析[J]. 中国肿瘤, 2019, 28(4): 271-280. [Xu KK, Wang J, Liao XZ, et al. Incidence and Mortality of Cancer in Hunan Cancer Registries, 2015[J]. Zhongguo Zhong Liu, 2019, 28(4): 271-280.] |
| [4] |
付振涛, 郭晓雷, 张思维, 等. 2014年中国鼻咽癌发病与死亡分析[J]. 中华肿瘤杂志, 2018, 40(8): 566-571. [Fu ZT, Gu XL, Zhang SW, et al. Incidence and mortality of nasopharyngeal carcinoma in China, 2014[J]. Zhonghua Zhong Liu Za Zhi, 2018, 40(8): 566-571.] |
| [5] |
Mao YP, Xie FY, Liu LZ, et al. Re-evaluation of 6th edition of AJCC staging system for nasopharyngeal carcinoma and proposed improvement based on magnetic resonance imaging[J]. Int J Radiat Oncol Biol Phys, 2009, 73(5): 1326-1334. DOI:10.1016/j.ijrobp.2008.07.062 |
| [6] |
Li JX, Huang SM, Jiang XH, et al. Local failure patterns for patients with nasopharyngeal carcinoma after intensity-modulated radiotherapy[J]. Radiat Oncol, 2014, 9: 87. DOI:10.1186/1748-717X-9-87 |
| [7] |
Au KH, Ngan RKC, Ng AWY, et al. Treatment outcomes of nasopharyngeal carcinoma in modern era after intensity modulated radiotherapy (IMRT) in Hong Kong: A report of 3328 patients (HKNPCSG 1301 study)[J]. Oral Oncol, 2018, 77: 16-21. DOI:10.1016/j.oraloncology.2017.12.004 |
| [8] |
Zhang Y, Sun Y, Ma J. Induction gemcitabine and cisplatin in locoregionally advanced nasopharyngeal carcinoma[J]. Cancer Commun (Lond), 2019, 39(1): 39. DOI:10.1186/s40880-019-0385-5 |
| [9] |
Zhu J, Duan B, Shi H, et al. Comparison of GP and TPF induction chemotherapy for locally advanced nasopharyngeal carcinoma[J]. Oral Oncol, 2019, 97: 37-43. DOI:10.1016/j.oraloncology.2019.08.001 |
| [10] |
Zheng L, Liao WJ, Xu P, et al. Tumor Volume Reduction After Gemcitabine Plus Cisplatin Induction Chemotherapy in Locally Advanced Nasopharyngeal Cancer: Comparison with Paclitaxel and Cisplatin Regimens[J]. Med Sci Monit, 2018, 24: 8001-8008. DOI:10.12659/MSM.909736 |
| [11] |
Liu T, Sun Q, Chen J, et al. A comparison of neoadjuvant chemotherapy with gemcitabine versus docetaxel plus cisplatin in locoregionally advanced nasopharyngeal carcinoma: a propensity score matching analysis[J]. Cancer Manag Res, 2018, 10: 6237-6245. DOI:10.2147/CMAR.S186233 |
| [12] |
Zeng Z, Yan RN, Tu L, et al. Assessment of Concurrent Chemoradiotherapy plus Induction Chemotherapy in Advanced Nasopharyngeal Carcinoma: Cisplatin, Fluorouracil, and Docetaxel versus Gemcitabine and Cisplatin[J]. Sci Rep, 2018, 8(1): 15581. DOI:10.1038/s41598-018-33614-5 |
| [13] |
Well G, Shea B, O'Connell D, et al. The Newcastle-Ottawa Scale(NOS) for assessing the quality of nonrandomised studies in meta-analyses[EB/OL]. http://ohri.ca/programs/clinical-epidemiology/oxforol.asp.
|
| [14] |
Guan H, He Y, Wei Z, et al. Assessment of induction chemotherapy regimen TPF vs GP followed by concurrent chemoradiotherapy in locally advanced nasopharyngeal carcinoma: A retrospective cohort study of 160 patients[J]. Clin Otolaryngol, 2020, 45(2): 274-279. DOI:10.1111/coa.13489 |
| [15] |
Gu MF, Liu LZ, He LJ, et al. Sequential chemoradiotherapy with gemcitabine and cisplatin for locoregionally advanced nasopharyngeal carcinoma[J]. Int J Cancer, 2013, 132(1): 215-223. DOI:10.1002/ijc.27638 |
| [16] |
潘学兵, 何宇, 邵俊伟, 等. 吉西他滨或紫杉醇联合奈达铂治疗局部晚期鼻咽癌效果比较[J]. 肿瘤研究与临床, 2017, 29(6): 394-397. [Pan XB, He Y, Shao JW, et al. Efficacy comparison between gemcitabine combined with nedaplatin and paclitaxel combined with nedaplatin in treatment of locally advanced nasopharyngeal carcinoma[J]. Zhong Liu Yan Jiu Yu Lin Chuang, 2017, 29(6): 394-397.] |
| [17] |
王羽, 陈国健, 程霞, 等. PF、GP及DC方案诱导化疗联合放疗局部晚期鼻咽癌的近期疗效比较[J]. 深圳中西医结合杂志, 2015, 25(15): 1-3. [Wang Y, Chen GJ, Cheng X, et al. Clinical Therapeutic Study of Different Induction Chemotherapy with Radiotherapy on Advanced Nasopharygeal Carcinoma[J]. Shenzhen Zhong Xi Yi Jie He Za Zhi, 2015, 25(15): 1-3.] |
| [18] |
韩亚骞, 范长根, 陈艳平, 等. 吉西他滨联合奈达铂同期放化疗治疗局部晚期鼻咽癌的疗效观察[J]. 中国肿瘤临床与康复, 2011, 18(2): 165-167. [Han YQ, Fan CG, Chen YP, et al. The observation of efficacy of gemcitabine and nedaplatin chemotherapy combined with concurrent radiotherapy in treatment of local advanced nasopharyngeal carcinoma[J]. Zhongguo Zhong Liu Lin Chuang Yu Kang Fu, 2011, 18(2): 165-167.] |
| [19] |
莫清华, 金军, 周隆军, 等. GP方案同期放化疗治疗局部晚期鼻咽癌的近期临床观察[J]. 中华肿瘤防治杂志, 2010, 17(10): 775-776, 781. [Mo QH, Jin J, Zhou LJ, et al. Clinical observation of GP combined with chemo-radiotherapy for local advanced nasopharynegeal carcinoma[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2010, 17(10): 775-776, 781.] |
| [20] |
任育江, 王阁, 胡南, 等. 不同诱导化疗方案联合同步调强放疗治疗局部晚期鼻咽癌的临床观察[J]. 中国药房, 2014, 25(22): 2064-2066. [Ren YJ, Wang G, Hu N, et al. Clinical Observation of Different Inductive Chemotherapy Combined with Radiotherapy in the Treatment of Local Advanced Nasopharyngeal Carcinoma[J]. Zhongguo Yao Fang, 2014, 25(22): 2064-2066.] |
| [21] |
Fuchs DA, Johnson RK. Cytologic evidence that taxol, an antineoplastic agent from Taxus brevifolia, acts as a mitotic spindle poison[J]. Cancer Treat Rep, 1978, 62(8): 1219-1222. |
| [22] |
谢鹏, 姜力, 夏冬梅, 等. 诱导化疗+IMRT同期化疗与IMRT同期化疗治疗局部中晚期鼻咽癌的远期疗效比较[J]. 肿瘤防治研究, 2016, 43(11): 969-973. [Xie P, Jiang L, Xia DM, et al. Comparison of Long-term Efficacy of IMRT plus Concurrent Chemotherapy Versus Neoadjuvant Chemotherapy Followed by IMRT plus Concurrent Chemotherapy for Locoregionally Advanced Nasopharyngeal Carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(11): 969-973.] |
| [23] |
Hitt R, López-Pousa A, Martínez-Trufero J, et al. Phase Ⅲ study comparing cisplatin plus fluorouracil to paclitaxel, cisplatin, and fluorouracil induction chemotherapy followed by chemoradiotherapy in locally advanced head and neck cancer[J]. J Clin Oncol, 2005, 23(34): 8636-8645. DOI:10.1200/JCO.2004.00.1990 |
| [24] |
Chen L, Hu CS, Chen XZ, et al. Concurrent chemoradiotherapy plus adjuvant chemotherapy versus concurrent chemoradiotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma: a phase 3 multicentre randomised controlled trial[J]. Lancet Oncol, 2012, 13(2): 163-171. DOI:10.1016/S1470-2045(11)70320-5 |
| [25] |
Peng H, Tang LL, Chen BB, et al. Optimizing the induction chemotherapy regimen for patients with locoregionally advanced nasopharyngeal Carcinoma: A big-data intelligence platform-based analysis[J]. Oral Ocol, 2018, 79: 40-46. |
| [26] |
Zhang L, Huang Y, Hong S, et al. Gemcitabine plus cisplatin versus fluorouracil plus cisplatin in recurrent or metastatic nasopharyngeal carcinoma: a multicentre, randomised, open-label, phase 3 trial[J]. Lancet, 2016, 388(10054): 1883-1892. DOI:10.1016/S0140-6736(16)31388-5 |
| [27] |
Trotti A, Colevas AD, Setser A, et al. CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment[J]. 2003, 13(3): 176-181.
|
| [28] |
Cheong K, Li J, Karapetis CS. Gemcitabine and reactivation of hepatitis B[J]. Med Oncol, 2003, 20(4): 385-388. DOI:10.1385/MO:20:4:385 |
| [29] |
Saif MW, Shahrokni A, Cornfeld D. Gemcitabine-induced liver fibrosis in a patient with pancreatic cancer[J]. JOP, 2007, 8(4): 460-467. |
| [30] |
Cassidy CA, Peterson P, Cirera L, et al. Incidence of thrombocytopenia with gemcitabine-based therapy and influence of dosing and schedule[J]. Anticancer Drugs, 2001, 12(4): 383-385. DOI:10.1097/00001813-200104000-00012 |
| [31] |
Wang Z, Cai XJ, Chen LY, et al. Factors potentially associated with gemcitabine-based chemotherapy-induced thrombocytopenia in Chinese patients with nonsmall cell lung cancer[J]. J Cancer Res Ther, 2018, 14(Supplement): S656-S660. |
| [32] |
Wu Q, Liao W, Huang J, et al. Cost-effectiveness analysis of gemcitabine plus cisplatin versus docetaxel, cisplatin and fluorouracil for induction chemotherapy of locoregionally advanced nasopharyngeal carcinoma[J]. Oral Oncol, 2020, 103: 104588. DOI:10.1016/j.oraloncology.2020.104588 |
 2021, Vol. 48
2021, Vol. 48