文章信息
- lncRNA FAL1通过调控MAPK通路对卵巢癌细胞化疗耐药性的影响及其机制
- Effect of lncRNA FAL1 on Chemotherapy Resistance of Ovarian Cancer Cells by Regulating MAPK Pathway and Related Mechanism
- 肿瘤防治研究, 2021, 48(4): 333-340
- Cancer Research on Prevention and Treatment, 2021, 48(4): 333-340
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0752
- 收稿日期: 2020-06-30
- 修回日期: 2021-01-06
卵巢癌是女性常见的恶性肿瘤之一,多数患者确诊晚,死亡率较高,占所有癌症死亡的5%[1]。尽管通过手术、化疗等一线治疗方法进行积极治疗,但被诊断为Ⅲ期或Ⅳ期的卵巢癌5年生存率仍低于25%,主要原因为治疗后复发并最终发展为化疗耐药[2]。因此,探究卵巢癌化疗耐药机制,寻找潜在的治疗靶点成为提高卵巢癌治疗效果、改善预后的关键。长链非编码RNA(long noncoding RNA, lncRNA)是一类长度大于200 nt的非编码RNA,越来越多的研究证明,lncRNA可根据其结合的伴侣类型和数量发挥多种功能,可能在正常发育和疾病发展过程中发挥关键调节作用,可与信号通路中的分子直接相互作用而调控细胞信号转导[3-4]。研究发现,lncRNA FAL1在胃癌、结肠癌、甲状腺癌等多种恶性肿瘤中异常高表达,可促进细胞增殖、转移和抑制细胞凋亡[5-7]。丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)信号通路与癌症代谢过程之间的联系已经得到了广泛研究,MAPK的激活是肿瘤发生的重要特征,MAPK在乳腺癌、肝癌、胃癌等耐药细胞株中均呈显著高表达状态,抑制该信号通路的激活则能不同程度逆转耐药细胞的化疗耐药性[8]。目前,关于lncRNA FAL1在卵巢癌中的表达及对其化疗耐药性方面的研究尚少,其作用机制尚不清晰,因此,本研究以MAPK信号通路为切入点,构建FAL1基因沉默SKOV3/DDP和COC1/DDP细胞,观察下调FAL1对卵巢癌细胞化疗耐药性的影响,并初步探究其作用机制。
1 材料与方法 1.1 细胞人卵巢癌SKOV3、COC1细胞株及其顺铂耐药细胞株SKOV3/DDP、COC1/DDP,购自中科院上海细胞库。细胞培养在含有10%胎牛血清的DMEM培养基中,培养条件为5%CO2、37℃。每2~3 d传代一次,取对数生长期的细胞用于实验。
1.2 动物24只SPF级6周龄雄性BALB/c裸鼠,体重18~20 g,购自北京维通利华实验动物技术有限公司(实验动物生产许可证号码:SCXK(京)2017-0011),饲养于河南省实验动物中心实验室独立动物房(实验动物使用许可证号码:SYXK(豫)2016-0002)。
1.3 试剂与仪器顺铂(Cisplatin,DDP,美国Sigma-Aldrich公司,批号:P4394);DMEM培养基,MTT染色试剂盒、Transwell小室、基质胶、结晶紫染液、胎牛血清,青链霉素混合液(100×),胰蛋白酶-EDTA消化液,RIPA裂解液、PMSF、脱脂奶粉、ECL发光液、PVDF转印膜(北京索莱宝科技有限公司);吉姆萨染色试剂盒(上海生工生物工程股份有限公司);Lipofectamine2000(北京沃比森科技公司);FAL1干扰序列FAL1-siRNA及其阴性对照NC-siRNA委托上海吉玛公司构建;RevertAidTM First Strand cDNA Synthesis Kit(美国Thermo Scientific公司);引物(日本Takara公司);MDR-1、MPR-1、ABCG2、p38 MAPK、p-p38 MAPK、ERK1/2、p-ERK1/2、JNK、p-JNK、GAPDH兔源单克隆抗体,羊抗兔二抗(美国CST公司);IX53显微镜(日本奥林巴斯);TGL16MB高速冷冻离心机(长沙湘智离心机仪器有限公司);DYCZ-24KS型双板垂直电泳仪(北京六一仪器厂);G: BOX多功能凝胶成像系统(Syngene)。
1.4 方法 1.4.1 qRT-PCR检测卵巢癌细胞及其耐药细胞中FAL1 mRNA表达差异收集细胞,胰酶消化、离心后收集细胞沉淀,加入适量Trizol裂解液提取细胞总RNA,使用RevertAidTM First Strand cDNA Synthesis Kit反转录试剂盒合成cDNA,作为荧光定量模版。引物由日本Takara公司设计合成,所有样品均以GAPDH作为内参。反应体系:dNTPs 0.5 μl+ 5×Buffer 5 μl+Taq酶0.3 μl+MgCl2 1.5 μl+cDNA模板2 μl+上下游引物分别1 μl,加去离子水至总体积25 μl。反应条件为:95℃预变性5 min,95℃变性30 s、62℃退火30 s、72℃延伸30 s,重复40个循环,最后72℃延伸10 min,4℃ 5 min终止反应,实验重复3次。采用2-△△CT的方法计算目的基因mRNA相对表达水平的变化。引物序列见表 1。
收集对数生长期的SKOV3/DDP、COC1/DDP细胞,接种至6孔板中,浓度为5×105个/孔。当细胞生长融合至70%~80%时,参照Lipofectamine2000试剂盒说明书,对细胞转染NC-siRNA、FAL1-siRNA,转染5 h后更换为正常培养基,继续培养48 h后收集各组细胞进行后续实验。通过qRT-PCR法检测转染后细胞中FAL1 mRNA的表达量,确定转染是否成功,方法同1.4.1。
1.4.3 MTT法检测细胞增殖能力收集细胞,消化、离心、重悬后计数,以3×103个/孔的浓度接种于96孔板中,继续培养24 h后换液,加入DDP浓度为0、3.13、6.25、12.5、25、50 μg/ml的含药培养基,每孔100 μl,每组设置4个复孔,置培养箱中培养48 h,培养结束后,每孔细胞中加入20 μl 5 mg/ml的MTT溶液,在37℃下继续孵育4 h后终止培养,弃上清液,每孔加入150 μl DMSO,充分振荡混匀使结晶溶解,在490 nm波长下检测OD值,计算药物的半抑制浓度(IC50),选择小于IC50的DDP浓度(6.25 μmol/L)进行后续实验。
1.4.4 Transwell法检测细胞侵袭能力收集细胞,使用DDP处理48 h,消化、离心、重悬,采用无血清培养基稀释细胞,按照2×104个/孔的浓度接种于已铺有基质胶的上室,每孔200 μl,下室加入600 μl的DMEM完全培养基,置培养箱中继续培养24 h之后,取出上室,用甲醇固定20 min,棉签擦掉上室残余细胞,1%的结晶紫染色15 min,PBS缓冲液冲洗2遍,置于显微镜下观察,选取4个高倍视野进行细胞计数,取平均值。
1.4.5 平板克隆形成实验检测细胞克隆能力收集细胞,使用DDP处理48 h,消化、离心、重悬后计数,按照1 000个/孔的浓度接种于6孔板中,每组设置3个复孔,加入2 ml DMEM完全培养基,每3~4 d更换一次,共培养14 d。培养结束后,吸弃培养基,PBS缓冲液清洗2次,每孔加入1 ml 4%多聚甲醛溶液固定细胞,30 min后吸出多聚甲醛溶液,PBS缓冲液清洗2次,加入1 ml吉姆萨A染液染色5 min,加入B染液2 ml染色15 min,PBS缓冲液清洗至6孔板无染料残留,晾干后置显微镜10倍镜下观察,统计细胞数大于10个的克隆数,重复3次,取平均值。
1.4.6 Western blot法检测细胞耐药相关蛋白及MAPK信号通路相关蛋白表达水平采用Western blot法检测细胞蛋白表达水平。收集细胞,胰酶消化、离心后收集细胞沉淀,加入蛋白裂解液置冰上裂解20 min,离心取上清液,BCA蛋白定量法测定蛋白的浓度,加入上样缓冲液,EP管中混匀后置于沸水中煮沸5 min使蛋白变性。配置15%的分离胶和5%的浓缩胶,每个样本取30 μg进行SDS-PAGE电泳,上样后80 V电泳2 h,60 V转膜2 h。PVDF膜置于5%脱脂奶粉中室温下封闭2 h,随后将条带放入10 ml MDR-1、MPR-1、ABCG2、p38 MAPK、p-p38 MAPK、ERK1/2、p-ERK1/2、GAPDH兔源一抗蛋白稀释液中,一抗稀释比例为1:2 000,置于4℃冰箱中过夜,第2天用TBST缓冲液清洗3次,每次10 min。37℃环境下加入羊抗兔二抗孵育2 h,二抗稀释比例为1:1 000,TBST缓冲液清洗3次后滴加ECL发光液,反应1 min后置于凝胶成像系统显影。免疫印迹实验的内参蛋白为GAPDH,用Image J软件分析各个蛋白对应的灰度值,计算蛋白的相对表达量,蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。
1.4.7 裸鼠皮下移植瘤小鼠适应性饲养3天后,将已转染NC-siRNA或FAL1-siRNA的SKOV3/DDP和COC1/DDP细胞(100 μl, 1×107个/毫升)注射至小鼠右前肢皮下,待肿瘤组织生长至100 mm3左右时,使用游标卡尺测量,瘤体积(mm3)=0.5×长径×短径2,每周测量一次瘤体积,待第4周(第28天)时测量瘤体积后处死小鼠,收集瘤组织并称重。
1.5 统计学方法应用SPSS25.0软件进行数据统计分析,GraphPad Prism 8.0作图,实验重复3次,计量资料以均数±标准差(x±s)表示,多样本比较采用单因素方差分析,两样本比较采用SNK-q检验。P < 0.05为差异有统计学意义。
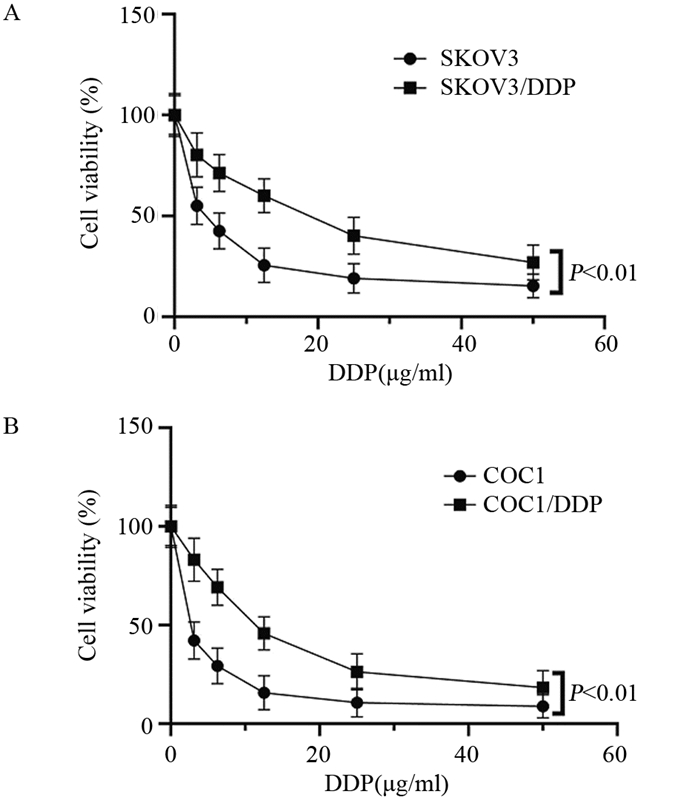
2 结果 2.1 FAL1基因表达与卵巢癌细胞化疗耐药性的关系不同浓度DDP处理SKOV3、COC1细胞及SKOV3/DDP、COC1/DDP细胞,细胞的增殖活力均降低,DDP对SKOV3细胞的IC50为(3.50±0.42)μg/ml,对SKOV3/DDP细胞的IC50为(15.25±1.01)μg/ml,DDP对COC1细胞的IC50为(2.15±0.22)μmol/ml,DDP对COC1/DDP细胞的IC50为(9.88±0.45)μmol/ml。见图 1。qRT-PCR检测结果显示,SKOV3、SKOV3/DDP细胞中FAL1 mRNA的表达水平分别为1.05±0.06、2.53±0.15,与SKOV3细胞比较,SKOV3/DDP细胞中FAL1基因的表达水平显著增加,差异有统计学意义(P < 0.01)。COC1、COC1/DDP细胞中FAL1 mRNA的表达水平分别为0.89±0.09、1.96±0.13,与COC1细胞比较,COC1/DDP细胞中FAL1基因的表达水平显著增加,差异有统计学意义(P < 0.01),见图 2。
|
| 图 1 MTT法检测卵巢癌细胞及其耐药株对DDP的敏感度差异 Figure 1 Differences in sensitivity of ovarian cancer cells and their drug-resistant cell lines to DDP detected by MTT |

|
| 图 2 FAL1在卵巢癌细胞及其耐药株中的表达情况 Figure 2 Expression of FAL1 in ovarian cancer cells and their drug-resistant cell lines |
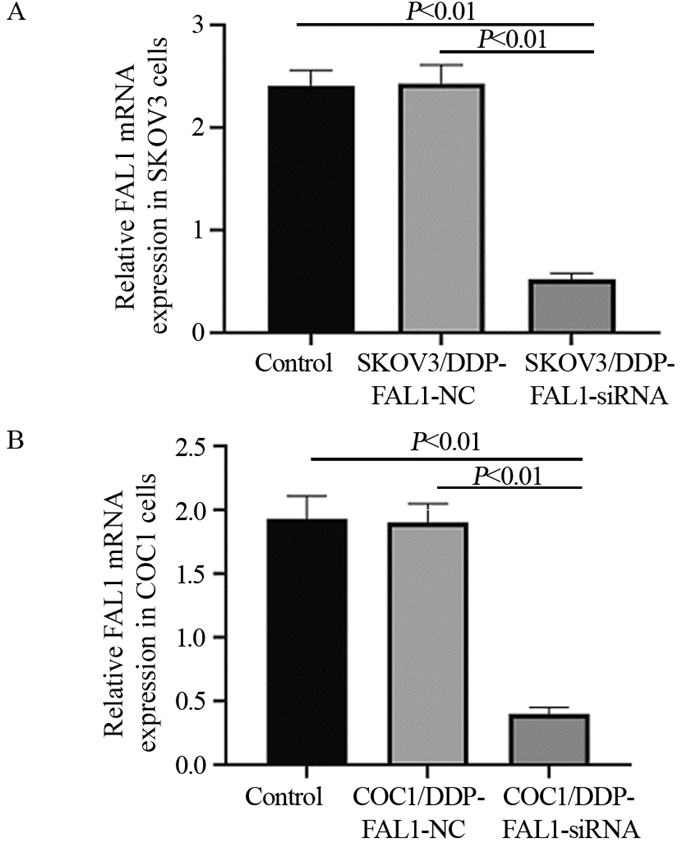
在SKOV3/DDP和COC1/DDP细胞中,转染NC-siRNA未改变FAL1 mRNA表达水平(P > 0.05),转染FAL1-siRNA使SKOV3/DDP和COC1/DDP细胞中FAL1 mRNA表达量显著降低(均P < 0.01),证明两种细胞均转染成功,见图 3。
|
| 图 3 qRT-PCR法检测转染后各组细胞中FAL1 mRNA的表达量 Figure 3 Expression of FAL1 mRNA in each group after transfection detected by qRT-PCR |
MTT实验结果显示,采用不同浓度的DDP处理各组细胞后,转染NC-siRNA未改变细胞对DDP的敏感度(P > 0.05),转染FAL1-siRNA后,SKOV3/DDP和COC1/DDP细胞的增殖被DDP显著抑制(P < 0.01)。在SKOV3/DDP细胞中,DDP对照组(control)、SKOV3/DDP-FAL1-NC组和SKOV3/DDP-FAL1-siRNA组细胞的IC50分别为(15.66±1.85)μg/ml、(15.25±1.12)μg/ml和(8.24±1.05)μg/ml。在COC1/DDP细胞中,DDP对照组(Control)、COC1/DDP-FAL1-NC组和COC1/DDP-FAL1-siRNA组细胞的IC50分别为(10.02±0.59)μg/ml、(9.69±0.68)μg/ml、(4.22±0.42)μg/ml,见图 4。

|
| 图 4 FAL1基因下调对细胞化疗耐药性的影响 Figure 4 Effect of FAL1 gene downregulation on cell chemotherapy resistance |
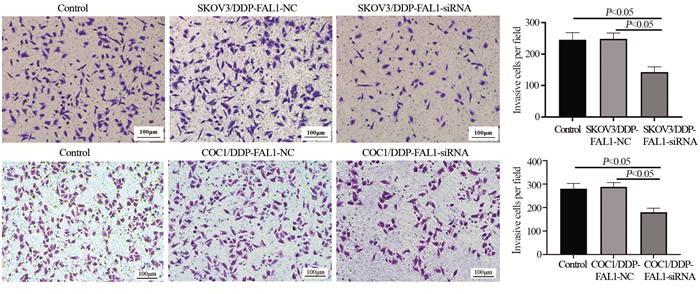
采用DDP处理48 h后,结果显示,转染NC-siRNA未改变细胞的侵袭能力(P > 0.05),转染FAL1-siRNA后,SKOV3/DDP和COC1/DDP细胞的侵袭能力被DDP显著抑制,穿膜数量显著减少(P < 0.05),见图 5。
|
| 图 5 FAL1基因下调对SKOV3/DDP和COC1/DDP细胞侵袭能力的影响(×400) Figure 5 Effect of FAL1 gene downregulation on invasion abilities of SKOV3/DDP and COC1/DDP cells (×400) |
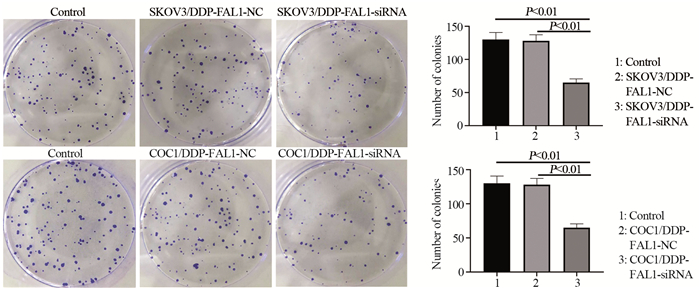
采用DDP处理48h后,结果显示转染NC-siRNA未改变细胞的克隆能力(P > 0.05),转染FAL1-siRNA后,SKOV3/DDP和COC1/DDP细胞的克隆能力被DDP显著抑制,克隆数量显著减少,差异有统计学意义(P < 0.05)。见图 6。
|
| 图 6 FAL1基因下调对SKOV3/DDP和细胞克隆能力的影响 Figure 6 Effect of FAL1 gene downregulation on cloning abilities of SKOV3/DDP and COC1/DDP cells |
结果显示,一定剂量的DDP可使耐药相关蛋白MDR-1、MPR-1、ABCG2的相对表达水平降低(P < 0.05),而与Control+DDP组比较,转染NC-siRNA未改变耐药相关蛋白MDR-1、MPR-1、ABCG2的相对表达水平(P > 0.05),转染FAL1-siRNA后,SKOV3/DDP和COC1/DDP细胞耐药相关蛋白MDR-1、MPR-1、ABCG2的相对表达水平降低,差异有统计学意义(P < 0.05),见图 7。

|
| **: P < 0.01. 图 7 FAL1基因下调对细胞耐药相关蛋白表达的影响 Figure 7 Effect of FAL1 gene downregulation on expression of cell resistance-related proteins |
结果显示,一定剂量的DDP可使SKOV3/DDP和COC1/DDP细胞p38 MAPK、ERK1/2和JNK的磷酸化水平降低(P < 0.05)。而与Control+DDP组比较,转染NC-siRNA未改变SKOV3/DDP和COC1/DDP细胞p38 MAPK、ERK1/2和JNK的磷酸化水平(P > 0.05),转染FAL1-siRNA后,SKOV3/DDP和COC1/DDP细胞p38 MAPK、ERK1/2和JNK的磷酸化水平降低,差异有统计学意义(P < 0.05),见图 8。

|
| *: P < 0.05. 图 8 FAL1基因下调对MAPK信号通路相关蛋白表达的影响 Figure 8 Effect of FAL1 gene downregulation on expression of proteins related to MAPK signaling pathway |
结果显示,与SKOV3/DDP-FAL1-NC组或COC1/DDP-FAL1-NC组比较,转染FAL1-siRNA使SKOV3/DDP-FAL1-siRNA和COC1/DDP-FAL1-siRNA细胞皮下移植瘤体积显著缩小(P < 0.01),见图 9。
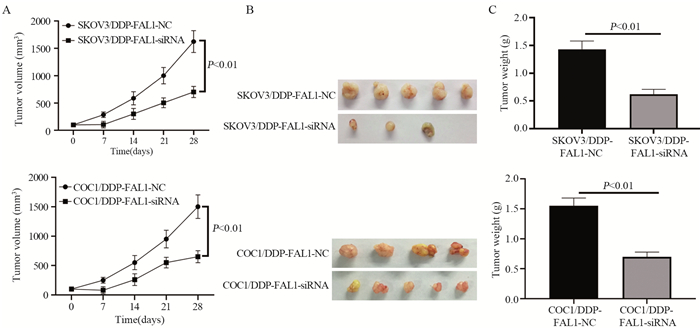
|
| 图 9 下调FAL-1对SKOV3/DDP和COC1/DDP皮下移植瘤的影响 Figure 9 Effect of FAL-1 downregulation on SKOV3/DDP and COC1/DDP subcutaneous transplantation tumor |
人类基因组中所包含的具有编码蛋白质功能的基因约20 000个,仅占整个基因组的1.5%左右,其余的基因被称为非编码RNA[9]。ncRNA最初被认为是基因组转录"噪音",随着研究不断深入,人们逐渐发现无论是长链或是短链ncRNA,均对多种人类疾病具有调控作用[10-12]。研究证明,卵巢癌中存在异常表达的长链非编码RNA(lncRNAs),其中某些lncRNAs已被证实可通过调控肿瘤细胞的增殖、凋亡和侵袭过程发挥抗癌或促癌作用[13-14]。1号染色体上局部扩增的lncRNA FAL1是一种具有增强子样活性的新型lncRNA,已被确定为多种癌症的致癌基因,能够促进癌细胞的增殖和转移,而FAL1的高表达水平也通常预示着恶性肿瘤患者预后不良[15]。
虽然Zhang等[16]指出FAL1在卵巢癌中呈高表达状态,但FAL1与卵巢癌化疗耐药性的关系及其作用机制尚不清楚。在本研究中,我们发现卵巢癌耐顺铂细胞株SKOV3/DDP和COC1/DDP细胞对顺铂的敏感度显著低于其亲本细胞株,而FAL1基因的表达水平显著高于其亲本细胞株,初步证实了lncRNA FAL1的高表达状态与卵巢癌细胞呈现化疗耐药性有关,而下调FAL1基因则显著降低了细胞的增殖、侵袭和克隆能力,表明沉默FAL1基因可以显著降低卵巢癌耐药细胞的生物学功能,提高其对化疗药物的敏感度。研究表明,ATP结合盒(ABC)外排蛋白家族,尤其是MDR-1、MPR-1、ABCG2的表达可赋予肿瘤细胞对细胞毒性药物和靶向化疗的耐药性[17]。Eid等[18]研究表明,抑制ABCC1,ABCG2和ABCB1等多药耐药蛋白的表达可诱导细胞凋亡,减少耐药性的产生。与上述研究一致,在本研究中,转染FAL1-siRNA使细胞中耐药相关蛋白MDR-1、MPR-1、ABCG2的表达水平显著降低,细胞对DDP的敏感度增加,进一步证明lncRNA FAL1的高表达状态诱导了卵巢癌细胞的化疗耐药性,沉默FAL1基因则可显著抑制卵巢癌细胞化疗耐药性的产生。MAPK信号通路是人类癌症中最常见的突变信号转导途径,靶向MAPK途径的治疗长期以来被认为是一种具有良好应用前景的癌症治疗策略,靶向作用于p38 MAPK、ERK、JNK等MAPK途径关键基因可以抑制干扰细胞的增殖、转移等活动,针对该信号通路的抑制剂ulixertinib在临床试验中表现出对晚期实体瘤有较好的治疗效果和良好的药动学过程[19-20]。Tang等[21]研究表明,激活MAPK途径可促进肿瘤细胞增殖、侵袭和迁移,并抑制细胞凋亡。与上述研究一致,本研究发现,FAL1基因高表达的SKOV3/DDP和COC1/DDP细胞中,p38 MAPK、ERK1/2、JNK的磷酸化水平较高,使用DDP处理后,p38 MAPK、ERK1/2、JNK的磷酸化水平降低,而下调FAL1基因可使耐药细胞中p38 MAPK、ERK1/2、JNK的磷酸化水平显著降低,表明lncRNA FAL1可能通过激活MAPK信号通路促进卵巢癌SKOV3细胞产生化疗耐药性,沉默FAL1基因则可显著抑制MAPK信号通路的活化。
综上所述,沉默FAL1基因可显著降低卵巢癌耐顺铂细胞株的化疗耐药性,抑制耐药细胞在体内的增殖能力,其作用机制与抑制MAPK信号通路的活化有关。然而,LncRNA调控方式有多种,本研究仅在动物和细胞水平进行了初步探讨,其具体作用机制仍需更多研究加以验证。
作者贡献:
栗浩然:研究设计、细胞实验及论文撰写
王雅莉:细胞实验
李红娟:动物实验
相元翠:数据统计
刘会敏:指导实验
| [1] |
Torre LA, Trabert B, DeSantis CE, et al. Ovarian cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(4): 284-296. DOI:10.3322/caac.21456 |
| [2] |
Odunsi K. Immunotherapy in ovarian cancer[J]. Ann Oncol, 2017, 28(suppl_8): viii1-viii7. |
| [3] |
Wilusz JE. Long noncoding RNAs: Re-writing dogmas of RNA processing and stability[J]. Biochim Biophys Acta, 2016, 1859(1): 128-138. DOI:10.1016/j.bbagrm.2015.06.003 |
| [4] |
Peng WX, Koirala P, Mo YY. LncRNA-mediated regulation of cell signaling in cancer[J]. Oncogene, 2017, 36(41): 5661-5667. DOI:10.1038/onc.2017.184 |
| [5] |
Zhu CH, Xiao DH, Dai LG, et al. Highly expressed lncRNA FAL1 promotes the progression of gastric cancer by inhibiting PTEN[J]. Eur Rev Med Pharmacol Sci, 2018, 22(23): 8257-8264. |
| [6] |
Wu K, Zhang N, Ma J, et al. Long noncoding RNA FAL1 promotes proliferation and inhibits apoptosis of human colon cancer cells[J]. IUBMB Life, 2018, 70(11): 1093-1100. DOI:10.1002/iub.1880 |
| [7] |
Jeong S, Lee J, Kim D, et al. Relationship of focally amplified long noncoding on chromosome 1 (FAL1) lncRNA with E2F transcription factors in thyroid cancer[J]. Medicine (Baltimore), 2016, 95(4): e2592. DOI:10.1097/MD.0000000000002592 |
| [8] |
柴冬亚, 袁佳琪, 周轶平. MAPK信号通路影响肿瘤多药耐药的研究进展[J]. 中国新药杂志, 2019, 28(8): 948-953. [Chai DY, Yuan JQ, Zhou YP. Research progress of MAPK signaling pathway for multidrug resistance in tumors[J]. Zhongguo Xin Yao Za Zhi, 2019, 28(8): 948-953.] |
| [9] |
Li J, Li Z, Zheng W, et al. LncRNA-ATB: An indispensable cancer-related long noncoding RNA[J]. Cell Prolif, 2017, 50(6): e12381. DOI:10.1111/cpr.12381 |
| [10] |
Huang Y. The novel regulatory role of lncRNA-miRNA-mRNA axis in cardiovascular diseases[J]. J Cell Mol Med, 2018, 22(12): 5768-5775. DOI:10.1111/jcmm.13866 |
| [11] |
Zhang Z, Qian W, Wang S, et al. Analysis of lncRNA-Associated ceRNA Network Reveals Potential lncRNA Biomarkers in Human Colon Adenocarcinoma[J]. Cell Physiol Biochem, 2018, 49(5): 1778-1791. DOI:10.1159/000493623 |
| [12] |
Wang L, Cho KB, Li Y, et al. Long noncoding RNA (lncRNA)-mediated competing endogenous RNA networks provide novel potential biomarkers and therapeutic targets for colorectal cancer[J]. Int J Mol Sci, 2019, 20(22): 5758. DOI:10.3390/ijms20225758 |
| [13] |
Li J, Yang C, Li Y, et al. LncRNA GAS5 suppresses ovarian cancer by inducing inflammasome formation[J]. Biosci Rep, 2018, 38(2): BSR20171150. DOI:10.1042/BSR20171150 |
| [14] |
Liang H, Yu T, Han Y, et al. LncRNA PTAR promotes EMT and invasion-metastasis in serous ovarian cancer by competitively binding miR-101-3p to regulate ZEB1 expression[J]. Mol Cancer, 2018, 17(1): 119. DOI:10.1186/s12943-018-0870-5 |
| [15] |
Lv X, Li Y, Li Y, et al. FAL1: A critical oncogenic long non-coding RNA in human cancers[J]. Life Sci, 2019, 236: 116918. DOI:10.1016/j.lfs.2019.116918 |
| [16] |
Zhang Q, Len TY, Zhang SX, et al. Exosomes transferring long non-coding RNA FAL1 to regulate ovarian cancer metastasis through the PTEN/AKT signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2020, 24(1): 43-54. |
| [17] |
Robey RW, Pluchino KM, Hall MD, et al. Revisiting the role of ABC transporters in multidrug-resistant cancer[J]. Nat Rev Cancer, 2018, 18(7): 452-464. DOI:10.1038/s41568-018-0005-8 |
| [18] |
Eid SY, Althubiti MA, Abdallah ME, et al. The carotenoid fucoxanthin can sensitize multidrug resistant cancer cells to doxorubicin via induction of apoptosis, inhibition of multidrug resistance proteins and metabolic enzymes[J]. Phytomedicine, 2020, 77: 153280. DOI:10.1016/j.phymed.2020.153280 |
| [19] |
Liu F, Yang X, Geng M, et al. Targeting ERK, an Achilles' Heel of the MAPK pathway, in cancer therapy[J]. Acta Pharm Sin B, 2018, 8(4): 552-562. DOI:10.1016/j.apsb.2018.01.008 |
| [20] |
Sullivan RJ, Infante JR, Janku F, et al. First-in-Class ERK1/2 Inhibitor Ulixertinib (BVD-523) in Patients with MAPK Mutant Advanced Solid Tumors: Results of a Phase Ⅰ Dose-Escalation and Expansion Study[J]. Cancer Discov, 2018, 8(2): 184-195. DOI:10.1158/2159-8290.CD-17-1119 |
| [21] |
Tang G, Zeng Z, Sun W, et al. Small Nucleolar RNA 71A Promotes Lung Cancer Cell Proliferation, Migration and Invasion via MAPK/ERK Pathway[J]. J Cancer, 2019, 10(10): 2261-2275. DOI:10.7150/jca.31077 |
 2021, Vol. 48
2021, Vol. 48



