文章信息
- 沉默LncRNA WT1-AS对三阴性乳腺癌细胞MDA-MB-231侵袭和迁移的影响
- LncRNA WT1-AS Knockdown Promotes Invasion and Migration of Triple Negative Breast Cancer MDA-MB-231 Cells
- 肿瘤防治研究, 2021, 48(3): 244-247
- Cancer Research on Prevention and Treatment, 2021, 48(3): 244-247
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0744
- 收稿日期: 2020-06-30
- 修回日期: 2020-10-16
2. 443100 宜昌,宜昌市夷陵医院肿瘤内科;
3. 443000 宜昌,国药葛洲坝中心医院肿瘤内科
2. Department of Oncology, Yiling Hospital, Yichang 443100, China;
3. Department of Oncology, Gezhouba Central Hospital, Yichang 443000, China
三阴性乳腺癌(triple-negative breast cancer,TNBC)是一种人表皮生长因子2(human epidermal growth factor receptor 2, HER2)、雌激素受体(estrogen receptor, ER)和孕激素受体(progesterone receptor, PR)均为阴性的乳腺癌。TNBC大约占所有乳腺癌患者的15%~20%,常见于年轻女性,并具有高侵袭、恶性程度高的特点[1]。目前,化疗仍然是治疗TNBC的主要手段。虽然在治疗前期,传统的化疗有效,但TNBC恶性程度高,与其他亚型相比更易复发和死亡,4年内的复发率超过70%[2]。因此,寻找TNBC的治疗手段意义重大。
Long non-coding RNA(LncRNA)是一种长度大于200个核苷酸、不具有编码蛋白质功能的RNA,它们参与着细胞增殖、分化、染色体重塑、表观遗传调控、转录及转录后调控等过程[3]。研究发现LncRNA在乳腺癌、结肠癌、前列腺癌等肿瘤细胞的生长、耐药及上皮间质转化(epithelial-to-mesenchymal transition, EMT)等过程中起着重要作用[4]。LncRNA WT1-AS是Wilm’s肿瘤基因的翻译转录物,编码锌指结构域,同时具有致癌与抑癌作用[5],它的表达量与肝癌患者的生存期呈正相关[6],而与早期宫颈癌患者生存呈负相关[7]。有研究发现WT1-AS在TNBC中表达显著上调[8]。但目前关于WT1-AS在TNBC中的研究仍较少,本文通过检测WT1-AS在TNBC细胞中的表达,探讨WT1-AS对TNBC细胞侵袭、迁移的影响,探讨其在TNBC发生发展的作用机制。
1 材料与方法 1.1 材料人乳腺上皮细胞MCF-10A和人乳腺癌细胞MDA-MB-231、MDA-MB-453、MDA-MB-468购自北京协和细胞资源中心;DMEM/F12和L15培养基购自美国Hyclone公司;马血清购自上海Solarbio公司;胎牛血清购自美国Gibco公司;胰蛋白酶、BCA蛋白浓度测定试剂盒、RIPA裂解液、5×上样缓冲液、RNA提取试剂和反转录试剂、嘌呤霉素及ECL超敏发光液购自上海Solarbio公司;Lipofectamine RNAiMAX和SYBR Select Master Mix试剂盒购自美国ThermoFisher Scientific公司;shRNA-WT1-AS购自上海RealGene公司;引物购自上海英潍捷基公司;E-cadherin鼠单克隆抗体、N-cadherin鼠单克隆抗体、Vimentin鼠单克隆抗体、Snail鼠单克隆抗体、GAPDH鼠单克隆抗体和HRP标记抗鼠抗体购自美国Cell Signaling Technology公司;其余试剂均为国产分析纯试剂,购自中国国药集团化学试剂有限公司。
1.2 方法 1.2.1 细胞培养与慢病毒感染人乳腺上皮细胞MCF-10A使用含5%热灭活马血清、10 µg/ml胰岛素、20 ng/ml EGF、100 ng/ml霍乱毒素和0.5 µg/ml氢化可的松DMEM/F12培养基于37℃、5%CO2培养箱中培养,每隔两天更换培养基。
人乳腺癌细胞MDA-MB-231、MDA-MB-453和MDA-MB-468使用含有10%热灭活胎牛血清(FBS)的L15培养基于37℃,无CO2培养箱中培养,每隔两天更换培养基。
使用10 cm的培养皿培养细胞,当融合至50%~60%后进行转染。使用Lipofectamine RNAiMAX将WT1-AS转染至MDA-MB-231细胞。感染后培养4周,换成含嘌呤霉素(1.5 µg/ml)的培养基继续培养两周,每3天更换含嘌呤霉素的培养基获得慢病毒感染且稳定敲除WS1-AS的MDA-MB-231细胞株。
1.2.2 实时荧光定量PCR(qRT-PCR)参照说明书利用TRIzol提取细胞总RNA,用反转录试剂盒进行反转录得到cDNA。然后利用SYBR Select Master Mix试剂盒在ABI 7900仪器上进行qRT-PCR实验。采用2-ΔΔCt计算基因相对表达量。引物序列:WT1-AS: 5’-GCCTCTCTGTCCTCTTCTTTGT-3’(正义引物),长度22 bp,5’-GCTGTGAGTCCTGGTGCTTAG-3’(反义引物),长度21 bp;GAPDH: 5’-GCTCTCTGCTCCTCCTGTTC-3’(正义引物),长度20 bp,5’-ACGACCAAATCCGTTGACTC3’(反义引物),长度20 bp。
1.2.3 划痕实验将对数生长期的MDA-MB-231细胞接种至6孔板,培养24 h后用200 µl枪头划痕,然后用0.01 mol/L PBS冲洗3次,并更换为含有1%血清的培养基,划痕后0、24 h观察细胞迁移并拍照。迁移率=(宽度0h-宽度24h)/宽度0 h×100%。
1.2.4 Transwell实验将Transwell小室放置24孔板中,小室内膜用Matrigel胶(1:8稀释)80 µl均匀涂抹,37℃孵育30 min使胶凝固。使用无血清培养基稀释肿瘤细胞,将1×105个细胞(100 µl)加入Transwell上室,在下室中加入600 µl含10%FBS的培养基,置于培养箱培养24 h。然后将细胞固定并用结晶紫染色,擦拭去掉内膜的细胞,于镜下拍照并统计细胞数量。
1.2.5 Western blot实验收集各组的心肌细胞,使用含有蛋白酶抑制剂Cocktail的RIPA裂解液冰上裂解细胞提取总蛋白,通过BCA法测定蛋白浓度,并将蛋白液95℃处理5 min变性。取50 μg蛋白样本行8%SDS-PAGE。湿法转印至PVDF膜上,5%脱脂牛奶室温封闭1 h,加入E-cadherin、N-cadherin、Vimentin、Snail和GAPDH抗体4℃过夜。二抗室温孵育1 h,凝胶成像系统采集图像。
1.3 统计学方法采用GraphPad Prism 8软件进行统计分析。数据用(x±s)表示,组间比较采用Student’s t-test检验。P < 0.05为差异有统计学意义。
2 结果 2.1 LncRNA WT1-AS在TNBC细胞MDA-MB-231中的表达qRT-PCR结果显示,TNBC细胞MDA-MB-231、MDA-MB-453、MDA-MB468中LncRNA WT1-AS的表达量显著高于正常乳腺细胞MCF10A(P=0.001、P=0.007、P=0.005),见图 1A。转染后MDA-MB-231细胞LncRNA WT1-AS的表达量显著降低(P=0.001),见图 1B。

|
| 图 1 LncRNA WT1-AS在TNBC细胞中的表达 Figure 1 Expression of LncRNA WT1-AS in triple-negative breast cancer (TNBC) cells |
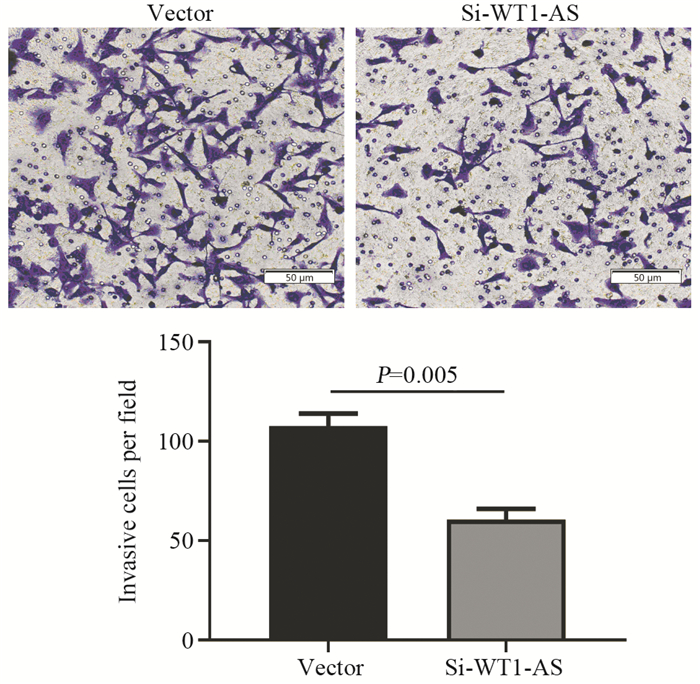
Transwell结果显示,在沉默MDA-MB-231细胞LncRNA WT1-AS表达后,穿膜细胞的数量由107±6下降至61±5,差异有统计学意义(P=0.005),见图 2。表明下调LncRNA WT1-AS可以抑制MDA-MB-231细胞侵袭能力。
|
| 图 2 Transwell实验检测LncRNA WT1-AS对MDA-MB-231细胞侵袭能力的影响(×200) Figure 2 Effect of LncRNA WT1-AS on invasion ability of MDA-MB-231 cells detected by Transwell assay (×200) |
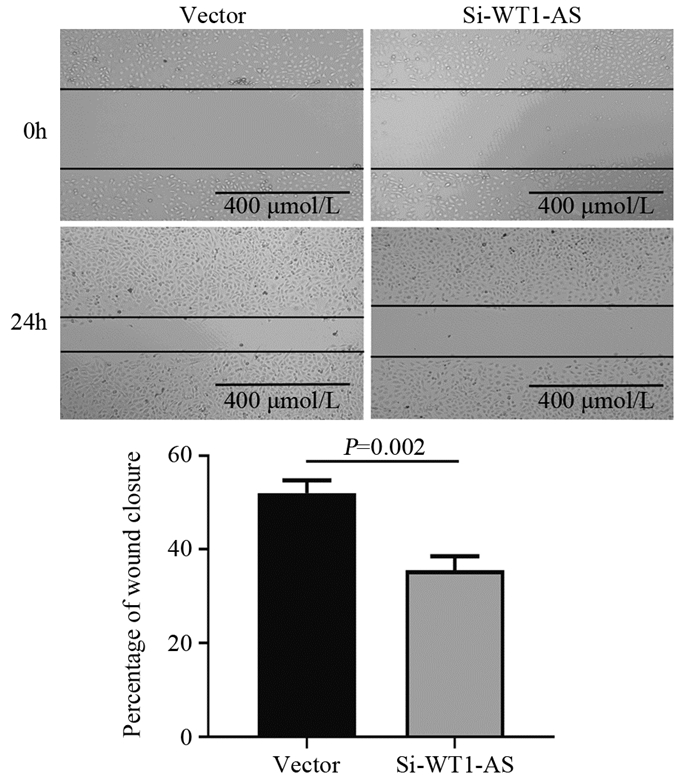
划痕实验结果表明,沉默MDA-MB-231细胞LncRNA WT1-AS表达后,细胞在24 h时的迁移率显著下降(Vector: (52.0±2.7)%, Si-WT1-AS: (35.6±2.9)%; P=0.002),见图 3。表明下调LncRNA WT1-AS可以抑制MDA-MB-231细胞迁移能力。
|
| 图 3 划痕实验检测LncRNA WT1-AS对MDA-MB-231细胞侵袭能力的影响(×100) Figure 3 Effect of LncRNA WT1-AS on invasion ability of MDA-MB-231 cells detected by wound healing assay (×100) |
Western blot结果显示,沉默MDA-MB-231细胞LncRNA WT1-AS表达后,E-cadherin表达量显著上调(P=0.000),N-cadherin、Vimentin和Snail表达量显著下调(P=0.000),见图 4。说明下调LncRNA WT1-AS抑制了MDA-MB-231细胞的EMT能力。

|
| **: P < 0.01. 图 4 Western blot检测LncRNA WT1-AS对MDA-MB-231细胞E-cadherin、N-cadherin、Vimentin和Snail表达的影响 Figure 4 Effect of LncRNA WT1-AS on E-cadherin, N-cadherin, Vimentin and Snail expression in MDA-MB-231 cells detected by Western blot |
TNBC是乳腺癌中预后最差的亚型,其中位生存期很少超过18月[9]。只有30%~45%的TNBC患者可以达到与其他乳腺癌亚型相同的病理完全缓解和生存率[10]。目前,仍然没有有效的靶点治疗TNBC。LncRNA在肿瘤的发生发展中扮演着重要作用。众多LncRNA在肿瘤中发生失调,它们可能是治疗肿瘤的潜在靶点[3]。研究发现,WT1-AS在人胃癌组织中表达下调,过表达后胃癌细胞的增殖、迁移、侵袭受到抑制[11-12]。此外,过表达WT1-AS抑制了宫颈癌细胞的凋亡、迁移、侵袭[12]。目前关于WT1-AS在TNBC中的表达及其发生发展中的作用未见报道。我们检测发现WT1-AS在MDA-MB-231、MDA-MB-453及MDA-MB-468等TNBC细胞中表达升高。沉默WT1-AS后,通过Transwell和划痕实验发现,MDA-MB-231细胞的侵袭和迁移能力受到抑制。这说明WT1-AS具有促进TNBC细胞MDA-MB-231侵袭与迁移的能力。
EMT是一种高度保守的细胞程序,调控极化上皮细胞转化为可运动的间质细胞,在肿瘤发生发展过程中,细胞间的黏附性降低,极性丧失,基质重塑。EMT与肿瘤的发生、恶性进展、肿瘤干细胞、迁移、肿瘤细胞进入血循环、侵袭及药物抵抗相关[12]。E-cadherin、N-cadherin是跨膜黏附糖蛋白,EMT的进程中出现上皮细胞标志物E-cadherin表达降低,间质细胞标志物N-cadherin表达上调,此外,Vimentin和Snail亦是EMT发生的两个标志物[13]。本研究发现,沉默WT1-AS后,E-cadherin表达上调,N-cadherin、Vimentin和Snail表达下调。说明沉默WT1-AS逆转了MDA-MB-231细胞EMT的过程。
综上所述,本研究发现WT1-AS在TNBC细胞的侵袭迁移过程中发挥着重要作用,并发现WT1-AS通过调控EMT促进TNBC细胞的侵袭迁移。这提示了调控WT1-AS也许是治疗TNBC可能的手段之一,但其具体机制仍需要进一步研究。
作者贡献
舒家武:细胞培养、细胞转染、划痕实验、Transwell实验及全部实验数据的分析工作,撰写论文
李熙君:实时定量PCR实验
朱力勤:Western blot实验
王燕燕:实验设计、实验数据审核及指导文章修改
| [1] |
Kwa MJ, Adams S. Checkpoint inhibitors in triple-negative breast cancer (TNBC): Where to go from here[J]. Cancer, 2018, 124(10): 2086-2103. DOI:10.1002/cncr.31272 |
| [2] |
Giudici F, Petracci E, Nanni O, et al. Elevated levels of eEF1A2 protein expression in triple negative breast cancer relate with poor prognosis[J]. PLoS One, 2019, 14(6): e0218030. DOI:10.1371/journal.pone.0218030 |
| [3] |
Quinn JJ, Chang HY. Unique features of long non-coding RNA biogenesis and function[J]. Nat Rev Genet, 2016, 17(1): 47-62. DOI:10.1038/nrg.2015.10 |
| [4] |
Calle AS, Kawamura Y, Yamamoto Y, et al. Emerging roles of long non-coding RNA in cancer[J]. Cancer Sci, 2018, 109(7): 2093-2100. DOI:10.1111/cas.13642 |
| [5] |
Dallosso AR, Hancock AL, Malik S, et al. Alternately spliced WT1 antisense transcripts interact with WT1 sense RNA and show epigenetic and splicing defects in cancer[J]. RNA, 2007, 13(12): 2287-2299. DOI:10.1261/rna.562907 |
| [6] |
Lv L, Chen G, Zhou J, et al. WT1-AS promotes cell apoptosis in hepatocellular carcinoma through down-regulating of WT1[J]. J Exp Clin Cancer Res, 2015, 34: 119. DOI:10.1186/s13046-015-0233-7 |
| [7] |
Cao J, Wang H, Xu P, et al. Loss of long noncoding RNA WT1-AS is associated with better survival in early stage of cervical cancer[J]. Int J Clin Exp Med, 2018, 11(8): 8158-8163. |
| [8] |
Tian T, Gong Z, Wang M, et al. Identification of long non-coding RNA signatures in triple-negative breast cancer[J]. Cancer Cell Int, 2018, 18: 103. DOI:10.1186/s12935-018-0598-8 |
| [9] |
Kast K, Link T, Friedrich K, et al. Impact of breast cancer subtypes and patterns of metastasis on outcome[J]. Breast Cancer Res Treat, 2015, 150(3): 621-629. DOI:10.1007/s10549-015-3341-3 |
| [10] |
Kalimutho M, Parsons K, Mittal D, et al. Targeted Therapies for Triple-Negative Breast Cancer: Combating a Stubborn Disease[J]. Trends Pharmacol Sci, 2015, 36(12): 822-846. DOI:10.1016/j.tips.2015.08.009 |
| [11] |
Du T, Zhang B, Zhang S, et al. Decreased expression of long non-coding RNA WT1-AS promotes cell proliferation and invasion in gastric cancer[J]. Biochim Biophys Acta, 2016, 1862(1): 12-19. DOI:10.1016/j.bbadis.2015.10.001 |
| [12] |
Luo H, Zhang J, He Z, et al. Long Noncoding RNA WT1-AS Inhibits the Progression of Cervical Cancer by Sponging miR-205[J]. Cancer Biother Radiopharm, 2020. Online ahead of print.. |
| [13] |
Pastushenko I, Blanpain C. EMT Transition States during Tumor Progression and Metastasis[J]. Trends Cell Biol, 2019, 29(3): 212-226. DOI:10.1016/j.tcb.2018.12.001 |
 2021, Vol. 48
2021, Vol. 48


