文章信息
- 基于肿瘤相关巨噬细胞为靶点的纳米载药体系在癌症治疗中的研究进展
- Research Progress of Nano-drug Delivery System Targeting Tumor-associated Macrophage in Cancer Treatment
- 肿瘤防治研究, 2021, 48(3): 307-313
- Cancer Research on Prevention and Treatment, 2021, 48(3): 307-313
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0724
- 收稿日期: 2020-06-28
- 修回日期: 2020-08-25
免疫细胞是肿瘤微环境的重要组成部分,在肿瘤免疫治疗中起着关键作用。其中浸润于肿瘤微环境中的巨噬细胞,称为肿瘤相关巨噬细胞(tumour-associated macrophages, TAMs),是微环境中数量最丰富的一类免疫细胞[1]。TAMs参与肿瘤血管生成,基质细胞重塑,维持微酸、低氧、高压等特殊状态调控,在肿瘤发生、生长及转移等过程中扮演重要角色。同时,TAMs通过增强肿瘤细胞的遗传不稳定性、滋养肿瘤干细胞、促进浸润转移等方面影响肿瘤的临床治疗效果[2],是促进肿瘤生长的关键驱动力。此外,肿瘤组织中巨噬细胞的浸润程度与患者预后不良有关,TAMs数量与患者生存时间呈负相关[3]。随着对TAMs与恶性肿瘤复杂关系的深入了解,TAMs已经成为临床癌症诊断和治疗的重要靶点。
TAMs与癌症转移、免疫抑制和肿瘤持续生长密切相关。目前,已有多种策略应用于靶向TAMs的免疫治疗中,例如抑制免疫检查点、RNA干扰(RNAi)的免疫治疗-化疗联合疗法、放射疗法以及基于TAMs的免疫疗法与其他疗法的联合治疗等。常见的靶向TAMs的抗癌药物主要是通过阻断其促肿瘤信号通路来发挥作用,如集落刺激因子-1受体(colony stimulating factor 1 receptor, CSF-1R)靶向药物,PD-1/PD-L1、CD47免疫检查点抑制剂等[4]。虽然该类药物在部分肿瘤(如黑色素瘤等)治疗中获得了突破性进展,降低了恶化和死亡风险,但在实体瘤治疗中,由于肿瘤微环境的组分复杂性以及药物本身存在的响应性差、易耐药等缺陷,严重影响了其治疗效果[5]。因此,如何提高肿瘤免疫治疗效果且降低药物不良反应成为了当前免疫治疗的关键问题。近年来,基于纳米载药体系在肿瘤免疫治疗方面的巨大潜力,纳米药物得到了研究者的高度关注。纳米载药体系具备独特的理化性质,可通过提高载药量、修饰靶向基团、改变药物分布等,实现快速透过生物屏障、有效增强肿瘤免疫原性、促进肿瘤免疫治疗效果并降低免疫毒性[6]。现已有近20种纳米药物获得美国食品药品监督管理局(Food and Drug Administration, FDA)批准用于肿瘤免疫治疗,如白蛋白结合型紫杉醇(albumin-bound paclitaxel),氧化铁磁性纳米颗粒(magnetic iron oxide nanoparticles)等[7]。因此,纳米载药体系用于肿瘤免疫治疗具有广阔的应用前景[8-9]。
1 肿瘤相关巨噬细胞巨噬细胞是先天性免疫的重要组成部分,随着对其功能的深入研究,越来越多的证据表明巨噬细胞在肿瘤发生和转移过程中发挥关键作用。根据表型和功能的不同,活化的巨噬细胞可分为M1型和M2型,其极化方向受所处微环境的调控,如组织微环境、外部因素和炎性反应因子等均可对巨噬细胞进行不同形式的激活[10]。促进肿瘤生长的巨噬细胞为M2表型,在正常组织中具有修复损伤与抑制炎性反应的功能。抑制肿瘤生长的巨噬细胞为M1表型,能够诱导炎性反应,激活免疫应答杀伤肿瘤细胞[11]。在肿瘤发生过程中,TAMs往往能够刺激血管生成,促进肿瘤细胞的迁移、侵袭,介导肿瘤免疫逃逸。在肿瘤转移部位中,TAMs促进肿瘤细胞外渗、存活和后续活动。此外,肿瘤组织中TAMs的浸润程度往往与患者的预后不良相关。因此,针对TAMs的肿瘤免疫疗法引起了人们的广泛关注[4, 12]。
2 肿瘤相关巨噬细胞的促肿瘤机制 2.1 低氧微环境诱导M2型TAMs由于肿瘤组织的急速增殖和扩张,肿瘤微环境处于缺氧状态。巨噬细胞被招募至肿瘤区域后,低氧微环境通过激活多种胞内信号途径,如低氧诱导因子(hypoxia inducible factor, HIF)途径、血管内皮生长因子(vascular endothelial growth factor, VEGF)途径和核转录因子(NF-κB)途径等,使VEGF与嗜酸性粒细胞趋化因子(Eotaxin)等细胞因子在肿瘤组织中富集,诱导巨噬细胞极化为M2型。M2型TAMs进一步产生趋化因子CCL2(C-C motif chemokine 2)、CCL5(C-C motif chemokine 5)或巨噬细胞集落刺激因子-1(macrophage colony stimulating factor-1, CSF-1)等因子参与免疫抑制,为血管生成、肿瘤的转移扩散等提供了重要基础[13-14]。
2.2 TAMs参与血管生成为适应肿瘤微环境中营养和氧气供应的减少,维持肿瘤细胞高增殖率所需的能量和结构改变,TAMs经历了一系列变化,刺激血管生成,促进肿瘤生长[15]。肿瘤组织缺氧致使血管生成因子和抗血管生成因子失衡,肿瘤组织血管生成紊乱。因此,与正常血管相比,肿瘤血管往往具有异常、不成熟和易渗漏等特性[16]。
肿瘤血管生成是一个由肿瘤细胞和基质细胞共同协调的过程,需要基底膜的降解以及内皮细胞的增殖和迁移。通过协调二者之间的相互作用,TAMs参与了血管生成这一过程。首先,TAMs分泌基质金属蛋白酶(matrix metalloproteinases, MMPs)和组织蛋白酶(cathepsins)降解基底膜;其次,分泌促血管生成因子,如VEGF、血小板衍生生长因子(platelet derived growth factor, PDGF),碱性成纤维细胞生长因子(basic fibroblast growth factor, b-FGF)和趋化因子CCL2、CXCL8,提供维持肿瘤细胞生长与扩散所需的血管网络;最后,VEGF-A和CCL2等因子可招募单核细胞,它们的表达量与TAMs积聚程度及某些肿瘤的血管发达程度呈正相关[15, 17]。此外,一种表达酪氨酸激酶受体Tie-2的单核细胞亚群(Tie2-expressing monocytes, TEMs)近年来逐渐受到人们关注,Biel等发现其可诱导血管生成[18]。血管生成素1(angiopoietin-1, Ang-1)为Tie-2的配体,血管内皮细胞表达Ang-1致使TEMs沿着血管表面排列,TEMs合成Wnt-7b蛋白靶向血管内皮细胞,最终刺激内皮细胞产生VEGF,诱导血管生成[19-21]。综上所述,TAMs与肿瘤衍生的血管生成因子协同促进新生血管的形成,是肿瘤血管生成与细胞增殖的重要前提。
2.3 TAMs调控肿瘤转移肿瘤侵袭转移是导致癌症患者死亡的主要原因。大量证据表明,TAMs的募集与肿瘤细胞侵袭扩散之间存在联系。TAMs通过参与转移前生态位的形成,促进转移部位的扩散。此外,在转移部位中,TAMs通过介导免疫逃逸,促进了肿瘤细胞的外渗和存活[22]。
上皮间质表型转换(epithelial-mesenchymal transition, EMT)是原发性肿瘤进行侵袭转移的起始步骤,肿瘤上皮细胞在EMT过程中获得浸润和迁移能力,通过血液循环、淋巴管灌注及远处迁移等途径得以生存扩散,TAMs参与调控这一过程[23]。有研究表明,TAMs分泌的转化生长因子-β(transforming growth factor-β, TGF-β)可诱发肿瘤细胞EMT过程,如畸胎瘤中,TAMs募集导致TGF-β表达升高,引发了肿瘤细胞EMT过程,致使肿瘤发生转移[24]。TAMs还可分泌酸性分泌蛋白,如蛋白水解酶、MMPs和丝氨酸蛋白酶等,在这些酶类的协同作用下,基底膜和胞外基质被降解,使得肿瘤细胞从原发部位向远端转移。此外,肿瘤细胞分泌的CSF-1与巨噬细胞介导的表皮生长因子(epidermal growth factor, EGF)信号通路能诱导二者在血管周围聚集,引发肿瘤细胞的免疫逃逸[17]。由此可见,TAMs的累积使得肿瘤细胞的浸润转移能力增强,以TAMs为靶点解决肿瘤转移问题对肿瘤免疫治疗具有重要意义。
3 纳米药物靶向TAMs的治疗策略 3.1 诱导TAMs重极化肿瘤微环境中的巨噬细胞多数为M2表型,且肿瘤组织内部及附近的M2型巨噬细胞数量与患者的预后不良相关[25]。因此,将M2型TAMs重极化为M1型有利于巨噬细胞发挥肿瘤杀伤作用,防止肿瘤转移,改善肿瘤微环境的免疫抑制状态。
氧化铁纳米颗粒(Ferumoxytol)是一种超小型顺磁性(USPIO)纳米颗粒,已被FDA批准进入临床使用[26]。Zanganeh等研究发现,氧化铁纳米颗粒可促进巨噬细胞向M1型转化,同时可促进Th1型T细胞相关基因的表达。动物实验研究表明,氧化铁纳米颗粒可将肿瘤组织中的TAMs由M2型转变为M1型,进而能显著抑制小鼠皮下腺癌的生长[27-28]。此外,Yu等也发现氧化铁纳米颗粒能够诱导M2型TAMs重极化,刺激活性氧产生,进而发挥M1型巨噬细胞的杀伤作用[29]。人参根提取物如人参皂苷、酚类和酸性多糖等已被认为具有多种药理特性,包括抗衰老、抗氧化及增强免疫抗癌等作用。近日研究发现,利用纳米载药体系携载人参根提取物有望成为肿瘤免疫治疗的新型纳米药物[30]。人参衍生纳米颗粒(ginseng-derived nanoparticles, GDNPs)重新编程巨噬细胞极化见图 1。Cao等[31]用超速离心法制备的GNDPs,在体内外水平上均可靶向TAMs,通过TLR4和MyD88信号通路诱导M2型TAMs极化为M1型,增加肿瘤组织中M1型巨噬细胞的数量,抑制小鼠黑色素瘤的生长。Wu等证明了羧基化多壁碳纳米管(MWCNTs-COOH)可通过TLR-4/NF-κB p65信号通路,诱导M2型TAMs极化为M1型,阻止肺癌中促癌因子的产生,结果发现明显地减缓了肺癌的侵袭和迁移行为并抑制了肿瘤的生长[32-33]。乳腺癌4T-1细胞具有高度侵袭性,可转移至肺、肝及大脑等部位,恶性程度极强,临床治疗困难。Pei等[34]开发了用于共输送疏水化疗药物紫杉醇(PTX)和生物大分子IL-12的纳米颗粒。纳米颗粒进入肿瘤部位后,显著抑制了乳腺癌4T-1细胞的生长和转移,延长了小鼠的生存时间。PTX和IL-12联合应用可激活T淋巴细胞和NK细胞释放IFN-γ,选择性抑制调节性T细胞,诱导肿瘤相关巨噬细胞M1型分化,从而改善肿瘤免疫抑制微环境。胶质母细胞瘤(glioblastoma, GBM)是一种死亡率很高的恶性脑肿瘤,其显著特征就是基底膜存在大量巨噬细胞。Li等[35]利用含阿霉素(DOX)的纳米金刚石药物复合物(Nano-DOX)调节基底膜微环境,结果表明Nano-DOX处理的基底膜细胞能够将TAMs从促GBM表型重新极化为抗GBM表型,从而抑制肿瘤生长。因此,利用巨噬细胞的极化能力转变TAMs表型,根据巨噬细胞的功能差异调节肿瘤免疫微环境,是纳米药物靶向TAMs发挥肿瘤免疫治疗的有效途径。
肿瘤相关巨噬细胞的募集和浸润是实体瘤的显著特征,在肿瘤的发展和转移中起着重要作用。此外,巨噬细胞具有吞噬功能,便于携带纳米药物进入肿瘤组织。因此,许多研究人员利用肿瘤组织募集TAMs这一过程,将药物加载于巨噬细胞中,促进药物在肿瘤部位的递送与滞留,增强药物的肿瘤杀伤作用。
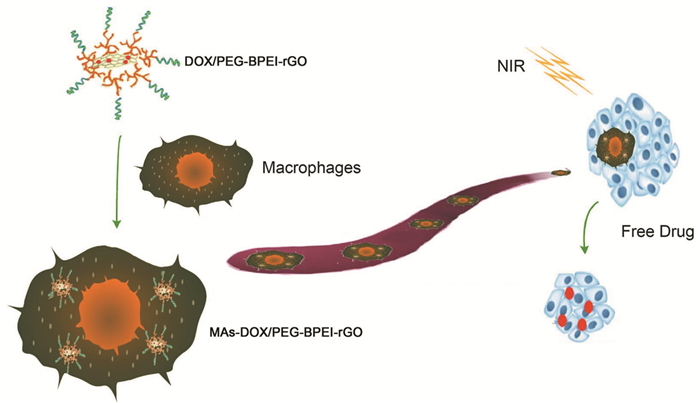
M1型巨噬细胞具有植入肿瘤组织的能力,能通过吞噬作用摄取足够的纳米药物进行肿瘤治疗,不少研究人员利用原代M1型巨噬细胞将纳米药物送入胶质瘤中。Pang等[36]将含有DOX的聚丙交酯-乙交酯共聚物纳米颗粒(DOX@NPs)与M1型巨噬细胞共孵育,制备了M1型巨噬细胞负载的DOX@NPs系统(DOX@M1-NPs)。体外细胞实验结果显示,M1型巨噬细胞负载颗粒后仍保持良好的趋瘤能力,并能有效携带颗粒进入肿瘤组织。体内结果表明,DOX@M1-NPs相较于游离纳米药物在肿瘤部位分布范围更广。该纳米系统中,M1型巨噬细胞能与肿瘤细胞产生良好的细胞相互作用,促进NPs向肿瘤组织的渗透,诱导肿瘤细胞凋亡,延长患者的中位生存期。为了进一步提高纳米药物的生物相容性和肿瘤治疗效果,各种纳米药物/巨噬细胞联合光热治疗、光声治疗等模式不断涌现。巨噬细胞递送纳米药物用于肿瘤的光热治疗见图 2。Qiang等[37]将负载DOX的还原氧化石墨烯(rGO)加载到小鼠巨噬细胞系(RAW264.7)中,结果发现RAW264.7细胞在体内外对小鼠前列腺癌细胞(RM-1)的趋瘤能力均无明显变化,巨噬细胞内的PEG-BPEI-rGO具有良好的光热转换性能,促使DOX快速释放,提高了杀瘤效果。Chiu等[38]利用巨噬细胞递送载有DOX的金纳米棒-白蛋白核壳纳米颗粒(NR@DOX: SA)用于肿瘤的光热治疗。负载纳米药物的巨噬细胞利用肿瘤募集作用将纳米药物运送到肿瘤组织,从而实现了高效的药物特异性递送与可控释放。与游离纳米药物相比,巨噬细胞递送有效地提高了药物分布的均匀性和肿瘤滞留能力,改善了肿瘤光热治疗的效果。此外,巨噬细胞携带纳米药物还具有跨越生理屏障的优势,在胶质母细胞瘤中,向肿瘤细胞输送治疗药物的一个主要障碍是血脑屏障。Pall等[39]利用巨噬细胞运送金纳米颗粒穿过该屏障,加速了GBM细胞的死亡,增强了肿瘤治疗效果。
尽管我国在癌症治疗领域取得了重大进展,但仍有众多患者在确诊时已处于中晚期,且伴有转移率高、侵袭性强、死亡率高等临床特点。因此,开发新的诊断方式对提高临床治疗效果十分重要。目前,纳米颗粒已广泛应用于肿瘤成像当中,在磁共振成像(MRI)、正电子发射断层扫描(PET)等诊断方法中均发挥了重要作用[40]。由于巨噬细胞在肿瘤微环境中的高水平浸润及其在肿瘤发展进程中的重要作用,且TAMs免疫反应可影响抗癌纳米药物的体内递送效果,越来越多的研究人员开始利用纳米成像技术精准靶向TAMs、追踪TAMs动态变化[41]。
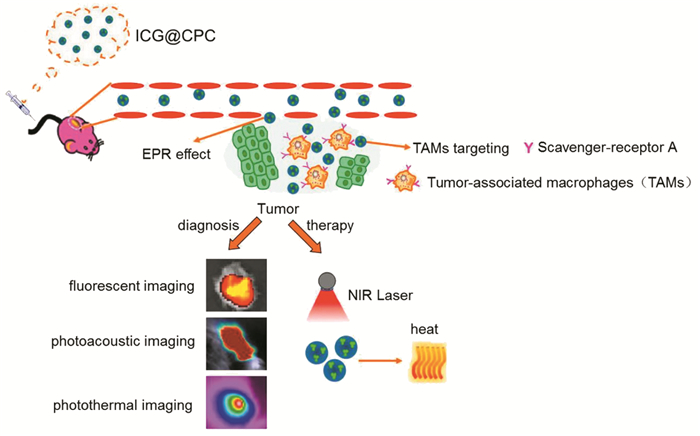
TAMs的群体数量可以影响癌症治疗效果,特别是在纳米药物的肿瘤免疫治疗方面。临床前与临床数据均表明,TAMs密度的定量测量有助于了解肿瘤免疫环境和预测治疗效果,但量化TAMs数量及分析其体内分布十分困难。许多纳米药物虽被用于TAMs的成像当中,但大多数存在靶向性不足或难以渗透肿瘤深部的问题。Kim等[42]开发了一种铜标记的多聚葡萄糖纳米颗粒(Macrin),该纳米颗粒可用于TAMs的正电子发射断层扫描定量成像。其中,交联葡聚糖及其衍生物组成的聚葡萄糖纳米药物对巨噬细胞具有显著的亲和力,能够解决药物靶向性差的问题。故Macrin具有良好的生物降解性和安全性,并且能最大限度地积聚在TAMs中,因此,Macrin成像能够更为精准地量化TAMs,并为治疗决策提供基础数据。吲哚菁绿(ICG)是一种临床批准的近红外荧光成像剂,同时也是一种良好的光热剂。然而,由于ICG存在水溶条件与光照条件下稳定性差、体内滞留时间短、缺乏肿瘤特异性等缺点,使其在肿瘤诊疗应用中受到影响。Wan等[43]利用藻蓝蛋白(CPC)负载ICG,构建了CPC-ICG的非共价偶联物(ICG@CPC)。CPC不仅具有生物安全性好、水溶性强、发光强等优点,而且可通过清道夫受体A(SR-A)介导的内吞作用与TAMs特异性结合,靶向肿瘤部位。与游离ICG相比,ICG@CPC具有更高的光稳定性和暗稳定性、特异的肿瘤靶向性,同时将光热转换效率提高了3倍,见图 3[43-44]。这些结果表明,ICG@CPC作为用于肿瘤精确诊断和治疗的纳米光敏剂具有广阔的应用前景。
|
| Afterbeing injected through the tail vein, ICG@CPC nanomedicine was enriched in tumor tissues and targeted TAMs through EPR effect, ligand-receptor binding mode, then achieved multimode imaging (fluorescence, photoacoustic, photothermal) and diagnosis, treatment. 图 3 ICG@CPC靶向TAMs的多模成像及光热效应示意图[43] Figure 3 Schematic illustration of TAMs-targeted multimodal imaging and photothermal effect of ICG@CPC[43] |
肿瘤微环境中TAMs的评估对胶质母细胞瘤的诊断及患者的预后判断十分重要。Karimian-Jazi等[45]以一种双峰荧光标记的氧化铁纳米颗粒,通过MRI和多光子显微镜(MR-MPM)将小鼠胶质母细胞瘤微环境中天然免疫细胞的动力学可视化,分析了巨噬细胞摄取纳米药物的过程。该方法实现了在同一动物中通过MRI和MR-MPM追踪免疫细胞,为研究肿瘤微环境中的免疫细胞动态、干预肿瘤的免疫治疗提供了支持。纳米二氧化硅(SNPs)具有良好的生物相容性和生物降解性,但由于SNPs缺乏荧光光谱,因此,在作为可降解成像剂的应用方面受到限制。Yoo等[46]利用正硅酸乙酯和3-氨基丙基三甲氧基硅烷通过人工产生光学活性缺陷中心来水热合成荧光SNPs,使二氧化硅成功地用作癌细胞与TAMs的荧光探针,为肿瘤的诊断提供了新策略。综上可知,使用纳米药物靶向TAMs的肿瘤成像技术有助于了解肿瘤免疫环境和预测治疗结果,为肿瘤的诊断和治疗开辟了新途径。
3.4 阻止TAMs肿瘤内募集肿瘤相关巨噬细胞的浸润与肿瘤的发展密切相关。但目前TAMs募集的机制尚不明确[47]。Fernández等[48]以氧化铈纳米颗粒(CeO2 NPs)处理肝癌模型小鼠,研究了CeO2 NPs对肿瘤进展和动物存活的影响。结果发现,氧化铈纳米颗粒积聚于肝脏,通过减少巨噬细胞浸润和抑制炎性反应相关基因的表达,抑制了肿瘤细胞生长并提高了肝癌模型小鼠的生存率,证明了巨噬细胞数量与小鼠生存率成负相关。
此外,趋化因子CSF-1、VEGF参与了巨噬细胞募集,其中趋化因子CCL2是将这些免疫细胞募集到肿瘤和其他组织中的关键介质[49]。通过干扰关键信号通路(如CCL2-CCR2)阻断单核细胞向肿瘤组织的募集是改善肿瘤微环境与治疗肿瘤的有效途径。Shen等[50]制备了siRNA包被的纳米粒子(CNP/siCCR2),发现CNP/siCCR2能够更有效地抑制单核细胞CCR2的表达。更重要的是,通过阻断单核细胞向肿瘤组织的募集,CNP/siCCR2可以改变肿瘤免疫微环境,抑制原发性肿瘤的生长,减少肿瘤转移,显示出了有效的抗肿瘤作用。
4 结语与展望尽管肿瘤微环境中存在多种免疫细胞,但TAMs的独特功能使其成为了近年来肿瘤免疫治疗的研究热点。TAMs在肿瘤生长中具有双重性功能,主要分为促瘤的M2型和抑瘤的M1型两种亚型,M2型主要参与肿瘤血管生成、调控肿瘤转移,促进肿瘤的发生和进展,同时M2型可以被诱导重极化为M1型。因此,靶向TAMs的治疗策略有望成为肿瘤免疫治疗的重要手段。面对复杂的肿瘤免疫微环境,纳米载药体系在肿瘤免疫治疗领域中展示出了巨大的研究优势。众多纳米载药体系可根据需要改变尺寸大小或修饰靶向基团获得不同的理化性质,进而更加快速地渗透屏障并精准靶向TAMs,发挥更高效的抗癌效果。此外,纳米载药体系还可解决双药或多药共输送的问题,有助于加强药物间的协同治疗作用。
目前,纳米载药体系靶向TAMs治疗虽在动物水平上取得了较好的效果,但由于巨噬细胞表型及功能的多样性,使得不同表型的巨噬细胞对药物所产生的免疫应答存在差异性,容易导致抗癌效果的不稳定性。另外,部分无机纳米颗粒在应用中仍存在生物不相容性和安全性等问题,而以生物来源的纳米颗粒作为载药体系有望解决如上问题。因此,实现纳米药物的精准靶向性与改善生物相容性将为今后纳米载药体系的开发提供更为高效、安全的策略。同时,还需对肿瘤相关巨噬细胞的极化机制进行更深入的研究,以开发出更稳定、安全、高效的肿瘤免疫诊疗新模式。
作者贡献
王晨晨:查阅文献,确定思路并撰写论文
杜朝、郭学玲、张曦月:协助梳理文章内容
王英泽:确定选题和论文框架,审阅及指导论文写作
| [1] |
Miao L, Qi J, Zhao Q, et al. Targeting the STING pathway in tumor-associated macrophages regulates innate immune sensing of gastric cancer cells[J]. Theranostics, 2020, 10(2): 498-515. DOI:10.7150/thno.37745 |
| [2] |
Mantovani A, Marchesi F, Malesci A, et al. Tumour-associated macrophages as treatment targets in oncology[J]. Nat Rev Clin Oncol, 2017, 14(7): 399-416. DOI:10.1038/nrclinonc.2016.217 |
| [3] |
Qiu SQ, Waaijer SJH, Zwager MC, et al. Tumor-associated macrophages in breast cancer: Innocent bystander or important player[J]. Cancer Treat Rev, 2018, 70: 178-189. DOI:10.1016/j.ctrv.2018.08.010 |
| [4] |
Ngambenjawong C, Gustafson HH, Pun SH. Progress in tumor-associated macrophage (TAM)-targeted therapeutics[J]. Adv Drug Deliv Rev, 2017, 114: 206-221. DOI:10.1016/j.addr.2017.04.010 |
| [5] |
Bertrand A, Kostine M, Barnetche T, et al. Immune related adverse events associated with anti-CTLA-4 antibodies: systematic review and meta-analysis[J]. BMC Med, 2015, 13: 211. DOI:10.1186/s12916-015-0455-8 |
| [6] |
Liu Y, Xu Y, Zhang Z, et al. A simple, yet multifunctional, nanoformulation for eradicating tumors and preventing recurrence with safely low administration dose[J]. Nano Lett, 2019, 19(8): 5515-5523. DOI:10.1021/acs.nanolett.9b02053 |
| [7] |
Bhardwaj V, Kaushik A, Khatib ZM, et al. Recalcitrant Issues and New Frontiers in Nano-Pharmacology[J]. Front Pharmacol, 2019, 10: 1369. DOI:10.3389/fphar.2019.01369 |
| [8] |
Sun Q, Zhou Z, Qiu N, et al. Rational Design of Cancer Nanomedicine: Nanoproperty Integration and Synchronization[J]. Adv Mater, 2017, 29(14). |
| [9] |
Kim BY, Rutka JT, Chan WC. Nanomedicine[J]. N Engl J Med, 2010, 363(25): 2434-2443. DOI:10.1056/NEJMra0912273 |
| [10] |
Murray PJ. Macrophage Polarization[J]. Annu Rev Physiol, 2017, 79: 541-566. DOI:10.1146/annurev-physiol-022516-034339 |
| [11] |
Imam S, Dar P, Paparodis R, et al. Nature of coexisting thyroid autoimmune disease determines success or failure of tumor immunity in thyroid cancer[J]. J Immunother Cancer, 2019, 7(1): 3. DOI:10.1186/s40425-018-0483-y |
| [12] |
Cassetta L, Pollard JW. Targeting macrophages: therapeutic approaches in cancer[J]. Nat Rev Drug Discov, 2018, 17(12): 887-904. DOI:10.1038/nrd.2018.169 |
| [13] |
Mitrofanova I, Zavyalova M, Riabov V, et al. The effect of neoadjuvant chemotherapy on the correlation of tumor-associated macrophages with CD31 and LYVE-1[J]. Immunobiology, 2018, 223(6-7): 449-459. DOI:10.1016/j.imbio.2017.10.050 |
| [14] |
Henze AT, Mazzone M. The impact of hypoxia on tumor-associated macrophages[J]. J Clin Invest, 2016, 126(10): 3672-3679. DOI:10.1172/JCI84427 |
| [15] |
Prenen H, Mazzone M. Tumor-associated macrophages: a short compendium[J]. Cell Mol Life Sci, 2019, 76(8): 1447-1458. DOI:10.1007/s00018-018-2997-3 |
| [16] |
Netea-Maier RT, Smit JWA, Netea MG. Metabolic changes in tumor cells and tumor-associated macrophages: A mutual relationship[J]. Cancer Lett, 2018, 413: 102-109. DOI:10.1016/j.canlet.2017.10.037 |
| [17] |
Petty A J, Yang Y. Tumor-associated macrophages: implications in cancer immunotherapy[J]. Immunotherapy, 2017, 9(3): 289-302. DOI:10.2217/imt-2016-0135 |
| [18] |
Biel NM, Siemann DW. Targeting the Angiopoietin-2/Tie-2 axis in conjunction with VEGF signal interference[J]. Cancer Lett, 2016, 380(2): 525-533. DOI:10.1016/j.canlet.2014.09.035 |
| [19] |
Turrini R, Pabois A, Xenarios I, et al. TIE-2 expressing monocytes in human cancers[J]. Oncoimmunology, 2017, 6(4): e1303585. DOI:10.1080/2162402X.2017.1303585 |
| [20] |
Eklund L, Kangas J, Saharinen P. Angiopoietin–Tie signalling in the cardiovascular and lymphatic systems[J]. Clin Sci(Lond), 2017, 131(1): 87-103. DOI:10.1042/CS20160129 |
| [21] |
Sidibe A, Ropraz P, Jemelin S, et al. Angiogenic factor-driven inflammation promotes extravasation of human proangiogenic monocytes to tumours[J]. Nat Commun, 2018, 9(1): 355. DOI:10.1038/s41467-017-02610-0 |
| [22] |
Weichand B, Popp R, Dziumbla S, et al. S1PR1 on tumor-associated macrophages promotes lymphangiogenesis and metastasis via NLRP3/IL-1β[J]. J Exp Med, 2017, 214(9): 2695-2713. DOI:10.1084/jem.20160392 |
| [23] |
Li L, Lu Y. Inhibition of Hypoxia-Induced Cell Motility by p16 in MDA-MB-231 Breast Cancer Cells[J]. J Cancer, 2010, 1: 126-135. |
| [24] |
Quail DF, Joyce JA. Microenvironmental regulation of tumor progression and metastasis[J]. Nat Med, 2013, 19(11): 1423-1437. DOI:10.1038/nm.3394 |
| [25] |
Li R, Serrano JC, Xing H, et al. Interstitial flow promotes macrophage polarization toward an M2 phenotype[J]. Mol Biol Cell, 2018, 29(16): 1927-1940. DOI:10.1091/mbc.E18-03-0164 |
| [26] |
Baroni S, Ruggiero MR, Bitonto V, et al. In vivo assessment of tumour associated macrophages in murine melanoma obtained by low-field relaxometry in the presence of iron oxide particles[J]. Biomaterials, 2020, 236: 119805. DOI:10.1016/j.biomaterials.2020.119805 |
| [27] |
Zanganeh S, Hutter G, Spitler R, et al. Iron oxide nanoparticles inhibit tumour growth by inducing pro-inflammatory macrophage polarization in tumour tissues[J]. Nat Nanotechnol, 2016, 11(11): 986-994. DOI:10.1038/nnano.2016.168 |
| [28] |
Zhao Y, Zhao X, Cheng Y, et al. Iron Oxide Nanoparticles-Based Vaccine Delivery for Cancer Treatment[J]. Mol Pharm, 2018, 15(5): 1791-1799. DOI:10.1021/acs.molpharmaceut.7b01103 |
| [29] |
Yu B, Wang Z, Almutairi L, et al. Harnessing iron-oxide nanoparticles towards the improved bactericidal activity of macrophage against Staphylococcus aureus[J]. Nanomedicine, 2020, 24: 102158. DOI:10.1016/j.nano.2020.102158 |
| [30] |
Mathiyalagan R, Yang DC. Ginseng nanoparticles: a budding tool for cancer treatment[J]. Nanomedicine(Lond), 2017, 12(10): 1091-1094. |
| [31] |
Cao M, Yan H, Han X, et al. Ginseng-derived nanoparticles alter macrophage polarization to inhibit melanoma growth[J]. J Immunother Cancer, 2019, 7(1): 326. DOI:10.1186/s40425-019-0817-4 |
| [32] |
Wu L, Tang H, Zheng H, et al. Multiwalled Carbon Nanotubes Prevent Tumor Metastasis Through Switching M2-Polarized Macrophages to M1 via TLR4 Activation[J]. J Biomed Nanotechnol, 2019, 15(1): 138-150. DOI:10.1166/jbn.2019.2661 |
| [33] |
González-Lavado E, Iturrioz-Rodríguez N, Padín-González E, et al. Biodegradable multi-walled carbon nanotubes trigger anti-tumoral effects[J]. Nanoscale, 2018, 10(23): 11013-11020. DOI:10.1039/C8NR03036G |
| [34] |
Pei X, Zhu Z, Gan Z, et al. PEGylated nano-graphene oxide as a nanocarrier for delivering mixed anticancer drugs to improve anticancer activity[J]. Sci Rep, 2020, 10(1): 2717. DOI:10.1038/s41598-020-59624-w |
| [35] |
Li TF, Li K, Wang C, et al. Harnessing the cross-talk between tumor cells and tumor-associated macrophages with a nano-drug for modulation of glioblastoma immune microenvironment[J]. J Control Release, 2017, 268: 128-146. DOI:10.1016/j.jconrel.2017.10.024 |
| [36] |
Pang L, Zhu Y, Qin J, et al. Primary M1 macrophages as multifunctional carrier combined with PLGA nanoparticle delivering anticancer drug for efficient glioma therapy[J]. Drug Deliv, 2018, 25(1): 1922-1931. DOI:10.1080/10717544.2018.1502839 |
| [37] |
Qiang L, Cai Z, Jiang W, et al. A novel macrophage-mediated biomimetic delivery system with NIR-triggered release for prostate cancer therapy[J]. J Nanobiotechnology, 2019, 17(1): 83. DOI:10.1186/s12951-019-0513-z |
| [38] |
Chiu HT, Su CK, Sun YC, et al. Albumin-Gold Nanorod Nanoplatform for Cell-Mediated Tumoritropic Delivery with Homogenous ChemoDrug Distribution and Enhanced Retention Ability[J]. Theranostics, 2017, 7(12): 3034-3052. DOI:10.7150/thno.19279 |
| [39] |
Pall AE, Juratli L, Guntur D, et al. A gain of function paradox: Targeted therapy for glioblastoma associated with abnormal NHE9 expression[J]. J Cell Mol Med, 2019, 23(11): 7859-7872. DOI:10.1111/jcmm.14665 |
| [40] |
Loc WS, Linton SS, Wilczynski ZR, et al. Effective encapsulation and biological activity of phosphorylated chemotherapeutics in calcium phosphosilicate nanoparticles for the treatment of pancreatic cancer[J]. Nanomedicine, 2017, 13(7): 2313-2324. DOI:10.1016/j.nano.2017.06.017 |
| [41] |
Omlor AJ, Nguyen J, Bals R, et al. Nanotechnology in respiratory medicine[J]. Respir Res, 2015, 16(1): 64. DOI:10.1186/s12931-015-0223-5 |
| [42] |
Kim HY, Li R, Ng TSC, et al. Quantitative Imaging of Tumor-Associated Macrophages and Their Response to Therapy Using 64Cu-Labeled Macrin[J]. ACS Nano, 2018, 12(12): 12015-12029. DOI:10.1021/acsnano.8b04338 |
| [43] |
Wan DH, Ma XY, Lin C, et al. Noncovalent Indocyanine Green Conjugate of C-Phycocyanin: Preparation and Tumor-Associated Macrophages-Targeted Photothermal Therapeutics[J]. Bioconjug Chem, 2020, 31(5): 1438-1448. DOI:10.1021/acs.bioconjchem.0c00139 |
| [44] |
Yan F, Wu H, Liu H, et al. Molecular imaging-guided photothermal/photodynamic therapy against tumor by iRGD-modified indocyanine green nanoparticles[J]. J Control Release, 2016, 224: 217-228. DOI:10.1016/j.jconrel.2015.12.050 |
| [45] |
Karimian-Jazi K, Münch P, Alexander A, et al. Monitoring innate immune cell dynamics in the glioma microenvironment by magnetic resonance imaging and multiphoton microscopy (MR-MPM)[J]. Theranostics, 2020, 10(4): 1873-1883. DOI:10.7150/thno.38659 |
| [46] |
Yoo J, Han S, Park W, et al. Defect-Induced Fluorescence of Silica Nanoparticles for Bioimaging Applications[J]. ACS Appl Mater Interfaces, 2018, 10(51): 44247-44256. DOI:10.1021/acsami.8b16163 |
| [47] |
Tang M, Liu B, Bu X, et al. Cross-talk between ovarian cancer cells and macrophages through periostin promotes macrophage recruitment[J]. Cancer Sci, 2018, 109(5): 1309-1318. DOI:10.1111/cas.13567 |
| [48] |
Fernández-Varo G, Perramón M, Carvajal S, et al. Bespoken nanoceria: A new effective treatment in experimental hepatocellular carcinoma[J]. Hepatology, 2020, 72(4): 1267-1282. DOI:10.1002/hep.31139 |
| [49] |
Song G, Tarrant TK, White TF, et al. Roles of chemokines CCL2 and CCL5 in the pharmacokinetics of PEGylated liposomal doxorubicin in vivo and in patients with recurrent epithelial ovarian cancer[J]. Nanomedicine, 2015, 11(7): 1797-1807. DOI:10.1016/j.nano.2015.05.007 |
| [50] |
Shen S, Zhang Y, Chen K, et al. Cationic Polymeric Nanoparticle Delivering CCR2 siRNA to Inflammatory Monocytes for Tumor Microenvironment Modification and Cancer Therapy[J]. Mol Pharm, 2018, 15(9): 3642-3653. DOI:10.1021/acs.molpharmaceut.7b00997 |
 2021, Vol. 48
2021, Vol. 48