文章信息
- 新型单细胞分析技术——质谱流式细胞术在白血病治疗中的应用
- Application of New Single-cell Analysis Technology——Cytometry by Time-of-flight in Treatment of Leukemia
- 肿瘤防治研究, 2021, 48(2): 209-213
- Cancer Research on Prevention and Treatment, 2021, 48(2): 209-213
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0662
- 收稿日期: 2020-06-13
- 修回日期: 2020-11-05
2. 213000 常州,南京医科大学附属常州第二人民医院妇产科;
3. 730000 兰州,兰州大学第一医院血液科
2. Obstetrics and Gynecology Department, Changzhou No.2 People's Hospital, The Affiliated Hospital of Nanjing Medical University, Changzhou 213000, China;
3. Department of Hematology, The First Affiliated Hospital of Lanzhou University, Lanzhou 730000, China
白血病是造血干细胞在不同分化阶段由于分化障碍、凋亡受阻及克隆增生引起的血液系统恶性肿瘤,目前白血病的治疗方法有化疗、放射治疗、免疫治疗、靶向治疗、干细胞移植等。白血病治疗期望实现个体化,质谱流式细胞术(cytometng by time-of-flight, CyTOF)将流式细胞分析方法与质谱检测方法相结合,可同时测量单细胞中几十种甚至上百种特征标志物,既有荧光流式细胞术高速分析的特点,又有质谱检测的高精确度与高识别能力[1-2],可实现在单细胞水平分析异质白血病细胞的免疫表型及复杂的信号通路变化[3],研究高度异质性白血病细胞群的生物学[4-5],分析血液肿瘤与免疫系统的相互作用[6-7],有助于深入了解白血病发生、发展及耐药机制,发现更多白血病潜在治疗靶点[8-9],为白血病治疗提供新的启示,并监测白血病患者靶向治疗和细胞毒性治疗反应[10]。CyTOF作为一种新技术,有助于指导白血病个体化治疗,体现了精准医学的新发展。
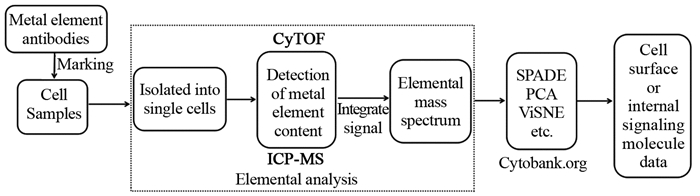
1 CyTOF工作原理CyTOF是一种新的高维多参数单细胞分析技术,其测量参数多、单细胞识别准确率高,克服了传统荧光流式细胞术光谱重叠的局限性[11-13]。CyTOF基本原理是用金属标签抗体标记的细胞进入质谱流式细胞仪后,用流式细胞技术分离成单个细胞,并逐个通过电感耦合等离子体质谱(inductively coupled plasma mass spectrometry, ICP-MS)检测装置,然后对每个细胞中各种金属标签进行检测,形成原子质量谱,再将测量的数据转换为细胞表面或内部的信号分子数据,通过专业的数据分析软件对获得的数据进行降维分析,从而达到对细胞表型和信号网络的精细观测的目的[2, 14-15],见图 1(自绘)。
|
| 图 1 CyTOF工作原理 Figure 1 Working principle diagram of cytometry by time-of-flight |
与流式细胞术(flow cytometry, FCM)相比,CyTOF主要有两点不同:第一,抗体标记系统不同。前者主要使用各种荧光素作为抗体标志物,后者则使用各种金属元素作为标志物;第二,检测系统不同。前者检测系统为激光器和光电倍增管,而后者检测系统为ICP-MS技术。因此CyTOF具有如下优势:(1)全新概念的金属标志物,理想的标志物需要满足4个条件:无放射性、生物样品中含量低、易于标记和检测、种类多。金属标志物与细胞的非特异性结合极弱,在细胞中的含量极低,背景极低,不会影响细胞正常的生理功能,目前已发现的金属元素种类有一百多种,用于抗体标记的金属元素有30多种,所以金属元素是细胞标志物的极佳选择。(2)测量参数多,上百个独立的检测通道。质谱流式细胞仪中的ICP-MS装置具有非常宽的原子量检测范围(88~210 Da),可以同时检测上百个不同的参数,使通道数量增加到上百个。(3)质谱检测的分辨率高,通道间无干扰,无需补偿计算。(4)高灵敏度和高稳定性。荧光流式细胞仪通道间灵敏度相差很大,CyTOF流式细胞仪各通道间灵敏度相差较小,且稳定性高,不同时间对同一样品检测结果变异系数(coefficient of variation, CV)值< 3%,结果具有很好的重复性。(5)多元化的数据分析方法,实现对样品的深入分析,除了传统的流式分析方法外,研究者可以根据各自实验目的选择不同的数据分析方法,常用的分析方法有:SPADE(spanning-tree progression analysis of density normalized events)、主成分分析(principal component analysis, PCA)、viSNE(visualization for high-dimensional single-cell data based on the t-Distributed Stochastic Neighbor Embedding (t-SNE) algorithm)及Gemstone等[2, 16]。
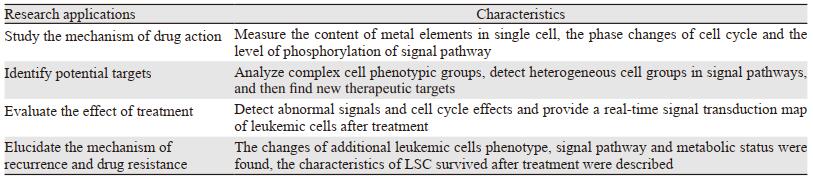
3 CyTOF在白血病治疗中的应用随着免疫学研究的发展,白血病个体化靶向治疗已成为新的发展方向。CyTOF是一种新型单细胞分析技术,可以全面分析细胞表型和信号网络。近年来,CyTOF在白血病治疗研究中的应用日益广泛,为白血病精细化个体治疗提供指导,CyTOF在白血病治疗中的研究应用及特点,见表 1。
|
质谱流式细胞仪的ICP-MS技术具有检测背景低、干扰少、灵敏度高、动态范围宽等优点,可精确测定单细胞内元素含量,用于药物作用机制的研究。Zhou等[17]用CyTOF研究砷剂治疗白血病的机制,砷剂可用于治疗多种类型的白血病,对急性早幼粒细胞白血病(acute promyelocytic leukemia, APL)疗效显著,可达到完全缓解,目前三氧化二砷(As2O3)治疗APL的机制主要有诱导细胞分化、促进细胞凋亡、抑制细胞增殖、诱导细胞自噬、抑制血管生成[18-20],鉴于砷剂治疗白血病取得了很好的效果,为进一步探索砷剂治疗白血病的机制及影响药物作用的因素,研究者用CyTOF测定含砷药物在单个白血病细胞不同细胞周期中的摄取量及细胞毒性作用,通过对比两种含砷药物(ATO和ZIO-101)在白血病细胞中跨细胞周期的摄取及细胞毒性作用,在单细胞水平上证实了含砷药物的细胞周期依赖性摄取和细胞毒性作用,为进一步研究细胞周期时相变化对抗癌药物的影响提供了理论依据。
CyTOF可监测药物治疗期间信号通路的变化,可从药物影响信号通路变化方面研究抗白血病药物的作用机制。阿帕替尼是一种新型血管内皮生长因子-2受体(vascular endothelial growth factor receptor 2, VEGFR-2)酪氨酸激酶抑制剂,通过抑制VEGFR-2磷酸化,下调其下游胞外信号通路调节激酶的磷酸化水平,继而抑制肿瘤血管生成达到抗肿瘤的目的[21],为了解阿帕替尼抗白血病细胞毒作用的潜在机制,Deng等[22]用CyTOF在单细胞水平测量细胞内信号通路,结果显示,VEGFR-2下游多条信号通路受到阿帕替尼的抑制,包括PI3K(AKT,S6,4E-BP1)、MAPK(p38, MAPKAPK2, ERK1/2)和STAT3通路,表明阿帕替尼通过抑制VEGFR-2磷酸化及其下游信号通路诱导白血病细胞死亡,支持阿帕替尼在白血病治疗中的潜在作用。Bandyopadhyay等[23]联合使用伊马替尼(imatinib, IM)和阿伐麦布(酰基辅酶A-胆固醇酰基转移酶1(ACAT-1)抑制剂)治疗IM耐药的慢性髓系白血病(chronic myelogenous leukemia, CML)患者,发现二者对IM耐药的CML细胞在抑制细胞增殖方面有协同效应,在正常细胞或IM敏感CML细胞中无协同效应。用CyTOF分析其机制,发现这种协同作用部分是由于阿伐麦布下调了MAPK通路,后者在IM耐药的CML中被激活,从而使CML细胞对IM治疗敏感。通过对药物作用机制及其作用靶点分析,可了解到在白血病治疗中,可能需要靶向白血病增殖的多种驱动因子的治疗才能获得更深的治疗应答。
3.2 识别白血病治疗的潜在靶点CyTOF作为一种新型的单细胞分析工具,可以分析免疫系统的复杂性,描述异质微环境中复杂的细胞表型群体,表征信号通路,可用于潜在治疗靶点的研究。Jiang等[24]利用CyTOF等技术研究了Wnt/β-catenin和FLT3联合抑制在FLT3突变型AML中的抗白血病活性,发现阻断Wnt/β-catenin信号转导对AML干细胞有很强的抑制作用,并与FLT3抑制有协同作用,这为临床治疗FLT3突变的AML提供了理论依据。Edwards等[25]研究发现集落刺激因子1受体(CSF1R)不是在大多数白血病细胞上表达,而是在支持细胞亚群中表达,用CyTOF分析发现表达CSF1R的细胞通过分泌肝细胞生长因子(hepatocyte growth factor, HGF)等细胞因子促进白血病细胞生长,从而将CSF1R确定为AML的一种新的治疗靶点,并提供了一种旁分泌细胞因子/生长因子信号通路的机制,CSF1R抑制剂通过阻断支持细胞的旁分泌信号,在AML中表现出抗肿瘤活性。Carter等[26]利用CyTOF等技术的研究表明,黏着斑激酶(focal adhesion kinase, FAK)调节白血病-基质相互作用,并支持白血病细胞存活,抑制FAK可降低间质细胞介导的AML细胞迁移和活性,并延长生存期,因此FAK是AML的一个潜在治疗靶点。
Wierz等[11]用CyTOF分析慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL)肿瘤微环境表型复杂性,表明在CLL微环境中,大多数免疫细胞群上调PD1(programmed cell death protein 1)和LAG3(lymphocyte-activation gene 3),双重PD1/LAG3阻断有效地限制了CLL的发展,并恢复了免疫微环境活性,证明双抗PD1/LAG3治疗是一种可能对CLL患者有益的潜在组合,为白血病的治疗提供了潜在靶点。Sarno等[27]用CyTOF分析高表达CRLF2(cytokine Receptor Like Factor 2)的B前体细胞急性淋巴细胞白血病(B-cell precursor acute lymphoblastic leukemia, BCP-ALL)细胞,对TSLP/CRLF2信号通路进行详细的表征,观察信号通路中的异质细胞群,发现SRC/ABL抑制剂使TSLP下游的信号通路中断,发现了新的靶向治疗的关键点,为携带CRLF2突变的BCP-ALL患者提供了新的治疗前景。随着白血病潜在治疗靶点的不断发现,白血病的治疗效果有望得到改善。
3.3 监测治疗效果CyTOF可监测治疗期间的骨髓细胞类型及信号通路,Behbehani等[10]用CyTOF检测FLT3-ITD+ AML中的异常信号以及测量羟基脲治疗的细胞周期效应,从而监测白血病患者对靶向治疗和细胞毒性治疗的反应。由于CyTOF可以同时评估多种骨髓细胞类型,可用于监测免疫治疗方法(如嵌合抗原受体T细胞)的疗效。CyTOF还可用于评估新型药物的治疗效果,Saenz等[28]用CyTOF监测AML干/祖细胞对新型BET(bromodomain and extra terminal domain)抑制剂的治疗反应。利用CyTOF高维多参数单细胞分析技术的优势,Gullaksen等[29]用其监测CML患者酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI)治疗期间单个细胞的信号转导变化,通过提供接近实时的癌细胞信号转导图谱,揭示TKI调节信号转导与临床应答之间的关系。
3.4 白血病复发和耐药机制的研究CyTOF将单细胞流式细胞术与质谱分析相结合,能在单细胞水平上了解白血病生物学的特点。该技术与先进的数据分析方法结合,能够发现额外的表面和胞内分子所致的AML的表型复杂性和多样性,表征信号通路和代谢状态,识别在白血病复发中起关键作用的白血病干细胞(leukemia stem cell, LSC),改善LSC的特性对于防止AML复发和提高AML治愈率至关重要。此外,CyTOF亦可识别治疗后AML表型和细胞内暂时或永久的改变,描述治疗后存活的单个LSC的特征,确定导致AML耐药机制发展的因素,从而发现AML耐药的新治疗方法[30]。白血病复发和耐药是影响患者预后的主要因素,阐明白血病复发和耐药机制是有效治疗白血病的关键。
4 结语CyTOF作为一种新型高维多参数的单细胞分析技术,可精确全面的分析细胞群免疫分型及细胞内信号网络。利用CyTOF高通量、多参数、高灵敏度及高稳定性等检测分析特点,该技术可用于白血病肿瘤微环境的研究,可在异质微环境中描述免疫背景和复杂细胞表型,分析细胞内信号网络传导,深入探究白血病发病机制,研究药物作用机理,发现更多白血病治疗的潜在新靶点,评估治疗效果,阐述白血病复发和耐药机制,有望为白血病的治疗带来新的进展。未来白血病治疗期望实现个体化、靶向治疗,CyTOF作为一种新型单细胞分析技术出现,允许快速实施和应用,可作为指导白血病个体化治疗的一个重要工具。
作者贡献:
田红娟:文献调研、论文设计与撰写
张任乐、乔艳红:文献调研
张登霞、刘蓓:论文设计与修改
| [1] |
Spitzer MH, Nolan GP. Mass cytometry: single cells, many features[J]. Cell, 2016, 165(4): 780-791. DOI:10.1016/j.cell.2016.04.019 |
| [2] |
周琰, 李琴, 刘皋林, 等. 临床(前)研究的质谱流式细胞术——流式细胞技术的"后荧光时代"[J]. 中国新药与临床杂志, 2017, 36(1): 1-6. [Zhou Y, Li Q, Liu GL, et al. Mass cytometry in (pre) clinical studies——the "post-fluorescence era" of cytometry[J]. Zhongguo Xin Yao Yu Lin Chuang Za Zhi, 2017, 36(1): 1-6.] |
| [3] |
Bandyopadhyay S, Fowles JS, Yu L, et al. Identification of functionally primitive and immunophenotypically distinct subpopulations in secondary acute myeloid leukemia by mass cytometry[J]. Cytometry B Clin Cytom, 2019, 96(1): 46-56. DOI:10.1002/cyto.b.21743 |
| [4] |
McCarthy RL, Mak DH, Burks JK, et al. Rapid monoisotopic cisplatin based barcoding for multiplexed mass cytometry[J]. Sci Rep, 2017, 7(1): 3779. DOI:10.1038/s41598-017-03610-2 |
| [5] |
Duckworth AD, Gherardini PF, Sykorova M, et al. Multiplexed profiling of RNA and protein expression signatures in individual cells using flow or mass cytometry[J]. Nat Protoc, 2019, 14(3): 901-920. DOI:10.1038/s41596-018-0120-8 |
| [6] |
Chretien AS, Fauriat C, Orlanducci F, et al. Natural killer defective maturation is associated with adverse clinical outcome in patients with acute myeloid leukemia[J]. Front Immunol, 2017, 8: 573. DOI:10.3389/fimmu.2017.00573 |
| [7] |
Zafeiris D, Vadakekolathu J, Wagner S, et al. Discovery and application of immune biomarkers for hematological malignancies[J]. Expert Rev Mol Diagn, 2017, 17(11): 983-1000. DOI:10.1080/14737159.2017.1381560 |
| [8] |
Lamble AJ, Dietz M, Laderas T, et al. Integrated functional and mass spectrometry-based flow cytometric phenotyping to describe the immune microenvironment in acute myeloid leukemia[J]. J Immunol Methods, 2018, 453: 44-52. DOI:10.1016/j.jim.2017.11.010 |
| [9] |
Good Z, Sarno J, Jager A, et al. Single-cell developmental classification of B cell precursor acute lymphoblastic leukemia at diagnosis reveals predictors of relapse[J]. Nat Med, 2018, 24(4): 474-483. DOI:10.1038/nm.4505 |
| [10] |
Behbehani GK, Samusik N, Bjornson ZB, et al. Mass cytometric functional profiling of acute myeloid leukemia defines cell-cycle and immunophenotypic properties that correlate with known responses to therapy[J]. Cancer Discov, 2015, 5(9): 988-1003. DOI:10.1158/2159-8290.CD-15-0298 |
| [11] |
Wierz M, Janji B, Berchem G, et al. High-dimensional mass cytometry analysis revealed microenvironment complexity in chronic lymphocytic leukemia[J]. Oncoimmunology, 2018, 7(8): e1465167. |
| [12] |
Chen H, Lau MC, Wong MT, et al. Cytofkit: a bioconductor package for an integrated mass cytometry data analysis pipeline[J]. PLoS Comput Biol, 2016, 12(9): e1005112. DOI:10.1371/journal.pcbi.1005112 |
| [13] |
Chattopadhyay PK, Winters AF, Lomas WE, et al. High-parameter single-cell analysis[J]. Annu Rev Anal Chem (Palo Alto Calif), 2019, 12(1): 411-430. DOI:10.1146/annurev-anchem-061417-125927 |
| [14] |
Behbehani GK. Applications of mass cytometry in clinical medicine: the promise and perils of clinical CyTOF[J]. Clin Lab Med, 2017, 37(4): 945-964. DOI:10.1016/j.cll.2017.07.010 |
| [15] |
Mironov GG, Bouzekri A, Watson J, et al. Aptamer-facilitated mass cytometry[J]. Anal Bioanal Chem, 2018, 410(13): 3047-3051. DOI:10.1007/s00216-018-1011-0 |
| [16] |
程小艳, 武会娟. 流式细胞术最新进展及临床应用[J]. 中国免疫学杂志, 2019, 35(10): 1271-1276. [Cheng XY, Wu HJ. Latest progress and clinical application of flow cytometry[J]. Zhongguo Mian Yi Xue Za Zhi, 2019, 35(10): 1271-1276.] |
| [17] |
Zhou Y, Wang H, Tse E, et al. Cell cycle-dependent uptake and cytotoxicity of arsenic-based drugs in single leukemia cells[J]. Anal Chem, 2018, 90(17): 10465-10471. DOI:10.1021/acs.analchem.8b02444 |
| [18] |
张勇, 吴献贤, 张海莹, 等. 三氧化二砷治疗早幼粒细胞白血病和毒性作用研究进展[J]. 中国药理学与毒理学杂志, 2017, 31(6): 675-681. [Zhang Y, Wu XX, Zhang HY, et al. Anti-leukemia effect and toxicity of arsenic trioxide: A review[J]. Zhongguo Yao Li Xue Yu Du Li Xue Za Zhi, 2017, 31(6): 675-681.] |
| [19] |
王怀宇, 张慧云, 刘湲, 等. 急性早幼粒细胞白血病亚砷酸治疗剂量与复发关系的初步研究[J]. 中国实验血液学杂志, 2018, 26(3): 705-709. [Wang HY, Zhang HY, Liu Y, et al. Relationship between the Therapeutic Dose of Arsenic Trioxide and Relapse in Acute Promyelocytic Leukemia[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2018, 26(3): 705-709.] |
| [20] |
何晓薇, 燕玮, 杨威. 三氧化二砷对慢性髓系白血病细胞Hedgehog通路的影响[J]. 中国实验血液学杂志, 2015, 23(4): 971-975. [He XW, Yan W, Yang W. Effect of As2O3 on Hedgehog Pathway in Chronic Myeloid Leukemia Cells[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2015, 23(4): 971-975.] |
| [21] |
Wang Y, Deng M, Chen Q, et al. Apatinib exerts anti-tumor activity to non-Hodgkin lymphoma by inhibition of the Ras pathway[J]. Eur J Pharmacol, 2019, 843: 145-153. DOI:10.1016/j.ejphar.2018.11.012 |
| [22] |
Deng M, Zha J, Jiang Z, et al. Apatinib exhibits anti-leukemia activity in preclinical models of acute lymphoblastic leukemia[J]. J Transl Med, 2018, 16(1): 47. DOI:10.1186/s12967-018-1421-y |
| [23] |
Bandyopadhyay S, Li J, Traer E, et al. Cholesterol esterification inhibition and imatinib treatment synergistically inhibit growth of BCR-ABL mutation-independent resistant chronic myelogenous leukemia[J]. PLoS One, 2017, 12(7): e0179558. DOI:10.1371/journal.pone.0179558 |
| [24] |
Jiang X, Mak PY, Mu H, et al. Disruption of wnt/β-catenin exerts antileukemia activity and synergizes with FLT3 inhibition in FLT3-mutant acute myeloid leukemia[J]. Clin Cancer Res, 2018, 24(10): 2417-2429. DOI:10.1158/1078-0432.CCR-17-1556 |
| [25] |
Edwards DK, Watanabe-Smith K, Rofelty A, et al. CSF1R inhibitors exhibit antitumor activity in acute myeloid leukemia by blocking paracrine signals from support cells[J]. Blood, 2019, 133(6): 588-599. DOI:10.1182/blood-2018-03-838946 |
| [26] |
Carter BZ, Mak PY, Wang X, et al. Focal adhesion kinase as a potential target in AML and MDS[J]. Mol Cancer Ther, 2017, 16(6): 1133-1144. DOI:10.1158/1535-7163.MCT-16-0719 |
| [27] |
Sarno J, Savino AM, Buracchi C, et al. SRC/ABL inhibition disrupts CRLF2-driven signaling to induce cell death in B-cell acute lymphoblastic leukemia[J]. Oncotarget, 2018, 9(33): 22872-22885. DOI:10.18632/oncotarget.25089 |
| [28] |
Saenz DT, Fiskus W, Qian Y, et al. Novel BET proteinproteolysis-targeting chimera exerts superior lethal activity than bromodomain inhibitor (BETi) against post-myeloproliferative neoplasm secondary (s) AML cells[J]. Leukemia, 2017, 31(9): 1951-1961. DOI:10.1038/leu.2016.393 |
| [29] |
Gullaksen SE, Skavland J, Gavasso S, et al. Single cell immune profiling by mass cytometry of newly diagnosed chronic phase chronic myeloid leukemia treated with nilotinib[J]. Haematologica, 2017, 102(8): 1361-1367. DOI:10.3324/haematol.2017.167080 |
| [30] |
Zeng Z, Konopleva M, Andreeff M. Single-cell mass cytometry of acute myeloid leukemia and leukemia stem/progenitor cells[J]. Methods Mol Biol, 2017, 1633: 75-86. |
 2021, Vol. 48
2021, Vol. 48


