文章信息
- 胸腺瘤术后患者预后营养指数与总生存率的相关性
- Correlation of Prognostic Nutritional Index with Overall Survival of Postoperative Patients with Thymoma
- 肿瘤防治研究, 2021, 48(2): 140-144
- Cancer Research on Prevention and Treatment, 2021, 48(2): 140-144
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0651
- 收稿日期: 2020-06-11
- 修回日期: 2020-09-18
2. 050011 石家庄,河北医科大学第四医院肿瘤研究所
2. Tumor Research Institute, The Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China
近年来的研究显示预后营养指数(prognostic nutritional index, PNI)与恶性肿瘤患者的预后相关[1-2]。本课题组前期研究也报道了PNI在评估食管癌患者预后中的价值[3],胸腺肿瘤占前纵隔肿瘤的20%~26%[4],然而PNI与胸腺瘤患者预后的关系目前尚未见报道。本研究拟讨论PNI与接受手术的胸腺瘤患者总生存率的关系。
1 资料与方法 1.1 研究对象回顾性分析1998年1月1日—2015年12月31日河北医科大学第四医院收治的173例接受手术的胸腺瘤患者的临床病理资料。入选标准:(1)根据胸部CT及术后病理确诊胸腺瘤;(2)初诊未行任何新辅助治疗;(3)采血前2周内无合并感染性疾病,未进行输血治疗;(4)接受胸腺切除+前纵隔脂肪清扫术;(5)随访时间 > 3月。排除标准:(1)复发性胸腺瘤;(2)临床资料不完整;(3)失访病例。173例患者中男85例,女88例;平均年龄49.8(31~62)岁。本研究经河北医科大学第四医院伦理审查委员会批准,患者均知情同意。
1.2 分析方法计算PNI:PNI=淋巴细胞绝对值(109/L)×5+血清白蛋白(g/L)。取患者术前2周内采血结果,根据既往研究报道PNI最佳截断值PNI=45进行分组[5],将全组患者分为PNI≤45组(118例)和PNI > 45组(55例)。
分析PNI与患者性别、年龄、术后是否接受放疗、是否合并重症肌无力、Masaoka分期、WHO分型以及是否R0切除的关系。患者年龄以 < 50岁及≥50岁分组。将所有影响因素及PNI纳入单因素及多因素生存分析。
1.3 随访方法患者出院后每3~6月随访1次,以门诊或电话询问方式进行随访。随访日期自手术日起截至2018年12月31日或患者死亡之日。
1.4 统计学方法采用SPSS24.0软件进行统计学分析,计数资料采用χ2检验, 通过Kaplan-Meier法计算5年生存率,绘制生存曲线,Log rank法对各组间的生存差异进行单因素分析,Cox回归模型法进行多因素分析。P < 0.05为差异有统计学意义。
2 结果 2.1 全组患者临床病理因素分析及影响PNI的临床病理因素本组中,PNI除与WHO分型有关(χ2=26.322, P < 0.001)外,与患者的性别、年龄、术后是否接受放疗、是否合并重症肌无力、Masaoka分期以及是否R0切除等多种临床病理因素无关(均P > 0.05),见表 1。
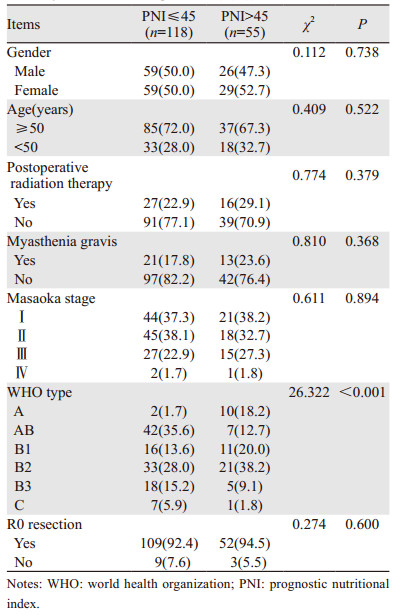
|
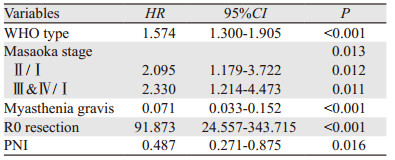
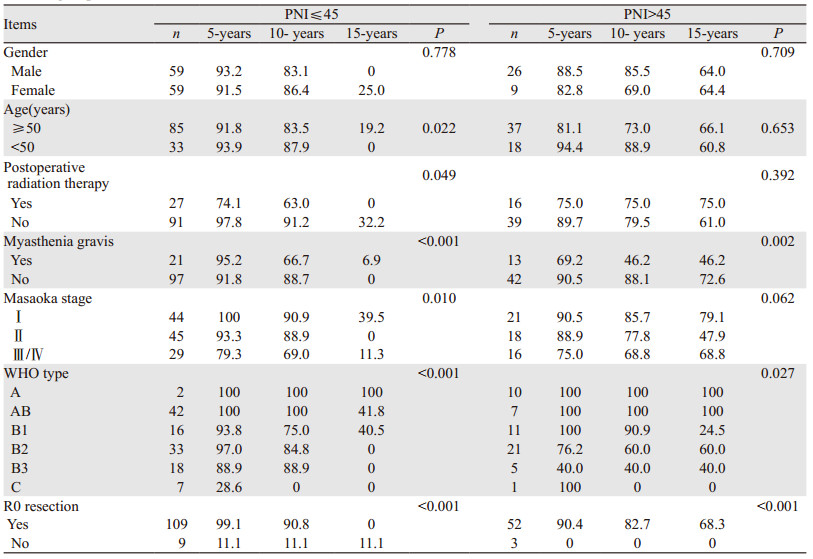
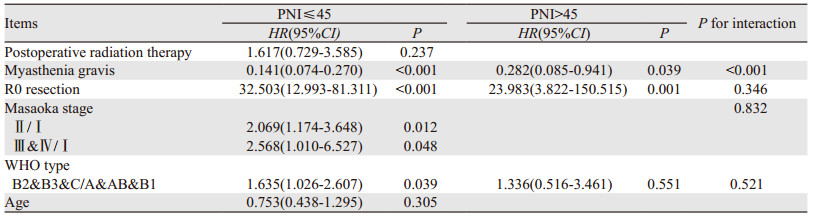
173例患者中位随访时间148(32~238)月,经单因素分析后再行多因素分析,结果显示是否合并重症肌无力、Masaoka分期、WHO分型、是否R0切除和PNI是影响患者总生存率的独立危险因素,见图 1、表 2~3。PNI≤45组患者15年生存率为0,PNI > 45组患者15年生存率64.5%,两组间比较差异有统计学意义(P=0.029)。进一步进行分层分析,单、多因素分析结果显示,是否合并重症肌无力、Masaoka分期、WHO分型、是否R0切除是影响PNI≤45组患者总生存率的独立危险因素;是否合并重症肌无力、是否R0切除是影响PNI > 45组患者总生存率的独立危险因素,见表 4、5。分析PNI和各变量之间的交互作用发现,PNI与是否合并重症肌无力之间存在交互作用,合并有重症肌无力的患者越容易出现PNI降低,从而对总生存率产生不良影响,见表 5。

|
| PNI: prognostic nutrition index 图 1 预后营养指数对胸腺瘤术后患者总生存率的影响 Figure 1 Effect of PNI on overall survival of postoperative patients with thymoma |

|
|
|
|
以往对胸腺瘤预后的研究中,胸腺瘤患者的性别、年龄、是否合并重症肌无力、Masaoka分期、WHO分型、手术是否R0切除、术后是否给予辅助治疗均被发现与胸腺瘤的预后有关[4, 6-15]。本研究结果显示,是否合并重症肌无力、Masaoka分期、WHO分型和手术是否R0切除和预后营养指数(PNI)与胸腺瘤患者的总生存率有关。低PNI组患者总生存率较低,说明低免疫-营养状态可能减低机体对肿瘤细胞的识别和杀伤能力,相对增强了肿瘤细胞的增殖迁徙能力,从而增加了复发率和转移率。PNI是影响胸腺瘤患者术后生存率的独立因素,可能成为预测胸腺瘤患者总生存率的新指标。目前各中心对于胸腺瘤手术患者的术前准备已十分充分,能够较好地改善患者术前的免疫营养状态,然而这个过程较长,手术患者是否有必要进行长时间准备,对于患者住院时长和经济负担都有直接的影响。于是本研究进一步对PNI高低两组患者的生存情况进行分层分析,发现术前免疫——营养状态相对较差的(PNI≤45)亚组患者中,是否合并重症肌无力、Masaoka分期、WHO分型和手术是否R0切除与患者总生存率有关,而在术前免疫——营养状态相对良好的患者(PNI > 45)亚组中,患者总生存率仅与是否合并重症肌无力及手术方式是否R0切除有关。
在以往对胃癌和肝癌等消化系统恶性肿瘤的研究当中,有研究发现预后营养指数较低的患者预后更差[16-17]。我们在对食管腺癌患者的研究中也发现,预后营养指数是患者术后生存的独立预后影响因素[3]。本研究单、多因素分析提示PNI≤45组胸腺瘤患者总生存率较低,首次发现低PNI是影响接受手术治疗的胸腺瘤患者总生存率的独立危险因素。分层分析发现是否合并重症肌无力、Masaoka分期、WHO分型、手术方式是影响PNI≤45组胸腺瘤患者总生存率的独立因素;是否合并重症肌无力、是否R0切除是影响PNI > 45组患者总生存率的独立危险因素。说明预后营养指数(PNI)影响胸腺瘤手术患者的总生存率。与食管癌、胃癌、肝癌等其他肿瘤患者一样,接受手术治疗的胸腺瘤患者术前应积极改善免疫——营养状态,尽量使预后营养指数达到45以上。
本研究队列显示,不伴重症肌无力的胸腺瘤患者总生存率较好(HR=0.071, 95%CI: 0.033~0.152, P < 0.001)。PNI与是否合并重症肌无力之间存在交互作用,说明合并有重症肌无力的患者容易出现PNI降低,从而对预后产生不良影响。因此对于合并有重症肌无力的胸腺瘤患者术前应常规监测PNI。此外,本研究发现,在两个亚组中,不伴重症肌无力的胸腺瘤患者总生存率均较好(PNI≤45组:HR=0.141, CI: 0.074-0.270, P < 0.001;PNI > 45组:HR=0.282, CI: 0.085-0.941, P=0.039)。中国胸腺疾病协作组在2017年关于重症肌无力对胸腺瘤患者预后影响的报道认为,对于早期胸腺瘤患者(MasaokaⅠ期)合并有重症肌无力的预后较单纯胸腺瘤患者差,而在Ⅲ/Ⅳ期患者中预后较好[6]。其他文献报道也有类似结果[7-10]。本研究中早期胸腺瘤患者(Ⅰ+Ⅱ期)占比较多(128/173, 74%),可能与不伴重症肌无力的胸腺瘤患者预后较好的结果有关[11-13]。胸腺是人体产生特异性免疫细胞的器官,而合并有重症肌无力的患者存在自身免疫状态异常。PNI反映了胸腺瘤患者接受治疗前的营养和免疫状态。由此我们推测,重症肌无力可能与患者的营养和免疫状态有关,进而对于胸腺瘤患者的预后产生影响[7-10, 14]。
从本研究结果来看,手术是否R0切除,是影响预后的独立危险因素。非R0切除患者的死亡风险是R0切除患者的91.9倍。从分层分析结果来看,无论在PNI低值组还是高值组,手术是否R0切除都是影响总生存率的独立危险因素。在PNI低值组和高值组中,非R0切除患者的死亡风险分别是R0切除患者的32.5和24倍。R0切除对于胸腺肿瘤患者的预后有重要的影响[15, 18-19]。完整切除胸腺瘤在胸腺肿瘤的治疗中仍然起到举足轻重的作用[20-23]。但本研究为单中心回顾性研究,研究结果仍需多中心大样本的前瞻性研究进一步明确和证实。
综上,本研究表明,术前免疫和营养状态良好的胸腺瘤患者,其远期生存较好。合并重症肌无力、Masaoka分期较晚、WHO分型较差、非R0切除和预后营养指数较低(PNI≤45)是影响接受手术的胸腺瘤患者总生存率的独立危险因素。对于合并有重症肌无力的胸腺瘤患者容易出现PNI降低,从而对总生存率产生不良影响。建议对这一类患者术前常规监测PNI。
作者贡献:
王岩:研究方向的设计论证、数据的收集和统计分析及论文的写作
曹玉:数据的统计分析
殷金环:数据的收集
刘俊峰:论文的写作及研究的设计
| [1] |
Nozoe T, Ninomiya M, Maeda T, et al. Prognostic nutritional index: a tool to predict the biological aggressiveness of gastric carcinoma[J]. Surg Today, 2010, 40(5): 440-443. DOI:10.1007/s00595-009-4065-y |
| [2] |
Kanda M, Fujii T, Kodera Y, et al. Nutritional predictors of postoperative outcome in pancreatic cancer[J]. Br J Surg, 2011, 98(2): 268-274. DOI:10.1002/bjs.7305 |
| [3] |
王岩, 陶仁海, 曹玉, 等. 预后营养指数在食管腺癌患者预后评估中的价值研究[J]. 中国全科医学, 2016, 19(28): 3428-3433. [Wang Y, Tao RH, Cao Y, et al. Investigation in Prognostic Value of Prognostic Nutritional Index in Patients with Esophageal Adenocarcinoma[J]. Zhongguo Quan Ke Yi Xue, 2016, 19(28): 3428-3433.] |
| [4] |
中国胸腺肿瘤研究协作组. 胸腺瘤术后临床病理分期与预后相关性的回顾性研究[J]. 中华胸心血管外科杂志, 2017, 33(5): 286-289. [Chinese Alliance of Research for Thymomas, ChART. The correlation analysis of thymoma postoperative clinical staging (Masaoka-Koga staging) and prognosis: a retrospective analysis[J]. Zhonghua Xiong Xin Xue Guan Wai Ke Za Zhi, 2017, 33(5): 286-289.] |
| [5] |
Onodera T, Goseki N, Kosaki G. Prognostic nutritional index in gastrointestinal surgery of malnourished cancer patients[J]. Nihon Geka Gakkai Zasshi, 1984, 85(9): 1001-1005. |
| [6] |
Wang F, Pang L, Fu J, et al. Postoperative survival for patients with thymoma complicating myasthenia gravis-preliminary retrospective results of the ChART database[J]. J Thorac Dis, 2016, 8(4): 711-717. DOI:10.21037/jtd.2016.02.07 |
| [7] |
Yu L, Zhang XJ, Ma S, et al. Different characteristics of thymomas with and without myasthenia gravis[J]. Ann Surg Oncol, 2012, 19(1): 94-98. DOI:10.1245/s10434-011-1896-8 |
| [8] |
Zhang Z, Cui Y, Jia R, et al. Myasthenia gravis in patients with thymoma affects survival rate following extended thymectomy[J]. Oncol Lett, 2016, 11(6): 4177-4182. DOI:10.3892/ol.2016.4528 |
| [9] |
袁东风, 谷志涛, 梁光辉, 等. 胸腺瘤合并重症肌无力患者预后的临床研究[J]. 中国肺癌杂志, 2018, 21(1): 1-7. [Yuan DF, Gu ZT, Liang GH, et al. Clinical Study on the Prognosis of Patients with Thymoma with Myasthenia Gravis[J]. Zhongguo Fei Ai Za Zhi, 2018, 21(1): 1-7.] |
| [10] |
李田, 吴显宁, 解明然, 等. 胸腺切除加前纵隔脂肪清扫治疗重症肌无力的预后分析[J]. 中华外科杂志, 2017, 55(4): 292-296. [Li T, Wu XN, Xie MR, et al. Prognostic analysis of patients with myasthenia gravis after extended thymectomy[J]. Zhonghua Wai Ke Za Zhi, 2017, 55(4): 292-296.] |
| [11] |
刘洪生, 任海涛, 周立新, 等. 胸腺瘤合并神经系统副肿瘤综合征临床分析[J]. 中华医学杂志, 2017, 97(35): 2770-2774. [Liu HS, Ren HT, Zhou LX, et al. Clinical analysis of paraneoplastic neurological syndrome associated with thymoma[J]. Zhonghua Yi Xue Za Zhi, 2017, 97(35): 2770-2774.] |
| [12] |
庞烈文, 汪防睿, 方文涛. 重症肌无力对胸腺瘤患者预后的影响[J]. 中华胸心血管外科杂志, 2017, 33(3): 133-134. [Pang LW, Wang FR, Fang WT. The influence of myasthenia gravis on the prognosis of thymoma patients[J]. Zhonghua Xiong Xin Xue Guan Wai Ke Za Zhi, 2017, 33(3): 133-134.] |
| [13] |
柳阳春, 章晔, 林庆, 等. 重症肌无力胸腺切除围手术期规范、程序化处理探索[J]. 中华胸心血管外科杂志, 2017, 33(3): 151-154. [Liu YC, Zhang Y, Lin Q, et al. A protocol for the perioperative management of thymectomy for myasthenia gravis patients[J]. Zhonghua Xiong Xin Xue Guan Wai Ke Za Zhi, 2017, 33(3): 151-154.] |
| [14] |
薛志强, 初向阳, 张连斌, 等. 达芬奇机器人与电视胸腔镜治疗胸腺瘤合并重症肌无力的效果[J]. 中华胸心血管外科杂志, 2017, 33(3): 141-143. [Xue ZQ, Chu XY, Zhang LB, et al. The study of clinical outcomes of extended thymectomy by robotic and video assisted thoracoscopic surgey for thymoma with myasthenia gravis[J]. Zhonghua Xiong Xin Xue Guan Wai Ke Za Zhi, 2017, 33(3): 141-143.] |
| [15] |
杨立, 范翔宇, 陆冬玲, 等. 胸腺瘤239例预后相关因素分析[J]. 中华肿瘤防治杂志, 2016, 23(18): 1264-1267. [Yang L, Fan XY, Lu DL, et al. Analysis of factors associated with prognosis of 239 case thymoma[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2016, 23(18): 1264-1267.] |
| [16] |
Wu SJ, Lin YX, Ye H, et al. Lymphocyte to monocyte ratio and prognostic nutritional index predict survival outcomes of hepatitis B virus associated hepatocellular carcinoma patients after curative hepatectomy[J]. J Surg Oncol, 2016, 114(2): 202-210. DOI:10.1002/jso.24297 |
| [17] |
Kanda MJ, Fujii T, Kodera Y, et al. Nutritional predictors of postoperative outcome in pancreatic cancer[J]. Br J Surg, 2011, 98(2): 268-274. DOI:10.1002/bjs.7305 |
| [18] |
Wang Y, Liu JF. A retrospective study on the prognostic value of preoperative neutrophil/lymphocyte ratio in patients with primary small-cell carcinoma of the esophagus[J]. Onco Targets Ther, 2017, 10: 2453-2459. DOI:10.2147/OTT.S115637 |
| [19] |
张磊, 杨洋, 吴恺, 等. 无症状胸腺瘤患者的CT特征与世界卫生组织分型的关系[J]. 中华实验外科杂志, 2017, 34(1): 140-142. [Zhang L, Yang Y, Wu K, et al. Correlation of features of chest computed tomographic scans with histologic subtypes of thymoma according to the World Health Organisation classification in asymptomatic patients[J]. Zhonghua Shi Yan Wai Ke Za Zhi, 2017, 34(1): 140-142.] |
| [20] |
张华俊, 程远大, 高阳, 等. 胸腺瘤与胸腺瘤合并重症肌无力患者的临床特点与围手术期临床处理[J]. 中华胸心血管外科杂志, 2017, 33(3): 148-150, 187. [Zhang HJ, Cheng YD, Gao Y, et al. Clinical features and experience of perioperative managements of thymomas with and without myasthenia gravis[J]. Zhonghua Xiong Xin Xue Guan Wai Ke Za Zhi, 2017, 33(3): 148-150, 187.] |
| [21] |
苏运超, 底锦熙, 笪冀平. 不典型A型胸腺瘤临床病理分析[J]. 中华病理学杂志, 2017, 46(5): 314-317. [Su YC, Di JX, Da JP. Clinicopathologic features of atypical type A thymoma[J]. Zhonghua Bing Li Xue Za Zhi, 2017, 46(5): 314-317.] |
| [22] |
贾佳, 朱慧军, 王冰, 等. 侵袭性胸腺瘤术后三维适形放疗预后分析[J]. 中华肿瘤防治杂志, 2016, 23(13): 888-892. [Jia J, Zhu HJ, Wang B, et al. Analysis for the prognosis of patients with invasive thymoma treated by three-dimensional conformal radiotherapy after operation[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2016, 23(13): 888-892.] |
| [23] |
刘乾文, 谷志涛, 杨富, 等. 术后放疗在Ⅰ期/Ⅱ期/Ⅲ期胸腺肿瘤中的作用--ChART回顾性数据库研究结果[J]. 中国肺癌杂志, 2016, 19(7): 465-472. [Liu QW, Gu ZT, Yang F, et al. Role of Postoperative Radiotherapy for StageⅠ/Ⅱ/Ⅲ Thymic Tumor-Results of the ChART Retrospective Database[J]. Zhongguo Fei Ai Za Zhi, 2016, 19(7): 465-472.] |
 2021, Vol. 48
2021, Vol. 48
