文章信息
- 肿瘤细胞减灭术加腹腔热灌注化疗治疗腹膜后巨大脂肪肉瘤
- Cytoreductive Surgery plus Hyperthermic Intraperitoneal Chemotherapy on Huge Retroperitoneal Liposarcoma
- 肿瘤防治研究, 2021, 48(1): 103-106
- Cancer Research on Prevention and Treatment, 2021, 48(1): 103-106
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0625
- 收稿日期: 2020-06-08
- 修回日期: 2020-10-12
2. 050011 石家庄,河北医科大学第四医院胃肠外科
2. Department of General Surgery, The Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China
脂肪肉瘤(liposarcoma)是最常见的腹膜后肿瘤,因位置隐蔽,往往肿瘤生长至非常巨大时才能触及和(或)产生压迫症状;因此,就诊时肿瘤多已侵犯重要脏器和血管。尽管手术切除仍是此病最主要的治疗方法,但常规手术难度极大,术后易复发;积极探索降低/延缓复发的手术综合治疗新模式有重要临床价值和学术意义。本文报道1例腹膜后巨大脂肪肉瘤患者,术前及术后治疗均签署知情同意,接受肿瘤细胞减灭术(cytoreductive surgery, CRS)加腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy, HIPEC)为核心的整合治疗,效果满意,报告如下。
1 资料与方法 1.1 病例资料患者,男,67岁。2019年3月因8月前开始无明显诱因腹胀入院;根据腹部CT等影像学检查,符合腹膜后脂肪肉瘤诊断;因肿瘤巨大,血供丰富,给予3周期术前辅助化疗,方案:多西他赛120 mg d1,卡铂600 mg d2,阿帕替尼250 mg 1次/天,3周/周期。化疗后腹部CT与化疗前相比,肿瘤直径未见明显变化,但肿瘤密度Hu值明显降低,由118 Hu降至55 Hu,见图 1。既往病史:“原发性高血压”病史2年,口服“拜新同”治疗,血压控制良好。查体:左上腹膨隆,左上腹可触及一约30 cm×20 cm质韧肿物,边界欠清,活动度差。腹部CT示:腹腔偏左侧巨大占位,脂肪肉瘤?左侧肾盂、肾扩张积水。入院诊断:(1)腹膜后恶性肿瘤;(2)左肾积水;(3)原发性高血压病2级,很高危。

|
| A and C were the axial and coronal CT manifestations of the huge retroperitoneal tumor before chemotherapy, respectively. A large tumor was pushing the small intestine in the abdominal cavity to the right abdomen, with significant enhancement around the tumor, as shown by the red arrow; The red double-headed arrow indicated the maximum CT value 118Hu; B and D were the axial and coronal CT manifestations of large retroperitoneal tumors after chemotherapy, respectively. The enhancement density around the tumor was reduced, as shown by the red arrow. The red double-headed arrow indicated that CT value decreased from 118Hu to 55Hu after chemotherapy. 图 1 腹膜后巨大脂肪肉瘤患者化疗前后腹部CT影像比较 Figure 1 Comparison of abdominal CT image before and after chemotherapy in patient with huge retroperitoneal liposarcoma |
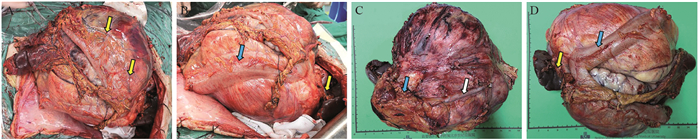
术前准备后行CRS+HIPEC手术。术中探查见:肿瘤占据中上腹腔,约30 cm×20 cm×20 cm大小,黄色包膜完整,表面可见数条肿瘤滋养血管,横结肠及系膜、大网膜受肿瘤侵犯压迫明显,与肿瘤前壁致密粘连,脾脏为肿瘤包绕,肿瘤下极粘连于膀胱后壁,全部小肠被肿瘤推挤到右侧腹。遂行腹膜后肿瘤联合脾、胰尾、左肾及输尿管、横结肠广泛切除术;完整切除肿瘤及周围受侵器官、组织,见图 2。术中HIPEC:盐酸多柔比星40 mg和异环磷酰胺3 g分别溶于3 000 ml 0.9%氯化钠溶液中,加热至43℃,分别持续循环热灌注30 min。手术过程顺利,术中出血约600 ml。
|
| A: the specimen before separation, several trophoblast vessels on the surface of the tumor shown by the yellow arrow; B: the specimen before separation, the invaded colon shown by the blue arrow and the invaded spleen and pancreatic tail shown by the yellow arrow; C: the specimen after separation, the dilatation of the ureter shown by the white arrow, and the kidney surrounded by the neoplasms shown by the blue arrow; D: the specimen after separation, the invaded colon shown by the blue arrow and the invaded spleen and pancreatic tail shown by the yellow arrow. 图 2 腹膜后巨大脂肪肉瘤患者术中情况和术后标本 Figure 2 Intra- and post-operative specimens of the huge retroperitoneal liposarcoma |
患者术后13天顺利出院。未出现腹腔感染、吻合口瘘等不良事件。术后病理:混合型脂肪肉瘤,部分为去分化型,部分为多形性,少部分为高分化,伴大片坏死,侵及脾门、(左)肾上腺被膜、左肾被膜、肾盂及肾窦脂肪、输尿管周边脂肪组织、网膜组织及结肠周围;输尿管断端未见肿瘤;胰腺组织未见肿瘤侵及。
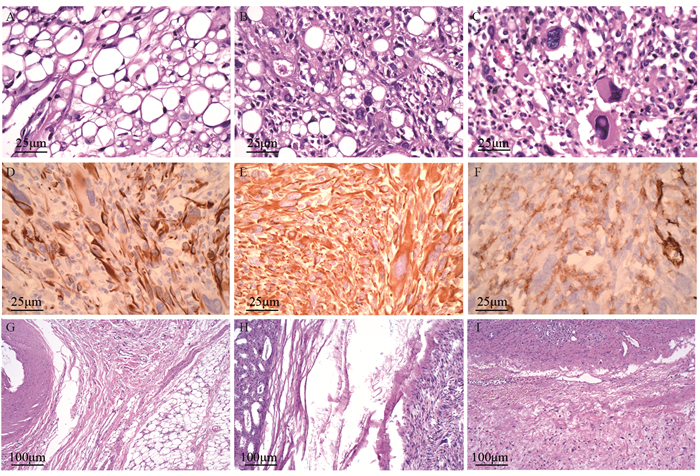
免疫组织化学:CK(-),EMA(-),Vimentin(+),S-100(-),CD117(灶+),CD34(血管+),Dog-1(-),SMA(-),Desmin(+),calretinin(-),BCL-2(+),Ki-67(Index 60%+),CD31(血管+),VEGF(个别+),MLH1(+),MSH2(+),MSH6(+),PMS2(+),见图 3。
|
| Postoperative pathology: mixed-type liposarcoma, partly dedifferentiated, partly pleomorphic, partly highly-differentiated; A: highly-differentiated adipocytes (HE ×400); B: pleomorphic adipocytes (HE ×400); C: dedifferentiated pleomorphic undifferentiated sarcoma (HE ×400); D: DESMIN(+) ×400; E: VIMENTIN(+) ×400; F: CD31(+) ×400; G: splenic hilar invasion, splenic artery-highly differentiated liposarcoma (HE ×100); H: the renal capsule was invaded (HE ×100); I: the adrenal gland was invaded (HE ×100). 图 3 腹膜后巨大脂肪肉瘤患者术后病理及免疫组织化学结果 Figure 3 Postoperative pathologic and immunohistochemical results of the huge retroperitoneal liposarcoma |
随访自2019年4月出院开始,末次随访时间2020年6月,无复发生存。
2 讨论腹膜后脂肪肉瘤早期多无症状,易在组织间隙中蔓延,发现时肿瘤大多侵犯重要脏器,如肾脏、肠道及腹膜后大血管等。目前,首次手术R0切除仍是治疗腹膜后脂肪肉瘤,降低局部复发率、改善生存的有效手段[1]。有研究表明高分化和去分化脂肪肉瘤尽管初发时为单病灶,但复发时可呈多中心的表现,为大范围手术联合脏器切除提供了理论依据[2]。近年来,手术完整切除率虽然已有了大幅度的提高,但是术后局部复发率仍不可忽视,5年内局部复发可达50%[3]。因此,手术之外积极探索预防肿瘤复发的新治疗手段具有积极的临床意义。
目前针对腹膜后肉瘤的化疗药物主要为蒽环类(表柔比星、多柔比星)和烷化剂(异环磷酰胺)。国外有随机对照研究显示阿霉素联合异环磷酰胺进行新辅助化疗,化疗组5年DFS较对照组提高4%[4]。张殿宝等[5]对49例软组织肉瘤患者进行随机对照研究,发现抑制肿瘤血管生成药物联合干扰细胞有丝分裂药物行辅助化疗后,疾病控制率可达52.17%。另有研究发现紫杉醇加卡铂联合化疗方案显示对骨肉瘤有较好的控制率[6]。本病例术前给予联合抗肿瘤化疗方案,患者化疗过程顺利,化疗3周期后通过腹部增强CT影像学评估疗效,提示肿瘤周边强化密度Hu值明显减低,说明联合化疗在一定程度上对区域内肿瘤产生抑制作用,为随后的手术治疗达到R0切除和预防术后复发提供了有利的条件。
术中脱落的肿瘤细胞是导致腹膜后脂肪肉瘤局部复发的危险因素,目前,针对游离癌细胞的有效治疗方式是术中或手术后早期行HIPEC治疗,HIPEC能够有效清除游离癌细胞和微小转移癌灶;腹膜后脂肪肉瘤也可从HIPEC治疗中获益。意大利学者曾对60例腹膜肉瘤患者行术中HIPEC进行研究,发现无进展生存及总生存均有改善[7]。本病例行新辅助化疗后,影像学显示肿瘤周边强化程度减低,提示肿瘤活性衰退。遂遵循CRS切除肿瘤理念,行腹膜后肿瘤联合受侵脏器及组织广泛切除,术中联合HIPEC,利用化疗药物与热效应的协同作用直接杀灭术中脱落游离肿瘤细胞,同时大量的热化疗液灌洗腹腔亦可有效减少游离肿瘤细胞,从而有效预防术后复发[8]。患者术后无不良事件发生。术后病理诊断:混合型脂肪肉瘤,周围脏器均有受侵,说明联合脏器切除的必要性。
局部复发是腹膜后脂肪肉瘤术后一个重要的生物学特性,化疗无疑是除手术之外另一重要的治疗手段。多柔比星早在1974年已被批准用于软组织肉瘤的治疗。目前,多柔比星与异环磷酰胺的联合化疗,已作为软组织肉瘤的标准化疗方案在临床中应用。随着分子生物学与靶向药物的发展,有望选择有效的靶向药物来抑制肿瘤细胞的增殖,从而提高患者的生存率。本例腹膜后脂肪肉瘤患者,通过术前给予新辅助化疗控制肿瘤进展,CRS+HIPEC完全肿瘤细胞减灭,并给予盐酸多柔比星联合异环磷酰胺术后辅助化疗,随访14月,无复发生存,效果良好。近年来基因治疗、靶向治疗、免疫治疗等新的治疗手段逐渐引起人们重视,但在腹膜后肉瘤治疗中推广应用,有待进一步研究。
回顾本病例治疗不足之处在于,术前化疗未取得活检组织病理,主要考虑目前影像学检查可使80%脂肪肉瘤病例获得准确诊断,而穿刺活体组织检查仅使诊断率增加10%,且针吸活检有引起针道种植转移的可能[9]。
综上所述,本文报道了术前辅助化疗联合CRS+HIPEC综合治疗策略成功治疗腹膜后巨大脂肪肉瘤1例,是对腹膜后巨大脂肪肉瘤治疗的一次有效探索。结合文献分析,该策略可能是有效预防腹膜后脂肪肉瘤术后复发的治疗措施,但其疗效和安全性仍需高级别循证医学证据验证。
作者贡献
杨沛刚:参与研究、收集数据及撰写论文
李鑫宝:收集数据、论文修改
刘刚、李勇、赵群:参与研究
安松林:论文修改
李雁:研究方案设计及实施、论文修改
| [1] |
Jiang H, Wang YX, Li B, et al. Surgical management of leiomysarcoma of the inferior vena cava[J]. Vascular, 2015, 23(3): 329-332. DOI:10.1177/1708538114547755 |
| [2] |
Tseng WW, Madewell JE, Wei W, et al. Locoregional disease patterns in well-differentiated and dedifferentiated retroperitoneal liposarcoma: implications for the extent of resection?[J]. Ann Surg Oncol, 2014, 21(7): 2136-2143. DOI:10.1245/s10434-014-3643-4 |
| [3] |
Nussbaum DP, Rushing CN, Lane WO, et al. Preoperative or postoperative radiotherapy versus surgery alone for retroperitoneal sarcoma: a case-control, propensity score-matched analysis of a nationwide clinical oncology database[J]. Lancet Oncol, 2016, 17(7): 966-975. DOI:10.1016/S1470-2045(16)30050-X |
| [4] |
Gortzak E, Azzarelli A, Buesa J, et al. A randomized phaseⅡstudy on neo-adjuvant chemotherapy for high-risk adult soft-tissue sarcoma[J]. Eur J Cancer, 2001, 37(9): 1096-1103. DOI:10.1016/S0959-8049(01)00083-1 |
| [5] |
张殿宝, 康议心, 郭艳珍. 恩度联合吉西他滨、多西他赛治疗晚期软组织肉瘤的疗效及安全性[J]. 现代肿瘤医学, 2018, 26(5): 769-772. [Zhang DB, Kang YX, GUO YZ. Efficacy and safety of Endu combined with gemcitabine and docetaxel in the treatment of advanced soft tissue sarcoma[J]. Xian Dai Zhong Liu Yi Xue, 2018, 26(5): 769-772. DOI:10.3969/j.issn.1672-4992.2018.05.030] |
| [6] |
朱宏财, 孙红. 紫杉醇加卡铂联合化疗治疗恶性骨肿瘤的临床效果观察[J]. 世界最新医学信息文摘, 2017, 17(2): 126-127. [Zhu HC, SUN H. Clinical effect of paclitaxel plus carboplatin combined with chemotherapy in the treatment of malignant bone tumors[J]. Shi Jie Zui Xin Yi Xue Xin Xi Wen Zhai, 2017, 17(2): 126-127.] |
| [7] |
Rossi CR, Deraco M, De Simone MD, et al. Hyperthermic intraperitoneal intraoperative chemotherapy after cytoreductive surgery for the treatment of abdominal sarcomatosis: clinical outcome and prognostic factors in 60 consecutive patients[J]. Cancer, 2004, 100(9): 1943-1950. DOI:10.1002/cncr.20192 |
| [8] |
Giorgio AD, Naticchioni E, Biacchi D, et al. Cytoreductive surgery (peritonectomy procedures) combined with hyperthermic intraperitoneal chemotherapy (HIPEC) in the treatment of diffuse peritoneal carcinomatosis from ovarian cancer[J]. Cancer, 2008, 113(2): 315-325. DOI:10.1002/cncr.23553 |
| [9] |
中华医学会外科学分会外科手术学学组, 中国抗癌协会肉瘤专业委员会, 中国医疗保健国际交流促进会软组织肿瘤分会, 等. 原发性腹膜后软组织肉瘤诊治中国专家共识(2019版)[J]. 中国实用外科杂志, 2019, 39(6): 526-532. [Surgery Group of Chinese Medical Association Surgery Branch, Sarcoma Professional Committee of China Anti-cancer Association, Soft Tissue Oncology Branch of China International Exchange and Promotion Association for Medical and Healthcare, et al. Diagnosis and treatment of primary retroperitoneal soft tissue sarcoma: consensus of Chinese experts(2019)[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2019, 39(6): 526-532.] |
 2021, Vol. 48
2021, Vol. 48


