文章信息
- 肿瘤细胞裂解物联合IL-2预防黑色素瘤发生并抑制肿瘤生长的免疫机制
- Immune Mechanism of Tumor Cell Lysate Combined with IL-2 Preventing Melanoma and Inhibiting Tumor Growth
- 肿瘤防治研究, 2021, 48(2): 115-120
- Cancer Research on Prevention and Treatment, 2021, 48(2): 115-120
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0606
- 收稿日期: 2020-06-04
- 修回日期: 2020-11-05
2. 200233 上海,上海交通大学附属第六人民医院超声医学科
2. Department of Ultrasound Medicine, The Sixth People's Hospital Affiliated to Shanghai Jiao Tong University, Shanghai 200233, China
近年来,免疫治疗是肿瘤领域发展最为迅速的治疗手段之一,其本质依赖于激活患者自身的免疫系统来对抗肿瘤。肿瘤疫苗是将肿瘤抗原以多种形式导入患者体内,诱导机体产生针对抗原的细胞免疫及体液免疫,并能形成长期的免疫记忆,从而达到控制或预防肿瘤的目的[1]。
黑色素瘤是一种恶性程度很高的肿瘤,容易发生侵袭转移,预后差[2],同时黑色素瘤也是一种免疫原性较强的肿瘤[3],免疫治疗的出现在提高黑色素瘤的疗效上具有突出的优势,尤其是免疫系统被激发后往往能获得长期疗效及远期记忆,因此以肿瘤疫苗为代表的免疫治疗在黑色素瘤的预防及治疗中具有良好的应用前景。
肿瘤细胞裂解物(tumor cell lysate, TCL)疫苗是通过超声、反复冻融、机械匀浆或蛋白分解酶等方法将肿瘤细胞裂解制备而得。由于TCL中含有大量肿瘤细胞内的抗原及蛋白质,可诱发机体的免疫反应,产生抗肿瘤作用[4-5],所以TCL疫苗成为近年来抗肿瘤免疫治疗方面的研究热点。既往研究表明TCL可诱导多种免疫细胞活化,如T淋巴细胞、树突状细胞、单核细胞等[6],但单纯的TCL疫苗免疫原性低,仅能激发机体产生低水平的免疫应答,因此良好的TCL疫苗需搭配合适的佐剂以增强疫苗疗效。本研究采用超声破碎仪获得B16F10黑色素瘤细胞TCL,联合IL-2为佐剂,制备了一种新型的肿瘤疫苗(TCL+IL-2),拟探讨该肿瘤疫苗在小鼠黑色素瘤模型中的预防和治疗作用及潜在机制。
1 材料与方法 1.1 试剂、实验动物与细胞株及仪器细胞培养用胎牛血清、DMEM培养基、PBS购自美国Gibco公司;青霉素/链霉素购自美国Mediatech公司;实验用重组IL-2购自美国R & D公司;抗凝用肝素及锥虫蓝染液购自北京索莱宝科技有限公司;抗CD4、抗CD8、抗CD3、抗CD45流式抗体、红细胞裂解液及FACS Verse流式细胞仪购自美国BD Biosciences公司;抗CD4、抗CD8免疫组织化学抗体购自北京中杉金桥生物技术有限公司。C57BL/6纯系小鼠,雌性,6~8周龄,由北京华阜康生物科技有限公司提供;小鼠黑色素瘤B16F10细胞株为中国医学科学院肿瘤医院肿瘤研究所实验室保存。JY96-II超声破碎仪购自宁波新芝生物科技股份有限公司;YA0941细胞过滤筛购自北京索莱宝科技有限公司。该研究通过中国医学科学院肿瘤医院肿瘤研究所动物实验伦理审批,符合动物试验委员会制订的伦理学标准,注册号:NCC2019A196。
1.2 实验方法 1.2.1 细胞培养将B16F10细胞冻存管从液氮中取出,37℃水浴锅中快速融化,10 cm细胞培养皿中加入9 ml含10%胎牛血清的DMEM培养基+1%青霉素/链霉素混匀,无菌条件下迅速将溶化后的细胞悬液转入细胞培养皿中并混匀,于细胞培养箱中37℃、5%CO2培养。
1.2.2 B16F10-TCL及TCL+IL-2疫苗的制备取对数生长期B16F10细胞用胰酶37℃消化2 min后,收集全部培养基。1 000 r/min离心3 min,弃上清液。用无菌PBS将细胞浓度调整为5×106个/毫升,于2只健康的C57BL/6小鼠右侧腋部皮下接种,每只100 μl。14天后脱颈法处死小鼠,于无菌条件下剥离肿瘤组织,去除坏死的部分,无菌冲洗,并于滤网中研磨收集细胞悬液于10 ml离心管中,1 000 r/min离心5 min。用无菌PBS将细胞浓度调整为1×108个/毫升,分装至2 ml离心管中。采用超声破碎仪裂解肿瘤细胞,超声条件Φ20变幅杆,工作6 s、停5 s,共3 min,离心管置于装有碎冰的烧杯中,防止超声过程中温度过高。超声结束后利用锥虫蓝染色明确细胞是否完全裂解。准备实验用IL-2,使用ddH2O稀释至105 u/ml备用。取1.5 ml EP管,分别加入50 μl TCL(由5×106个细胞裂解得)及50 μl IL-2(含5000 u),混匀后即可使用。
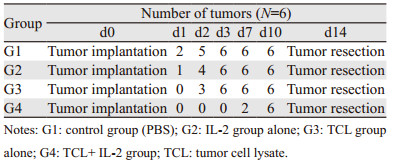
1.2.3 预防性免疫流程重新准备24只雌性C57BL/6小鼠,随机分为4组,每组6只,分别为对照组(G1)、单纯IL-2组(G2)、单纯TCL组(G3)、TCL+IL-2疫苗组(G4)。分别于-21d、-14d、-7d左侧腋部皮下注射,共免疫3次。G1组注射100 μl无菌PBS,G2组注射50 μl IL-2+50 μl无菌PBS,G3组注射50 μl TCL+50 μl无菌PBS,G4组注射50 μl TCL+50 μl IL-2。免疫后密切监测小鼠接种部位的局部改变及全身情况。
1.2.4 免疫后小鼠对侧皮下植瘤最后一次免疫结束后1周(d0),在小鼠右侧腋部皮下接种B16F10肿瘤细胞悬液100 μl(含1×106 B16F10细胞)。植瘤后注意记录肿瘤的出瘤时间(以右侧腋下出现可触及结节为准),出瘤后每3天测量一次,并记录肿瘤体积的变化,体积测量采用游标卡尺测量肿瘤的最长径a(cm)和最短径b(cm),计算体积V=1/2(a×b2)。出瘤后2周脱颈法处死小鼠,肿瘤组织剥离,记录各组小鼠肿瘤的质量。
1.2.5 流式细胞术检测按照免疫前(-22d)、免疫中(-11d)、植瘤前(0d)、出瘤后(7d)、处死前(14d)的时间,我们分别对每组3只小鼠行眼眶后静脉丛取血,每次取100 μl于肝素抗凝管中。100 μl全血使用2 ml红细胞裂解液裂解5 min后,1 000 r/min离心5 min,弃上清并用PBS+10%FBS清洗3次,后用抗CD3、抗CD4、抗CD45及抗CD8避光染色20 min,PBS+10%FBS清洗1次后上机检测外周血CD4+T细胞及CD8+T细胞。d14处死小鼠后我们同时摘取小鼠脾脏,去除脂肪组织,充分研磨并用红细胞裂解液裂解,后用流式细胞术抗体避光染色并上机检测脾脏中CD4+T及CD8+T细胞的表达。所有流式细胞术结果采用FlowJo软件进行分析。
1.2.6 肿瘤组织免疫组织化学染色小鼠肿瘤组织取出后,用4%多聚甲醛固定,后予石蜡包埋,制片,切片后进行肿瘤组织抗CD4、抗CD8免疫组织化学染色,明确肿瘤组织中CD4+T细胞及CD8+T细胞。每只小鼠的肿瘤组织共切片6张行免疫组织化学染色,光学显微镜下每张切片取5个视野(×200)拍照,并用ImageJ软件计算染色的IOD值。
1.3 统计学方法所有实验均独立重复3次。采用GraphPad Prism 7.0软件进行统计分析,计量资料以x±s表示,两组间比较采用t检验。P < 0.05为差异有统计学意义。
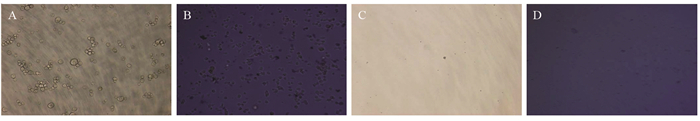
2 结果 2.1 肿瘤细胞裂解物的活性验证取小鼠皮下移植瘤研磨为单细胞悬液,采用超声破碎仪对肿瘤细胞进行裂解,锥虫蓝染色明确肿瘤细胞的裂解情况。无论是光学显微镜下观察或是锥虫蓝染色的结果,超声作用后均无完整的细胞形态,无活细胞存留,见图 1。
|
| A: B16F10 melanoma cells under light microscope; B: performance under light microscope after ultrasonic disruption; C: results of trypan blue staining before ultrasound disruption; D: results of trypan blue staining after ultrasound disruption. 图 1 超声破碎仪制备TCL的活性验证(×40) Figure 1 Activity verification of TCL prepared by ultrasonic disruptor (×40) |
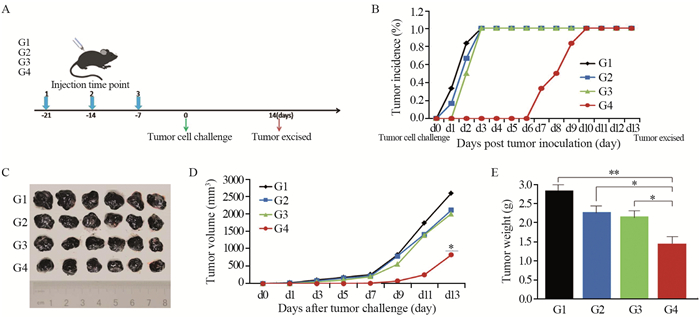
对四组健康的C57BL/6小鼠进行干预,预防性免疫流程见图 2A。各组小鼠免疫后局部无明显不良反应,小鼠全身状态良好,各组差异无统计学意义。植瘤后G1、G2及G3组小鼠首先出瘤,但G4组至植瘤后第7天才有小鼠出瘤,见表 1。通过对出瘤情况的统计可见,G4组疫苗作用后明显推迟了小鼠的出瘤时间(P=0.034),见图 2B;且G4组的平均肿瘤体积(821.13±1.2)小于其他三组(G1: 2591.95±1.0, P=0.023; G2: 2007.18±1.5, P=0.031; G3: 1899.92±1.4, P=0.029),见图 2C~D。瘤重结果提示G4组的肿瘤质量明显小于G1组(1.44±0.2 vs. 2.82±1.3, P=0.0015),见图 2E。
|
| A: immunity flow chart; B: tumor emergence rate of mice in each group; C: tumor in each group after resection; D: changes in tumor volume in each group (x±s, n=6); E: tumor weight in each group (x±s, n=6); *: P < 0.05, **: P < 0.01. 图 2 小鼠进行预防性免疫干预后的出瘤情况 Figure 2 Tumor development in each group after preventive immune intervention |
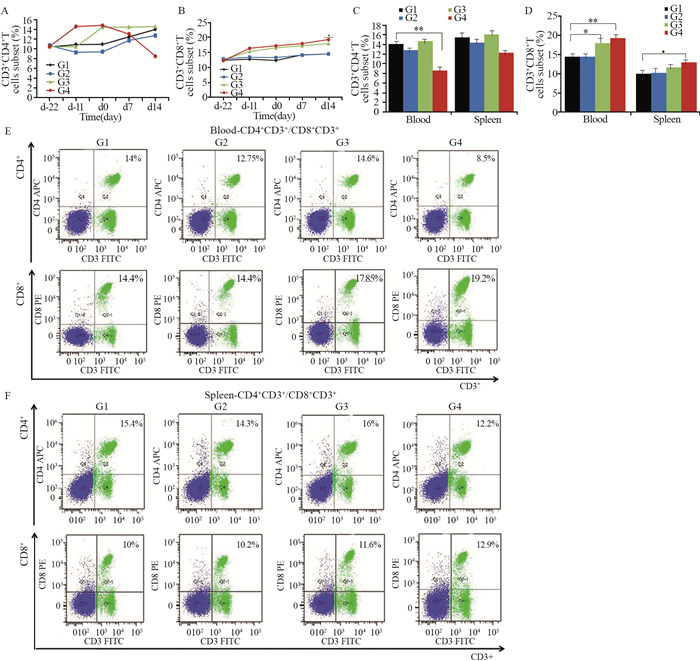
动态监测小鼠外周血CD4+T细胞和CD8+T细胞的变化结果提示,免疫后各组CD4+T细胞均有上升,但G4组的CD4+T细胞在植瘤后有所下降,见图 3A,G1:(11.74±1.0)%; G2:(10.77±1.2)%; G3:(12.89±1.4)%; G4:(10.24±1.9)%。G4组CD8+T细胞较G1组及G2组均有上升((16.54±1.0)% vs. G1组: (13.14±1.1)%, P=0.015; G2组: (13.55±1.4)%, P=0.020),见图 3B。此外我们对脾脏中CD4+T细胞、CD8+T细胞及同一天的外周血中CD4+T、CD8+T细胞的表达进行了对比。结果提示外周血与脾脏的表达结果趋势大致相同,外周血中G4组CD4+T细胞较G1组明显下降((8.45±0.4)% vs.(14.03±0.2)%, P=0.0089),而G4组及G3组CD8+T细胞(G4:(19.21±0.2)%; G3:(17.85±0.4)%)表达较G1组(14.42±0.1)%均上升,且G4组上升更加明显(P=0.0016)。脾脏流式细胞术结果提示G4组CD8+T细胞表达较G1组上升((12.94±0.2)% vs.(10.01±0.1)%, P=0.018),见图 3C~F。
|
| A: dynamic changes of CD4+ T cells expression in peripheral blood (x±s, n=3); B: dynamic changes of CD8+T cells expression in peripheral blood (x±s, n=3); C-F: expression of CD4+T and CD8+T cells in blood and spleen at the same time (x±s, n=3); *: P < 0.05, **: P < 0.01. 图 3 外周血及脾脏流式细胞术指标变化 Figure 3 Changes of CD4+ T and CD8+ T cells in peripheral blood and spleen |
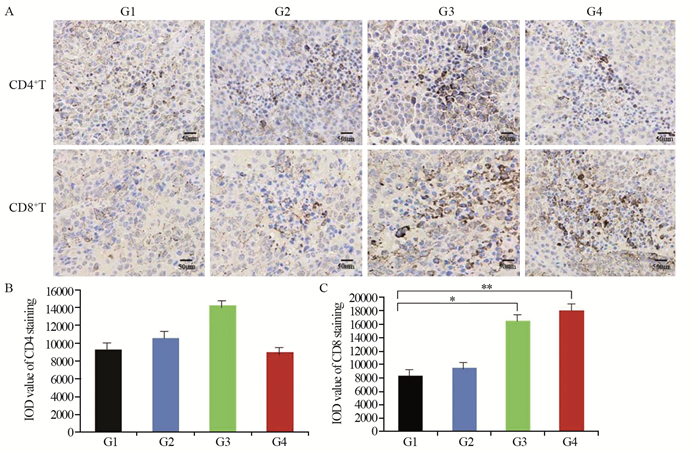
G4组肿瘤组织中CD4+T细胞较其他组减低,而CD8+T细胞在G4组肿瘤组织中明显上升(P=0.0078),同时G3组CD8+T细胞也较对照组增加(P=0.032),见图 4。
|
| A: immunohistochemical staining of CD4+ T and CD8+ T cells in tumor tissues in four groups; B: IOD value of CD4 staining in each group; C: IOD value of CD8 staining in each group; *: P < 0.05, **: P < 0.01. 图 4 肿瘤组织中免疫指标的变化(×200) Figure 4 Changes of CD4+ T and CD8+ T cells in tumor tissues (×200) |
随着对免疫学及肿瘤发病机制的逐步深入探讨,肿瘤免疫治疗成为当前最值得期待的研究领域之一。肿瘤疫苗作为免疫治疗的重要组成部分之一,近年来迅速成长,在基础研究和临床研究领域均获得诸多优秀的成果。例如既往基础研究证实名为Algenpantucel-L的肿瘤疫苗可以利用排斥反应来增强抗原呈递细胞对肿瘤特异性抗原的摄取,并迁移到区域淋巴结以激活CD4+T和CD8+T细胞。该疫苗的Ⅱ期临床研究针对接受了R0或R1手术切除后胰腺癌患者,Algenpantucel-L治疗组的中位和1年无病生存期分别为21月和62%,1年总生存期为86%[7],目前该研究的Ⅲ期临床正在招募中(NCT03165188)。此外,也有诸多应用于黑色素瘤的肿瘤疫苗得到验证和发展[8-9]。TCL疫苗作为肿瘤疫苗的主要类型之一,在黑色素瘤的临床前及临床研究中的成果并不十分理想,因此TCL疫苗在黑色素瘤领域中的应用仍有较大的探索空间。
本研究发现小鼠黑色素瘤TCL疫苗,以IL-2为佐剂,两者的联合不仅具有预防小鼠黑色素瘤发生的潜力,还可以维持机体长时间的免疫反应来抑制肿瘤生长。IL-2是最早被证明的可以激活T细胞增长的细胞因子之一,是肿瘤疫苗的良好佐剂之选。既往研究证实低剂量IL-2和肿瘤疫苗联用时将有效增强免疫原性,激发抗肿瘤作用,同时有效避免了大剂量的不良反应[10]。但另有研究发现,低剂量IL-2(< 1000U)单独使用可能还存在损害宿主抗肿瘤的免疫力,促进肿瘤生长[11-12]。本研究在制定研究计划时,结合既往的研究结果,最终证实IL-2应用5 000 u/次皮下注射,小鼠并未出现严重不良反应,单纯IL-2组的小鼠也未出现明显的肿瘤增长。同时低剂量IL-2联合TCL疫苗达到有效激活抗肿瘤免疫的目的,为低剂量IL-2在肿瘤免疫治疗领域的应用提供了新的可能。
肿瘤疫苗可以激发强烈的免疫反应导致肿瘤缓解,既往研究发现可能与CD8+T细胞有关,因为肿瘤细胞几乎不表达这类MHCⅡ类分子[13]。但迄今为止肿瘤疫苗的作用机制仍无定论,可能的原因包括肿瘤本身会产生免疫抑制信号,可以下调MHCⅠ类分子[14-15]。既往大量研究证实抗原特异性CD4+T细胞可促进肿瘤特异性CD8+T细胞扩增,增强CD8+T细胞在肿瘤中的募集和浸润,帮助克服肿瘤微环境中的免疫抑制反应,发挥抗肿瘤作用[16-17]。但也有研究发现CD4+T细胞仅是在诱发CD8+T细胞增殖最初的所需[18],而CD8+T真正发挥细胞毒性作用时并不需要CD4+T细胞的支持,其辅助功能可能已被激活识别受体提供的信号所取代,例如Toll样受体等[19-20]。因此肿瘤疫苗在引起细胞毒性杀伤作用并抑制肿瘤生长的过程中,CD4+T细胞承担的“角色”值得深入探讨。本研究通过对小鼠外周血CD4+T细胞与CD8+ T细胞的动态监测,发现CD8+T细胞在TCL+IL-2组有明显上升,单纯TCL组也高于单纯IL-2组及对照组。但CD4+ T细胞在各组有所不同,植瘤前各组均有上升,但植瘤后TCL+IL-2组的CD4+T细胞较其他三组下降。由此我们猜测TCL+IL-2疫苗发挥作用的过程中,CD4+T细胞只是在免疫初期辅助了CD8+T细胞的增殖,而当后期CD8+T细胞产生细胞毒性杀伤功能时,CD4+T细胞已不再发挥作用。此外,我们对小鼠脾及肿瘤组织中CD4+T细胞及CD8+T细胞也进行了检测,其结果与外周血中的变化趋势基本一致。由此可见CD8+T细胞的免疫作用是小鼠黑色素瘤TCL+IL-2疫苗发挥预防性免疫及抑瘤作用的主要途径。本研究目前在机制探索方面的工作仍不够,后期还需更加深入的探索来进一步证实。
综上所述,本研究对TCL联合IL-2疫苗在小鼠黑色素瘤中的作用进行探讨,结果发现TCL联合IL-2通过激活CD8+T细胞途径预防黑色素瘤发生,并且有效的抑制肿瘤生长,为黑色素瘤免疫治疗提供了新的研究方向。
作者贡献:
司怡然、岳健:实施实验及撰写文章
刘朝阳、李茉:数据统计分析、校对文章
郑元义:对课题思路提出建议及指导文章写作
王小兵:实验设计、提出文章思路
袁芃:提供基金支助及文章写作指导
| [1] |
Lichtenstern CR, Ngu RK, Shalapour S, et al. Immunotherapy, Inflammation and Colorectal Cancer[J]. Cells, 2020, 9(3): 618. DOI:10.3390/cells9030618 |
| [2] |
Wakabayashi R, Sakuragi M, Kozaka S, et al. Solid-in-oil peptide nanocarriers for transcutaneous cancer vaccine delivery against melanoma[J]. Mol Pharm, 2018, 15(3): 955-961. DOI:10.1021/acs.molpharmaceut.7b00894 |
| [3] |
Gilley RP, Dube PH. Checkpoint blockade inhibitors enhances the effectiveness of a Listeria monocytogenes-based melanoma vaccine[J]. Oncotarget, 2020, 11(7): 740-754. DOI:10.18632/oncotarget.27490 |
| [4] |
Belderbos RA, Baas P, Berardi R, et al. A multicenter, randomized, phase Ⅱ/Ⅲ study dendritic cells loaded with allogeneic tumor cell lysate (MesoPher) in subjects with mesothelioma as maintenance therapy after chemotherapy: DENdritic cell Immunotherapy for Mesothelioma (DENIM) trial[J]. Transl Lung Cancer Res, 2019, 8(3): 280-285. DOI:10.21037/tlcr.2019.05.05 |
| [5] |
Martínez-Torres AC, Calvillo-Rodríguez KM, Uscanga-Palomeque AC, et al. PKHB1 Tumor Cell Lysate Induces Antitumor Immune System Stimulation and Tumor Regression in Syngeneic Mice with Tumoral T Lymphoblasts[J]. J Oncol, 2019, 2019: 9852361. |
| [6] |
Xing X, Zou Z, He C, et al. Enhanced antitumor effect of cytotoxic T lymphocytes induced by dendritic cells pulsed with colorectal cancer cell lysate expressing α-Gal epitopes[J]. Oncol Lett, 2019, 18(1): 864-871. |
| [7] |
Coveler AL, Rossi GR, Vahanian NN, et al. Algenpantucel-L immunotherapy in pancreatic adenocarcinoma[J]. Immunotherapy, 2016, 8(2): 117-125. DOI:10.2217/imt.15.113 |
| [8] |
Gilley RP, Dube PH. Checkpoint blockade inhibitors enhances the effectiveness of a Listeria monocytogenes-based melanoma vaccine[J]. Oncotarget, 2020, 11(7): 740-754. DOI:10.18632/oncotarget.27490 |
| [9] |
Remic T, Sersa G, Ursic K, et al. Development of Tumor Cell-Based Vaccine with IL-12 Gene Electrotransfer as Adjuvant[J]. Vaccines (Basel), 2020, 28(1): 111. |
| [10] |
Mitra S, Leonard WJ. Biology of IL-2 and its therapeutic modulation: Mechanisms and strategies[J]. J Leukoc Biol, 2018, 103(4): 643-655. DOI:10.1002/JLB.2RI0717-278R |
| [11] |
Zloza A, Dharmadhikari ND, Huelsmann EJ, et al. Low-dose interleukin-2 impairs host anti-tumor immunity and inhibits therapeutic responses in a mouse model of melanoma[J]. Cancer Immunol Immunother, 2017, 66(1): 9-16. DOI:10.1007/s00262-016-1916-4 |
| [12] |
Arenas-Ramirez N, Zou C, Popp S, et al. Improved cancer immunotherapy by a CD25-mimobody conferring selectivity to human interleukin-2[J]. Sci Transl Med, 2016, 8(367): 367ra166. DOI:10.1126/scitranslmed.aag3187 |
| [13] |
Zanetti M. Tapping CD4 T cells for cancer immunotherapy: the choice of personalized genomics[J]. J Immunol, 2015, 194(5): 2049-2056. DOI:10.4049/jimmunol.1402669 |
| [14] |
Laidlaw BJ, Craft JE, Kaech SM. The multifaceted role of CD4(+) T cells in CD8(+) T cell memory[J]. Nat Rev Immunol, 2016, 16(2): 102-111. DOI:10.1038/nri.2015.10 |
| [15] |
Provine NM, Larocca RA, Aid M, et al. Immediate dysfunction of vaccine-elicited CD8+ T cells primed in the absence of CD4+ T cell[J]. J Immunol, 2016, 197(5): 1809-1822. DOI:10.4049/jimmunol.1600591 |
| [16] |
Knocke S, Fleischmann-Mundt B, Saborowski M, et al. Tailored tumor immunogenicity reveals regulation of CD4 and CD8 T cell responses against cancer[J]. Cell Rep, 2016, 17(9): 2234-2246. DOI:10.1016/j.celrep.2016.10.086 |
| [17] |
Xiao H, Peng Y, Hong Y, et al. Lentivector prime and vaccinia virus vector boost generate high-quality CD8 memory T cells and prevent autochthonous mouse melanoma[J]. J Immunol, 2011, 187(4): 1788-1796. DOI:10.4049/jimmunol.1101138 |
| [18] |
Janssen EM, Lemmens EE, Wolfe T, et al. CD4+ T cells are required for secondary expansion and memory in CD8+ T lymphocytes[J]. Nature, 2003, 421(6925): 852-856. DOI:10.1038/nature01441 |
| [19] |
Côté AL, Byrne KT, Steinberg SM, et al. Protective CD8 memory T cell responses to mouse melanoma are generated in the absence of CD4 T cell help[J]. PLoS One, 2011, 6(10): e26491. DOI:10.1371/journal.pone.0026491 |
| [20] |
Ahrends T, Spanjaard A, Pilzecker B, et al. CD4(+) T cell help confers a cytotoxic T cell effector program including coinhibitory receptor downregulation and increased tissue invasiveness[J]. Immunity, 2017, 47(5): 848-861. DOI:10.1016/j.immuni.2017.10.009 |
 2021, Vol. 48
2021, Vol. 48