文章信息
- MiR-128-3p靶向抑制HOXA5调控多形性胶质母细胞瘤的增殖、侵袭与凋亡
- MiR-128-3p Regulates Proliferation, Migration and Apoptosis of Glioblastoma Multiforme by Targeting HOXA5
- 肿瘤防治研究, 2021, 48(1): 12-18
- Cancer Research on Prevention and Treatment, 2021, 48(1): 12-18
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0595
- 收稿日期: 2020-06-01
- 修回日期: 2020-09-08
2. 050000 石家庄,河北医科大学第二医院全科医学科
2. Department of General Practice, The Second Hospital of Hebei Medical University, Shijiazhuang 050000, China
多形性胶质母细胞瘤(glioblastoma multiforme, GBM)是人类胶质瘤中最常见、恶性程度最高的一种亚型,尽管目前放化疗技术已取得巨大进展,但目前全世界GBM患者2年生存率仍不超过10%,总体生存时间仍然很短,严重威胁人类健康[1]。目前研究对于GBM发生与进展有关基因的研究已成为当今热点。同源异型盒基因家族是与人类肿瘤关系密切的基因家族之一。HOXA5已被证实在GBM中呈显著高表达并且可促进GBM细胞的增殖与侵袭[2],但其在GBM中过表达的原因目前尚不明确,本研究从microRNA角度入手,就HOXA5在GBM中过表达的机制进行探讨。
1 材料与方法 1.1 临床资料收集2018年1月—2019年12月于河北医科大学第二医院手术治疗的GBM患者肿瘤标本共30例,其中男19例、女11例,年龄42~68岁,平均年龄50.3±2.98岁,每例肿瘤标本均由两名经验丰富的病理医师核实并诊断为GBM(根据WHO 2007年标准),收集同期30例重度颅脑创伤患者去骨瓣减压术中的正常脑组织标本作为对照。本研究人体标本及动物实验均获本院伦理委员会批准,患者均知情同意。
1.2 试剂与仪器实验选购国产的HyClone DMEM/High-Glucose培养基,10%特级胎牛血清及双抗购自美国Gibco公司,HOXA5及GAPDH抗体购于英国Abcam公司,miR-128-3p及GAPDH的引物是由北京Invitrogen公司合成,Dual-Luciferase® Reporter试剂盒购自普洛麦格(北京)生物技术有限公司。主要设备与仪器包括Applied Biosystems 9700实时荧光定量PCR仪(美国Life Technologies公司),BioTek Synergy HT多功能酶标仪(美国伯腾公司),国产DYCZ-24DN型双垂直电泳仪(中国北京),SDS-聚丙烯酰胺凝胶电泳仪和转膜仪(美国伯乐Bio-Rad公司),光学显微镜和倒置相差显微镜(日本Olympus公司),二氧化碳培养箱(美国Thermo Fisher Scientific公司的Thermo Forma 3111),SW-CJ-IFD净化工作台(苏州苏净集团安泰空气技术公司),精密移液枪(Thermo公司),AP250D-0电子天平(美国Ohaus公司),超纯水仪(英国Ultrabioscience公司),MLS-3020CH高压蒸汽灭菌器(日本SANYO公司)。
1.3 蛋白质免疫印迹法于冰浴中充分研磨组织或细胞同时加入适量的RIPA蛋白裂解液,取蛋白浓度测定试剂盒(BCA, Pierce)测量样品蛋白浓度,根据样品体积与上样缓冲液体积的比值(4:1)计算需要加入的5×上样缓冲液的体积,取封口膜封紧管口,煮沸5 min,分装放置于-20℃保存。在预先制好的12%的聚丙烯酰胺凝胶板的每个孔内加入90 μg的蛋白电泳,按照海绵、滤纸、凝胶、PVDF膜、滤纸、海绵的顺序放好,转膜约1.5 h。取5%脱脂奶粉的TBST缓冲液封闭1 h,加入兔抗人HOXA5多克隆抗体,密封后4℃冰箱过夜。次日添加二抗,避光室温孵育2 h。用1×TBST清洗3次,每次15 min,后于双色红外激光成像系统扫描进行条带显影,最后用Image-Pro Plus 6软件进行灰度定量分析。检测miR-128-3p过表达后HOXA5蛋白的表达水平。每组实验重复3次。取GAPDH作为内参照,计算目的基因条带与内参条带的灰度比值。
1.4 实时荧光定量PCR利用qPCR检测待测样品的miR-128-3p水平,根据miRcute Plus miRNA Detection Kit说明书提取标本总RNA,用紫外分光光度计测定其吸光度,其中OD260/OD280的值在1.6~2.0之间的RNA质量最好,测定RNA浓度,将上述总RNA反转录成cDNA,根据SuperReal PreMix Plus(SYBR Green)试剂盒说明书进行qPCR扩增,取U6作为内参照。引物设计如下:miR-128-3p上游引物: 5’-GACTGCCGAGCGAGCG-3’,下游引物:5’-GACGCCGAGGCACTCTCTCCT-3’; U6上游引物:5’-CTCGCTTCGGCAGCACA-3’,下游引物:5’-AACGCTTCACGAATTTGCGT-3’,每组实验重复3次。
1.5 细胞培养人胶质母细胞瘤细胞株U87购自中国科学院,培养基成分包括10%FBS、100 u/ml青霉素、100 pg/ml链霉素的DMEM高糖培养基,置于37℃、5%CO2的细胞培养箱进行培养,每日于显微镜下观察细胞生长状况,每两日更换培养基一次,于细胞对数生长期进行细胞转染与细胞功能学实验。
1.6 双荧光素酶报告基因实验通过生物信息网站TargetScan、miRbase与miRDB,预测miR-128-3p为可能的上游miRNA及靶向结合序列,构建插入荧光素酶的野生型与突变型HOXA5质粒,并将上述两种质粒分别与miR-128-3p过表达的质粒及对照的空载质粒共转染入293T细胞中,24~48 h内明确转染效果并于转染后48 h收集细胞,根据双荧光素酶检测试剂盒说明书先后测定荧光素酶活性与海肾荧光素酶活性,萤火虫荧光素酶/海肾荧光素酶活性即为报告基因活性。
1.7 miR-128-3p过表达与低表达慢病毒的构建及转染购买由上海吉凯公司构建并合成的miR-128-3p过表达与低表达的带绿色荧光的慢病毒及相应的对照空载慢病毒,当细胞融合率至40%时计算病毒用量,MOI值取4,根据病毒滴度得出相应病毒体积并将其转染至U87细胞系中,同时添加溴化己二甲铵及转染增效试剂辅助慢病毒的转染,转染16 h更换培养基,72 h后荧光显微镜下观察绿色荧光,后收集细胞利用PCR检测miR-128-3p水平以验证转染效果。
1.8 CCK-8、Transwell及流式细胞仪检测细胞周期与凋亡CCK-8实验:将转染后的实验组及对照组细胞种植于96孔板上,每组取4个副孔,细胞密度为4×103/孔,培养基100 μl,放置培养箱孵育,分别于24、36、48、72 h,加入10 μl的CCK-8试剂,加试剂前更换培养基,孵育4 h后利用酶标仪测定吸光度,空白孔内添加100 μl培养基与10 μl的CCK-8试剂。Transwell实验:将转染后细胞种植于24孔板的小室上,细胞密度为每孔1×105,加入100 μl无血清的培养基孵育,小室底部铺纤维连接蛋白膜,小室外加入600 μl血清浓度为30%的培养基,培养箱孵育24 h后,轻轻擦去小室面膜上的细胞后在膜的室外表面添加甲醇固定30 min,结晶紫染色20 min后清水洗涤3遍,置于100倍显微镜下,随机选取6个视野并计数每个视野内的细胞量,计算平均值并拍照。细胞周期流式细胞学分析:两组细胞消化后预冷PBS冲洗后离心,弃上清液后取1 ml的70%酒精固定细胞,添加PI试剂并避光放置10 min后上机检测。细胞凋亡流式细胞学分析:将两组细胞胰酶消化后取预冷的PBS缓慢冲洗两遍,离心后弃上清液,工作液冲悬细胞后依次添加10 μl的7-AAD及5 μl的Annexin V试剂,室温避光15 min后上机。通过上述实验完成拯救实验,验证miR-128-3p通过抑制HOXA5表达进而调控GBM的增殖、侵袭与抗凋亡能力。
1.9 裸鼠成瘤实验于南京常州卡文斯实验动物有限公司购进裸鼠(4周雌鼠)20只,分为两组(每组10只),将miR-128-3p与HOXA5过表达的U87细胞(miR-128-3p+HOXA5)及对照U87细胞(miR-128-3p+Control)分别注射于裸鼠侧背部皮下,每只约注入5×106个细胞,饲养于无菌饲养室,每周测量一次成瘤的长径与短径,饲养6周后宰杀裸鼠取出瘤体,称重并拍照。
1.10 统计学方法所得数据用SPSS17.0统计软件进行处理。计量资料以均数±标准差表示,采用t检验比较两组计量资料,P < 0.05为差异有统计学意义。
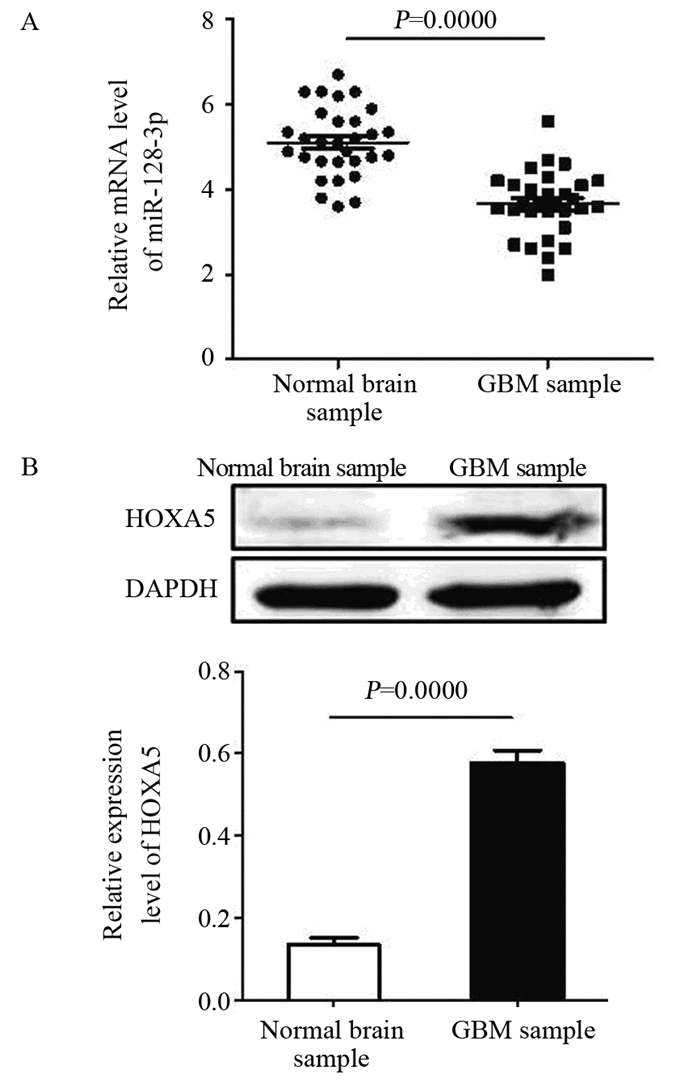
2 结果 2.1 正常脑与GBM组织中HOXA5蛋白与miR-128-3p的表达miR-128-3p在GBM组织中表达水平明显低于正常脑组织(t=7.141, P=0.0000),见图 1A,而HOXA5蛋白在GBM组织中表达水平明显高于正常脑组织(t=12.61, P=0.0000),见图 1B。
|
| GBM: glioblastoma multiforme. 图 1 miR-128-3p(A)与HOXA5(B)在正常脑组织与GBM组织中的表达 Figure 1 Expression of miR-128-3p(A) and HOXA5 protein(B) in normal brain sample and GBM sample |
在U87细胞中分别转染miR-128-3p过表达与低表达的慢病毒,再利用Western blot方法检测HOXA5的表达量,结果表明miR-128-3p过表达的U87细胞系中HOXA5蛋白的表达水平较对照组可显著降低(t=9.015, P=0.0008),见图 2A;miR-128-3p低表达的U87细胞系中HOXA5蛋白的表达水平明显高于对照组(t=8.476, P=0.0011),见图 2B。结果表明U87细胞中miR-128-3p与HOXA5的表达存在显著负相关性。

|
| A: The expression level of HOXA5 in U87 cell lines with miR-128-3p overexpression; B: The expression level of HOXA5 in U87 cell lines with low miR-128-3p expression. 图 2 miR-128-3p与HOXA5在U87细胞系中表达的相关性 Figure 2 Correlation of miR-128-3p and HOXA5 expression in U87 cell lines |
通过查阅生物信息网站得到miR-128-3p与HOXA5潜在的靶向结合位置,并购置HOXA5野生型与突变型的质粒,见图 3A。随后进行双荧光素酶报告基因实验,结果发现HOXA5野生型组的荧光素酶活性显著低于HOXA5突变型组(t=4.214, P=0.0135),见图 3B。结果表明miR-128-3p可靶向结合HOXA5的3’UTR区并抑制HOXA5的表达。

|
| A: the binding site of miR-128-3p and HOXA5, the construction of wild-type and mutant HOXA5 vectors; B: the comparison of luciferase activity among wild-type HOXA5, mutant HOXA5 and control groups. 图 3 miR-128-3p靶向HOXA5的3’UTR区抑制HOXA5的表达 Figure 3 miR-128-3p targeted 3'UTR of HOXA5 and inhibited HOXA5 expression |
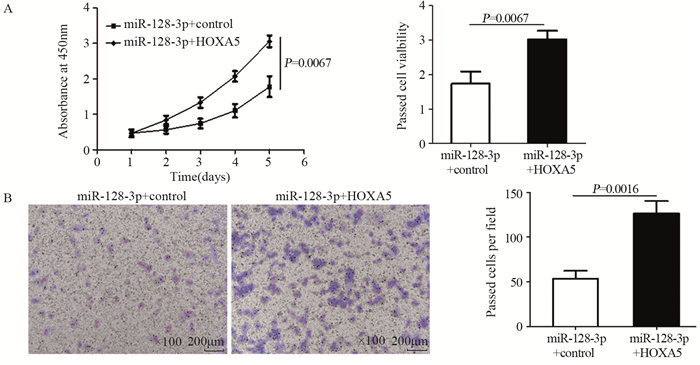
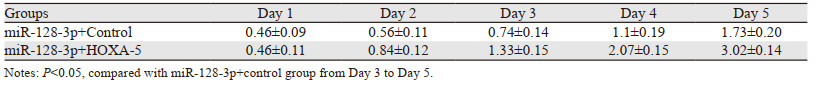
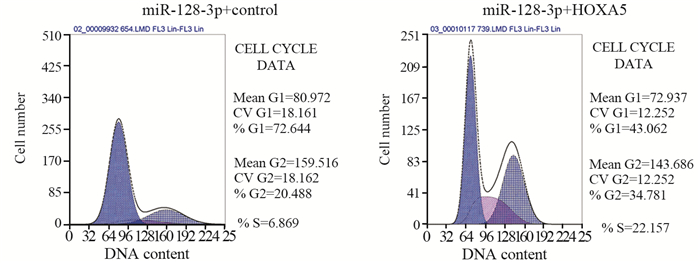
拯救实验发现miR-128-3p+control组比miR-128-3p+HOXA5组细胞增殖能力显著下降(t=5.17, P=0.0067),两组细胞450 nm吸光度值变化曲线及第5天吸光度值比较情况,见图 4A、表 1。miR-128-3p+control组每视野穿过膜的平均细胞数为(53.47±5.03)个,miR-128-3p+HOXA5组每视野穿过膜的平均细胞数为(126.3±8.11)个,结果显示miR-128-3p+control组U87细胞侵袭力明显低于miR-128-3p+HOXA5组(t=7.634, P=0.0016),见图 4B。流式细胞仪结果显示:miR-128-3p+control组中G0/G1期的细胞明显多于miR-128-3p+HOXA5组(t=7.842, P=0.0014),miR-128-3p+control组中处于S期的细胞明显少于miR-128-3p+HOXA5组(t=6.641, P=0.0027),两组细胞周期中G1/G0期与S期分布情况,见图 5;miR-128-3p+control组U87细胞凋亡比例(18.73±1.43)%显著高于miR-128-3p+HOXA5组的(5.2±0.64)%(t=8.615, P=0.0010),见图 6。上述结果证实:miR-128-3p是通过靶向抑制HOXA5的表达来调控胶质瘤母细胞瘤的增殖、侵袭与凋亡。
|
| 图 4 miR-128-3p+Control组与miR-128-3p+HOXA5组细胞增殖(A)与侵袭(B)能力的比较 Figure 4 Proliferation(A) and invasion(B) abilities between miR-128-3p+control group and miR-128-3p+HOXA5 group detected by CCK-8 assay and Transwell assay |
|
|
| 图 5 拯救实验中miR-128-3p+control组与miR-128-3p+HOXA5组细胞周期的比较 Figure 5 Comparison of cell cycles between miR-128-3p+control group and miR-128-3p+HOXA5 group in rescue experiments |
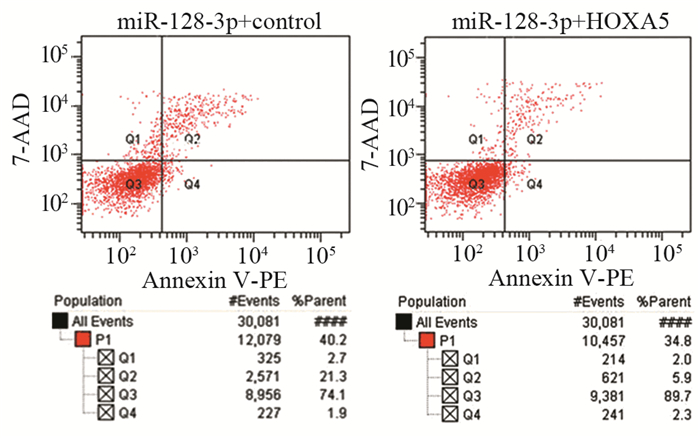
|
| 图 6 拯救实验中miR-128-3p+control组与miR-128-3p+HOXA5组细胞凋亡的比较 Figure 6 Comparison of cell apoptosis between miR-128-3p+control group and miR-128-3p+HOXA5 group in rescue experiments |
裸鼠成瘤实验表明:miR-128-3p+control组裸鼠所成瘤体的体积与重量明显低于miR-128-3p+HOXA5组(t=6.653, P=0.0000; t=7.975, P=0.0000),见图 7。
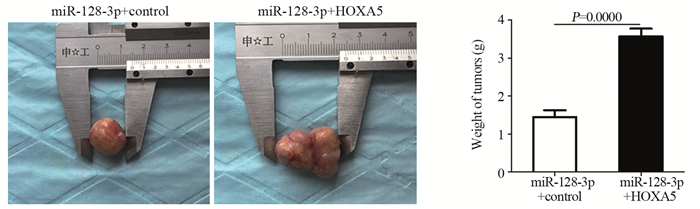
|
| 图 7 拯救实验中miR-128-3p+control组与miR-128-3p+HOXA5组裸鼠成瘤体积与重量的比较 Figure 7 Comparison of tumor volume and weight in nude mice between miR-128-3p+control group and miR-128-3p+HOXA5 group |
HOXA5是同源异型盒基因家族的一员,又称HOX1、HOX1C等,基因位于人类第7号染色体(7p15.2),该基因的异常表达与人类多种肿瘤的发生与进展密切相关,如胃癌、食管癌、肺癌等[3-5]。严小卫等于2012年首次发现HOXA5在胶质瘤细胞中呈显著高表达,并发现HOXA5的表达水平与GBM患者的平均生存期呈明显负相关[6]。本研究利用蛋白免疫印迹法检测GBM组织中的HOXA5蛋白表达水平时发现:相比正常脑组织,HOXA5在GBM组织中表达水平显著升高,此结果与文献报道一致。Li等发现在胶质瘤中HOXA5与CD133密切相关且两者表达水平相互依赖,在CD133低表达时HOXA5的表达会对胶质瘤患者的预后发挥重要影响[7]。刘鹏等通过质粒转染等实验证实HOXA5过表达可显著提高胶质瘤细胞的增殖与侵袭能力[2]。至于HOXA5促进胶质瘤发生与进展的具体机制目前有关文献报道较少,Ma等研究发现HOXA5在胶质瘤中的作用与β-catenin/USP1/EZH2轴的调控和H3K27me3的富集有关[8]。而HOXA5在恶性胶质瘤细胞中呈高表达的原因目前仍不明确。
MicroRNA是人体中与多种生命过程关系密切的一类RNA,一般由约22~25核苷酸构成,可通过与下游基因的3’UTR区结合并抑制下游基因的表达,对人类疾病与肿瘤的发生和进展发挥重要调控作用[9-10]。其中miR-128-3p被发现可抑制人体多种恶性肿瘤细胞的增殖及侵袭,已被公认具有广泛抑癌作用的一个microRNA,如肝细胞癌、乳腺癌、黑色素瘤等[11-13]。此外,Huo等发现miR-128-3p在胶质瘤中呈显著低表达并可通过IRS-1/PI3K/AKT信号通路抑制GBM肿瘤细胞的增殖与分化[14]。本研究发现GBM中miR-128-3p的表达水平明显低于正常脑组织,此结果与上述文献相符。Qu等发现miR-128-3p可靶向抑制PDK1胶质瘤细胞线粒体功能障碍并诱导肿瘤细胞凋亡[15]。通过查询生物信息网站发现miR-128-3p与HOXA5基因3’UTR区具有潜在靶向结合可能,考虑在胶质母细胞瘤中miR-128-3p也极有可能靶向结合HOXA5的3’UTR区进而抑制HOXA5的表达。本研究证实在GBM细胞中miR-128-3p与HOXA5的表达存在负相关性。随后进行了双荧光素酶报告基因实验,结果显示野生型HOXA5组的荧光素酶活性显著低于突变型HOXA5组,表明miR-128-3p可靶向结合HOXA5基因的3’UTR区并抑制HOXA5的表达。为进一步明确miR-128-3p是否可通过靶向抑制HOXA5来抑制GBM肿瘤细胞的增殖、侵袭与抗凋亡能力,本研究通过拯救实验和裸鼠体内实验证实,miR-128-3p可在体内外经靶向抑制HOXA5进而负向调控GBM细胞的增殖、侵袭并促进肿瘤细胞凋亡。利用流式细胞仪检测细胞周期实验发现miR-128-3p经靶向抑制HOXA5表达最终使更多的肿瘤细胞停留至G1期,考虑miR-128-3p、HOXA5可能与具有调控DNA复制功能的某个因子或信号通路关系密切。miR-128-3p在胶质瘤中低表达的原因已被发现与LncRNA PVT1的靶向结合有关[16],仍可能存在某些机制引起miR-128-3p的低表达,miR-128-3p的低表达也可能仅是HOXA5在GBM中高表达的原因之一。故miR-128-3p与HOXA5在GBM中的具体作用机制今后仍需进一步研究。
综上所述,miR-128-3p可靶向抑制HOXA5的表达进而负向调控GBM细胞的增殖、侵袭与抗凋亡能力。本研究从microRNA的角度部分解释了HOXA5在GBM中高表达的原因,同时进一步探索miR-128-3p在GBM中的作用机制。今后将从同源异型盒基因与microRNA的角度进一步探索GBM的发生与进展机制,为GBM基因治疗与靶向治疗提供新的理论依据与思路。
作者贡献
杨吉鹏:实验操作及论文撰写
邱翔:收集标本
李琛、杨建凯:实验操作
刘红江:数据统计
焦保华:实验设计及过程等方面的指导
| [1] |
Bryukhovetskiy I, Pak O, Khotimchenko Y, et al. Personalized therapy and stem cell transplantation for pro-inflammatory modulation of cancer stem cells microenvironment in glioblastoma: Review[J]. Int Rev Neurobiol, 2020, 151: 67-98. DOI:10.1016/bs.irn.2020.03.002 |
| [2] |
刘鹏, 冉雯雯, 吴泽玉, 等. 同源异型盒基因在胶质瘤细胞增殖及迁移侵袭中的作用[J]. 中国老年学杂志, 2015, 35(17): 4790-4792. [Liu P, Ran WW, Wu ZY, et al. The role of homologous box genes in the proliferation, migration and invasion of glioma[J]. Zhongguo Lao Nain Xue Za Zhi, 2015, 35(17): 4790-4792. DOI:10.3969/j.issn.1005-9202.2015.17.024] |
| [3] |
Peng X, Zha L, Chen A, et al. HOXA5 is a tumor suppressor gene that is decreased in gastric cancer[J]. Oncol Rep, 2018, 40(3): 1317-1329. DOI:10.3892/or.2018.6537 |
| [4] |
Zhang H, Zhao JH, Suo ZM. Knockdown of HOXA5 inhibits the tumorigenesis in esophageal squamous cell cancer[J]. Biomed Pharmacother, 2017, 86: 149-154. DOI:10.1016/j.biopha.2016.12.012 |
| [5] |
Zhang ML, Nie FQ, Sun M, et al. HOXA5 indicates poor prognosis and suppresses cell proliferation by regulating p21 expression in non small cell lung cancer[J]. Tumour Biol, 2015, 36(5): 3521-3531. DOI:10.1007/s13277-014-2988-4 |
| [6] |
严小卫, 田强, 张师超. 肿瘤基因图集(TCGA)中恶性胶质瘤数据的挖掘[J]. 广西师范大学学报(自然科学版), 2012, 30(3): 109-112. [Yan XW, Tian Q, Zhang SC, et al. Data mining of malignant glioma from tumor gene atlas (TCGA)[J]. Guangxi Shi Fan Da Xue Xue Bao (Zi Ran Ke Xue Ban), 2012, 30(3): 109-112. DOI:10.3969/j.issn.1001-6600.2012.03.019] |
| [7] |
Li B, McCrudden CM, Yuen HF, et al. CD133 in brain tumor: the prognostic factor[J]. Oncotarget, 2017, 8(7): 11144-11159. DOI:10.18632/oncotarget.14406 |
| [8] |
Ma L, Lin K, Chang G, et al. Aberrant Activation of β-Catenin Signaling Drives Glioma Tumorigenesis via USP1-Mediated Stabilization of EZH2[J]. Cancer Res, 2019, 79(1): 72-85. DOI:10.1158/0008-5472.CAN-18-1304 |
| [9] |
Valera VA, Parra-Medina R, Walter BA, et al. microRNA Expression Profiling in Young Prostate Cancer Patients[J]. J Cancer, 2020, 11(14): 4106-4114. DOI:10.7150/jca.37842 |
| [10] |
Ferreira P, Roela RA, Lopez R, et al. The prognostic role of microRNA in epithelial ovarian cancer: a systematic review of literature with an overall survival meta-analysis[J]. Oncotarget, 2020, 11(12): 1085-1095. DOI:10.18632/oncotarget.27246 |
| [11] |
Guo XL, Wang HB, Yong JK, et al. MiR-128-3p overexpression sensitizes hepatocellular carcinoma cells to sorafenib induced apoptosis through regulating DJ-1[J]. Eur Rev Med Pharmacol Sci, 2018, 22(20): 6667-6677. DOI:10.26355/eurrev_201810_16143 |
| [12] |
Zhao J, Li D, Fang L. MiR-128-3p suppresses breast cancer cellular progression via targeting LIMK1[J]. Biomed Pharmacother, 2019, 115: 108947. DOI:10.1016/j.biopha.2019.108947 |
| [13] |
Zu ML, Piao XL, Gao JM, et al. Monomer Gypenoside LI From Gynostemma Pentaphyllum Inhibits Cell Proliferation and Upregulates Expression of miR-128-3p in Melanoma Cells[J]. J Biochem Mol Toxicol, 2020, 34(5): e22460. DOI:10.1002/jbt.22460 |
| [14] |
Huo L, Wang B, Zheng M, et al. miR-128-3p inhibits glioma cell proliferation and differentiation by targeting NPTX1 through IRS-1/PI3K/AKT signaling pathway[J]. Exp Ther Med, 2019, 17(4): 2921-2930. DOI:10.3892/etm.2019.7284 |
| [15] |
Qu C, Yan C, Cao W, et al. miR-128-3p contributes to mitochondrial dysfunction and induces apoptosis in glioma cells via targeting pyruvate dehydrogenase kinase 1[J]. IUBMB Life, 2020, 72(3): 465-475. DOI:10.1002/iub.2212 |
| [16] |
Fu C, Li D, Zhang X, et al. LncRNA PVT1 Facilitates Tumorigenesis and Progression of Glioma via Regulation of MiR-128-3p/GREM1 Axis and BMP Signaling Pathway[J]. Neurotherapeutics, 2018, 15(4): 1139-1157. DOI:10.1007/s13311-018-0649-9 |
 2021, Vol. 48
2021, Vol. 48


