文章信息
- 光学分子探针FITC-CSPLNTRFC对乳腺癌细胞Bcap-37的特异性和靶向性
- Specificity and Targeting of Optical Molecular Probe FITC-CSPLNTRFC on Breast Cancer Cells Bcap-37
- 肿瘤防治研究, 2021, 48(1): 24-30
- Cancer Research on Prevention and Treatment, 2021, 48(1): 24-30
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0590
- 收稿日期: 2020-06-01
- 修回日期: 2020-10-19
2. 030001 太原,山西医科大学第一医院泌尿外科
2. Department of Urology, The First Affiliated Hospital of Shanxi Medical University, Taiyuan 030001, China
乳腺癌是世界上最常见的癌症之一,也是导致女性癌症死亡的主要原因[1]。研究显示,早期诊断的乳腺癌患者5年存活率可达90%以上,比晚期患者提高约50%,早期诊断仍是改善乳腺癌患者预后的关键[2]。目前乳腺癌早期筛查手段主要有乳腺X线筛查、乳腺自我检查(BSE)和临床乳腺检查(CBE),虽能在一定程度上提高诊断率,但不能及早发现肿瘤细胞在分子水平的改变[3]。基于肿瘤靶向肽的光学分子成像技术,可将肿瘤识别时间窗由组织结构病变提前到生物大分子甚至基因水平的改变,为实现肿瘤的早期精确诊断提供了可能[4-6]。该诊疗策略实施的关键在于研发能够特异性靶向肿瘤细胞及组织的肿瘤靶向肽光学分子探针。
本课题组前期通过体内噬菌体展示技术筛选并获得人乳腺癌Bcap-37细胞特异性结合肽CSPLNTRFC,命名为BCSP1。本实验合成异硫氰酸荧光素(flourescein isothiocyanate, FITC)标记的光学分子探针FITC-BCSP1,并研究其对乳腺癌细胞的特异性和靶向性,为乳腺癌的早期诊断提供帮助。
1 材料与方法 1.1 实验材料 1.1.1 主要试剂与仪器DMEM培养基、RPMI 1640培养基、DMEM/F12培养基、澳洲特级胎牛血清、含EDTA的胰酶细胞消化液、PBS磷酸盐缓冲液、双抗(青-链霉素混合液)、二甲基亚砜(DMSO)、牛血清白蛋白(BSA)、4%多聚甲醛、4, 6-二脒基-2-苯基吲哚二盐酸盐(DAPI)、MTT细胞毒性检测试剂盒均购自西安宝森生物科技有限公司。Matrigel基底膜基质胶购自美国BD公司。细胞超净工作台、二氧化碳培养箱、紫外分光光度仪均购自美国赛默飞世尔科技公司,倒置光学显微镜购自日本奥林巴斯公司,自动酶标仪购自美国Bioteck公司,BD Accuri C6 Plus流式细胞仪购自美国BD公司,XSP-BM13C荧光倒置显微镜购自上海光学仪器厂,赛恩思0010AⅠ型小动物活体成像仪由四川赛恩思仪器有限公司提供。
1.1.2 细胞株与实验动物人乳腺癌细胞株Bcap-37、MDA-MB-231、MCF7及人膀胱癌细胞株EJ、人正常乳腺上皮细胞株MCF-10A均购自上海斯信生物科技有限公司。5~6周龄的BALB/c系雌性裸鼠购自北京维通利华实验动物技术有限公司(许可证:SCXK(京)2016-0006)。
1.2 实验方法 1.2.1 化学合成光学分子探针委托杭州中肽生化有限公司采用固相合成法合成多肽BCSP1(CSPLNTRFC),通过二硫键连接半胱氨酸耦合成环形成环七肽。为减少荧光基团FITC对多肽分子结构的直接影响,将FITC与环七肽链N端之间通过6个碳原子连接,形成FITC标记的光学分子探针(FITC-BCSP1)。按上述方法合成阴性对照探针FITC-svBCSP1。
FITC-BCSP1序列:FITC-C6-Cys-Ser-Pro-Leu-Asn-Thr-Arg-Phe-Cys(Cys & CysBridge);FITC-svBCSP1序列:FITC-C6-Cys-Thr-Pro-Ser-Leu-Phe-Asn-Arg-Cys(Cys & CysBridge)。
阴性对照探针FITC-svBCSP1与靶向肽探针FITC-BCSP1相比,结构和氨基酸种类均相同,仅氨基酸组合顺序不同。通过高效液相色谱法(HPLC)及质谱分析(MS)鉴定所合成探针的纯度。
1.2.2 细胞培养人乳腺癌细胞Bcap-37用DMEM培养基,人正常乳腺上皮细胞MCF-10A用DMEM/F12培养基,人膀胱癌细胞EJ及人乳腺癌细胞MDA-MB-231、MCF7用RPMI 1640培养基,其中均含有10%胎牛血清、1%青-链霉素混合液。将细胞置于37℃、5%CO2的孵箱中培养,待细胞贴壁生长至90%以上时传代。
1.2.3 FITC-BCSP1和FITC-svBCSP1探针的细胞毒性检测将Bcap-37细胞制成1×104/ml的细胞悬液并接种于96孔板中。用去离子水将FITC-BCSP1和FITC-svBCSP1探针分别稀释成浓度为50、100、200、300 μmol/L的溶液。待细胞贴壁后,将96孔板上的细胞分成两组,分别对应两种溶液,每种溶液的每个浓度设3个复孔,另外留出3孔作空白对照。将两种溶液分别加入对应的细胞孔位中,每孔200 μl,空白对照加等量PBS,继续培养12 h。PBS清洗3次,每次1 min,每孔细胞加入20 μl MTT液培养4 h,弃去MTT液,加100 μl DMSO震荡培养至结晶物质溶解。酶标仪检测490 nm处OD值。相对抑制率(IR%)=[1-(OD490实验组/OD490空白对照组)]×100%,三个复孔取均值作为最终结果。判定标准:IR%≤30%为耐药,30%~50%为敏感,50%~70%为中度敏感,IR% > 70%为高度敏感。
1.2.4 流式细胞术检测FITC-BCSP1探针与Bcap-37细胞结合的特异性用去离子水分别将FITC-BCSP1和FITC-svBCSP1稀释成浓度为25 μmol/L的溶液。将人乳腺癌细胞Bcap-37、MDA-MB-231、MCF7、人正常乳腺上皮细胞MCF-10A及人膀胱癌细胞EJ分别制成1×106/ml的细胞悬液,分装于无菌EP管中,每种细胞15管,每管400 μl。实验组:取每种细胞5管,每管加入10 μl FITC-BCSP1探针溶液;对照组:取每种细胞5管,每管加入10 μl FITC-svBCSP1探针溶液;空白组加入等量PBS,室温避光孵育30 min。800 r/min离心5 min,PBS清洗3次。过滤每管细胞,置于流式细胞管中,分别加入200 μl上样缓冲液,用流式细胞仪进行检测。结果分析:统计两种探针标记的阳性细胞所占百分比,计算均值(x±s)。
1.2.5 荧光倒置显微镜术鉴定FITC-BCSP1探针与Bcap-37细胞结合的特异性将Bcap-37细胞悬液以1×104/ml的浓度接种于6孔板中,37℃、5%CO2培养。用去离子水分别将FITC-BCSP1和FITC-svBCSP1稀释成浓度为25 μmol/L的溶液。次日,弃去培养液,用无血清培养基孵育1 h,4%多聚甲醛固定20 min,PBS清洗,2%PBS-BSA封闭1 h。每两孔细胞为一组,共3组。实验组每孔加入10 μl FITC-BCSP1溶液,对照组加等量FITC-svBCSP1溶液,空白组加等量PBS,室温、避光孵育15 min。PBS清洗3次,每次1 min,加入DAPI染液,室温、避光孵育10 min,用荧光倒置显微镜观察。计数:在200倍显微镜下随机取5个视野观察100个细胞并计数荧光细胞,计算阳性细胞百分比=(荧光标记细胞数/100个细胞)×100。
1.2.6 FITC-BCSP1探针的浓度(C)与吸光度(A)值相关性分析将FITC-BCSP1探针分别稀释成浓度为50、100、150、200、250、280、310、340、370、400 μmol/L的溶液各400 μl。用紫外-可见分光光度计在200~800 nm范围内测定不同浓度溶液的紫外吸收光谱(高纯水作为参比溶液),每个浓度测试3次。
1.2.7 FITC-BCSP1探针的光照稳定性分析将FITC-BCSP1探针稀释成最适浓度的溶液装满1.5 ml EP管,置于36℃~38℃的恒温孵育箱中,从多光谱内镜光源输出白光照射EP管。用荧光分子成像仪观察24 h内不同时间点溶液荧光信号强度的变化,并用Image-Pro Plus7.0测量各时间点图像平均灰度值。
1.2.8 Bcap-37细胞荷瘤裸鼠模型的制备选择生长状态良好的Bcap-37细胞,制成浓度为1×107/ml的PBS细胞悬液。4℃环境下,取40 μl细胞悬液混合于160 μl Matrigel基底膜基质胶中,用预冷的1 ml注射器抽取,接种于生长状态良好的裸鼠前肢腋窝部位,每天观察并记录肿瘤长径。
1.2.9 光学分子成像鉴定FITC-BCSP1探针在荷瘤裸鼠模型体内的分布取状态良好、瘤体大小接近的Bcap-37细胞荷瘤裸鼠20只,分成在体实验组和离体实验组。用4%水合氯醛麻醉。通过尾静脉分别注入200 μl上述最适浓度的FITC-BCSP1探针。在体实验组5只:用赛恩思0010AⅠ型小动物活体成像仪,分别对探针注入前及注入后0.5、1、1.5、2、2.5、3、3.5、4、12 h的肿瘤区进行荧光分子成像,确定荧光信号强度最强的时间点。离体实验组15只:分别在探针注入后0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、8、10、12 h,将其中1只处死,分离心、肝、脾、双肾及肿瘤组织并置于背景荧光低不容易反光的黑纸上,用同样的方法对各组织器官进行荧光分子成像,并用仪器自带的Image-Pro Plus7.0测量各图像的平均灰度值。
1.3 统计学方法本研究采用SPSS17.0软件进行统计学分析,计量资料符合正态分布,以均数±标准差(x±s)表示,两组间比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 合成光学分子探针光学分子探针合成后的质量检测结果显示,FITC-BCSP1和FITC-svBCSP1探针分子式为C70H89N15O19S3,分子量1540.8,均可溶于水;通过质谱(MS)和高效液相色谱法(HPLC)鉴定所合成探针的纯度≥98%。
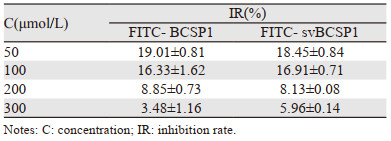
2.2 荧光探针对Bcap-37细胞毒性鉴定结果MTT结果显示,当浓度为50、100、200、300 μmol/L时,FITC-BCSP1及FITC-svBCSP1组细胞的相对抑制率均低于30%,表明二者在50~300 μmol/L浓度内对Bcap-37细胞的增殖及活性无影响,见表 1。
|
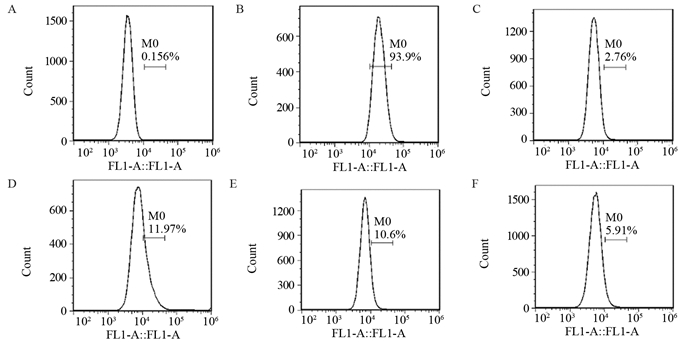
PBS空白对照组阳性细胞百分比为(0.16±0.02)%,将阴性阈值设置为0.18%。同等条件下,Bcap-37细胞中FITC-BCSP1探针标记的细胞百分比明显高于其他细胞,差异均有统计学意义(均P=0.000)。同等条件的Bcap-37细胞中,FITC-BCSP1探针标记的细胞百分比为(94.53±2.26)%,明显高于对照组FITC-svBCSP1探针的(3.89±0.36)%(P=0.000)。说明FITC-BCSP1能与人乳腺癌细胞Bcap-37特异性结合,见表 2、图 1。
|
| A: negative threshold; B: Bcap-37cells; C: MCF-10A cells; D: MDA-MB-231 cells; E: MCF7 cells; F: EJ cells. 图 1 FITC-BCSP1探针与多种细胞结合的流式细胞图 Figure 1 Flow cytometry analysis of combination of FITC-BCSP1 probe and different cells |
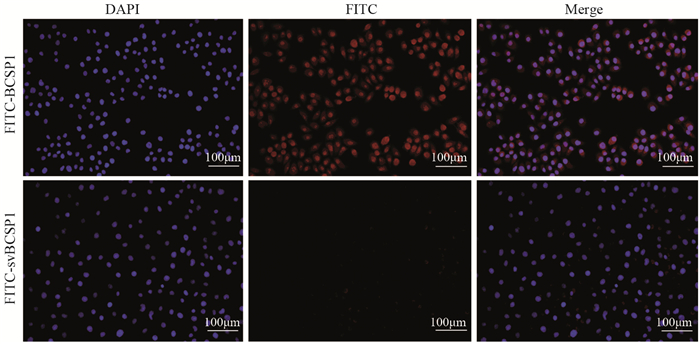
结果显示,FITC-BCSP1组能观察到大量荧光标记的细胞,阳性率为100%,而FITC-svBCSP1组阳性率仅为1%,两组相比差异有统计学意义(P=0.000),FITC-BCSP1探针与乳腺癌Bcap-37细胞结合具有特异性,见图 2。
|
| 图 2 光学分子探针与Bcap-37细胞结合的荧光倒置显微镜成像图 Figure 2 Fluorescence inverted microscope images of combination of optical molecular probes and Bcap-37 cells |
FITC-BCSP1探针在50~280 µmol/L内,A值随浓度的增加而升高,浓度为320~440 µmol/L时,探针的A值基本在0.92±0.03内发生微小变化。探针浓度为280 µmol/L时的A值(1.16±0.02)均高于其他浓度(均P < 0.05),见图 3A。

|
| 图 3 FITC-BCSP1探针吸光度值与浓度的对应关系(A)和最适浓度的光照稳定性(B) Figure 3 Correspondence between absorbance and concentration of FITC-BCSP1 probe(A) and light stability of the optimum concentration(B) |
温度恒定为37±1℃时,白光照射下,浓度为280 µmol/L的FITC-BCSP1探针在24 h内不同时间点荧光分子成像的灰度值始终在66.7±1.0附近变化,说明在37℃下,光照对280 µmol/L的FITC-BCSP1探针稳定性无影响,见图 3B。
2.7 成功建立人乳腺癌Bcap-37细胞荷瘤裸鼠模型致瘤3周后,裸鼠前肢腋窝部逐渐隆起长径0.3~0.5 cm肿瘤,4~5周后瘤体长径可达2~2.5 cm,形状规则近似球形,触之质地均一,无化脓和破损。
2.8 FITC-BCSP1探针在荷瘤裸鼠体内分布的荧光分子成像离体实验组:FITC-BCSP1探针注入后,随着时间的延长,离体肿瘤组织荧光信号强度逐渐增强,3 h时最强(灰度值89.2±1.3),之后开始衰减。3 h时正常组织除胆囊外几乎观察不到荧光信号,肝脏、肾脏、脾脏、心脏荧光成像的灰度值分别为23.6±0.1、32.1±0.1、14.3±0.2、11.8±0.1,而胆囊的灰度值最高98.20,肿瘤组织与正常组织相比,差异有统计学意义(均P < 0.05),见表 3、图 4。

|

|
| 图 4 FITC-BCSP1探针注入荷瘤裸鼠模型体内3h时离体器官及肿瘤组织的荧光分子成像 Figure 4 Fluorescence molecular imaging of in vitro organs and tumor tissues after FITC- BCSP1 probe was injected into tumor-bearing nude mice for 3h |
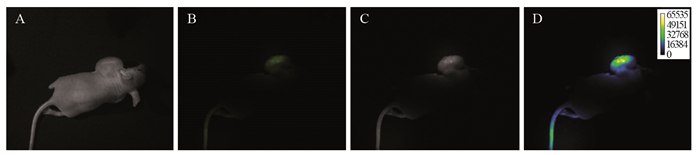
在体实验组:FITC-BCSP1探针注入后,最先观察到尾部注射点附近发出较强荧光。30 min后,移植瘤隆起部位开始发出微弱的荧光。随着时间的延长,尾部荧光信号逐渐减弱,移植瘤区荧光信号逐渐增强,3 h达到峰值(灰度值78.68)。随后出现不同程度的衰减,见图 5。
|
| A: visible light; B: fluorogram; C: gray scale image; D: pseudo-color image. 图 5 FITC-BCSP1探针注入后3h肿瘤区荧光分子成像 Figure 5 Fluorescence molecular imaging of tumor region after FITC-BCSP1 probe was injected into tumor-bearing nude mice for 3h |
光学分子成像技术(optical molecular imaging, OMI)的基本原理是通过一定波长的光波照射生物体内被荧光染料标记的细胞从而产生光学分子影像。OMT近年来的发展对肿瘤的早期诊断治疗有极大的帮助,因为它具有高度特异性和灵敏度,可早期从分子层面对肿瘤细胞的改变进行观察检测。OMI诊疗策略实施的关键在于研发与肿瘤细胞及组织具有较高结合特异性和敏感度的靶向分子,进而展开分子探针及靶向化疗药物载体的开发。Cai等[7]在荷人胶质母细胞瘤小鼠中注射了RGD标记的QD(QD705-RGD),显示了良好的靶向肿瘤血管和血管光学成像。随着新型成像仪器的开发,光学分子探针介导内窥镜检查有望成为肿瘤早期诊断和治疗的新技术。
肿瘤靶向肽能携带荧光素特异性富集在肿瘤组织、细胞,是肿瘤光学分子靶向诊断的重要载体。肿瘤靶向多肽介导的光学分子成像技术对于早期检测肿瘤病灶、提高肿瘤早期诊断率具有重要价值。目前针对黑色素瘤、肝癌、胃癌、结肠癌、胰腺癌、前列腺癌等多种肿瘤有特异亲和力的肽已被筛选出。Feng等[8]利用噬菌体展示技术筛选获得乳腺癌靶向肽CLKADKAKC(CK3),其受体是在乳腺肿瘤中过表达的Neuropilin-1(NRP-1)。以CK3肽为靶向配体的光学分子探针已被证实对乳腺肿瘤的SPECT和NIRF成像有效。研究表明靶向肿瘤新生血管整合素αvβ3受体的RGD靶向肽,与放射性核素或荧光素偶联后可实现对肿瘤组织的特异性光学分子成像[9]。由此发展起来的RGD光学分子影像技术已被应用于乳腺肿瘤的早期诊断研究中[10]。
本研究进行了一系列体外和体内验证试验,为鉴定基于靶向肽BCSP1的光学分子探针对乳腺癌细胞Bcap-37的特异性和靶向性。首先化学合成靶向肽光学分子探针,选择异硫氰酸荧光素(FITC)作荧光指示基团,通过缩合反应与BCSP1分子末端的游离氨基结合成FITC-BCSP1荧光分子探针。同时合成了FITC标记的随机探针FITC-svBCSP1作为阴性对照,其中svBCSP1的结构和氨基酸种类与BCSP1相同,仅氨基酸组合顺序不同。通过体外流式细胞术及荧光倒置显微镜检测,结果显示靶向肽荧光探针FITC-BCSP1能特异性地结合到Bcap-37细胞,而阴性对照探针FITC-svBCSP1与Bcap-37细胞基本不结合。
在荷瘤裸鼠模型体内验证FITC-BCSP1探针的特异性和靶向性,首先要明确荧光探针FITC-BCSP1的最适浓度及稳定性。通过实验探索发现,FITC-BCSP1在浓度为280 µmol/L时所发出荧光强度最大,且在24 h内稳定性不受光照影响。将FITC-BCSP1探针以280 µmol/L的浓度注入Bcap-37细胞荷瘤裸鼠模型体内后,连续监测离体肿瘤组织的荧光信号强度,发现在探针注入后3 h时,离体的肿瘤组织荧光信号强度最高,而同时期的正常组织(肝脏、肾脏、脾脏、心脏)除胆囊外几乎观察不到荧光信号,表明FITC-BCSP1能明显富集在移植瘤组织,说明FITC-BCSP1探针能特异性靶向人乳腺癌Bcap-37细胞异体移植瘤。类似研究表明[11],FITC标记的环七肽主要通过肝脏、胆囊和肾脏代谢,所以胆囊可非特异性富集荧光探针,显示出较强荧光信号。
综上所述,靶向肽光学分子探针FITC-CSPLNTRFC具有良好的乳腺癌细胞特异性和靶向性,为其应用于乳腺癌早期诊断提供了一定理论依据。我们将在后续工作中进一步探索FITC-CSPLNTRFC探针与Bcap-37细胞特异性结合的分子机制,争取早日实现FITC-CSPLNTRFC探针的临床转化,使其真正应用到乳腺癌的早期诊断中。
作者贡献
郭超:设计及实施实验、采集并分析数据、撰写论文
左琪:设计及实施实验、采集并分析数据
杨晓峰:设计及指导实施实验及论文修改
张帆:设计及实施实验、获取研究经费、指导及审阅论文
| [1] |
Nassar FJ, Chamandi G, Tfaily MA, et al. Peripheral Blood-Based Biopsy for Breast Cancer Risk Prediction and Early Detection[J]. Front Med (Lausanne), 2020, 7: 28. DOI:10.3389/fmed.2020.00028 |
| [2] |
陈莉莉, 石菊芳, 刘玉琴, 等. 基于人群的乳腺癌预后参数研究现状[J]. 中华乳腺病杂志(电子版), 2018, 12(6): 370-372. [Chen LL, Shi JF, Liu YQ, et al. Current status of population-based studies on prognostic parameters of breast cancer[J]. Zhonghua Ru Xian Bing Za Zhi(Dian Zi Ban), 2018, 12(6): 370-372. DOI:10.3877/cma.j.issn.1674-0807.2018.06.010] |
| [3] |
Albeshan SM, Hossain SZ, Mackey MG, et al. Can Breast Self-examination and Clinical Breast Examination Along With Increasing Breast Awareness Facilitate Earlier Detection of Breast Cancer in Populations With Advanced Stages at Diagnosis?[J]. Clin Breast Cancer, 2020, 20(3): 194-200. DOI:10.1016/j.clbc.2020.02.001 |
| [4] |
杨晓峰. 光学分子影像学在肿瘤外科应用的前景[J]. 肿瘤防治研究, 2018, 45(6): 357-361. [Yang XF. Comment on Prospect of Optical Molecular Imaging in Oncological Surgery[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(6): 357-361. DOI:10.3971/j.issn.1000-8578.2018.18.0364] |
| [5] |
Lee JYK, Cho SS, Stummer W, et al. Review of clinical trials in intraoperative molecular imaging during cancer surgery[J]. J Biomed Opt, 2019, 24(12): 1-8. DOI:10.1117/1.JBO.24.12.120901 |
| [6] |
Wang C, Wang Z, Zhao T, et al. Optical molecular imaging for tumor detection and image-guided surgery[J]. Biomaterials, 2018, 157: 62-75. DOI:10.1016/j.biomaterials.2017.12.002 |
| [7] |
Cai W, Shin DW, Chen K, et al. Peptide-labeled near-infrared quantum dots for imaging tumor vasculature in living subjects[J]. Nano Lett, 2006, 6(4): 669-676. DOI:10.1021/nl052405t |
| [8] |
Feng GK, Liu RB, Zhang MQ, et al. SPECT and near-infrared fluorescence imaging of breast cancer with a neuropilin-1-targeting peptide[J]. J Control Release, 2014, 192: 236-242. DOI:10.1016/j.jconrel.2014.07.039 |
| [9] |
Lee TY, Lin CT, Kuo SY, et al. Peptide-mediated targeting to tumor blood vessels of lung cancer for drug delivery[J]. Cancer Res, 2007, 67(22): 10958-10965. DOI:10.1158/0008-5472.CAN-07-2233 |
| [10] |
Pirsaheb M, Mohammadi S, Salimi A, et al. Functionalized fluorescent carbon nanostructures for targeted imaging of cancer cells: a review[J]. Mikrochim Acta, 2019, 186(4): 231. DOI:10.1007/s00604-019-3338-4 |
| [11] |
Zhang H, Guo Z, He B, et al. The Improved Delivery to Breast Cancer Based on a Novel Nanocarrier Modified with High-Affinity Peptides Discovered by Phage Display[J]. Adv Healthc Mater, 2018, 7(20): e1800269. DOI:10.1002/adhm.201800269 |
 2021, Vol. 48
2021, Vol. 48



