文章信息
- 拉帕替尼和紫杉醇在食管癌细胞中的抗肿瘤活性及其作用机制
- Synergistic Antitumor Activity and Mechanism of Lapatinib and Paclitaxel in Esophageal Cancer Cells
- 肿瘤防治研究, 2021, 48(1): 19-23
- Cancer Research on Prevention and Treatment, 2021, 48(1): 19-23
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0579
- 收稿日期: 2020-05-28
- 修回日期: 2020-09-30
食管癌是常见的消化道恶性肿瘤,其发病率和死亡率分别居全球恶性肿瘤的第八位和第六位[1]。目前对食管癌的治疗方式主要有手术、放疗和化疗,其5年生存率仍不足20%[2]。人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)和表皮生长因子受体(epidermal growth factor receptor, EGFR)是HER酪氨酸激酶受体家族的主要成员,与细胞的增殖、迁移和侵袭相关[3]。有研究表明在食管癌中EGFR、HER2的共同过表达率高达30%,且与患者的不良预后相关[4-6]。有研究显示,拉帕替尼与临床常用的化疗药物在治疗未接受过化疗的转移性膀胱癌的治疗中发挥协同作用,且拉帕替尼和化疗药物联用,可减少化疗药物的剂量,这是一种潜在的降低毒性的策略[7-8]。多烯紫杉醇,又称紫杉醇,是一种抗微管药物,通过其对微管结构的稳定诱导细胞周期阻滞及凋亡。在临床中单独作用于食管鳞癌的治疗时有效反应率仅为30%左右,故本研究检测拉帕替尼联合紫杉醇在食管癌中是否可以发挥协同抗肿瘤活性及其可能的机制。
1 材料与方法 1.1 细胞及试剂人食管鳞状细胞系EC109购于中国医学科学院基础医学研究所细胞资源中心。RPMI 1640培养基、胰蛋白酶-EDTA、MTT粉末、结晶紫粉末、青霉素和链霉素购于北京索莱宝科技有限公司;侵袭实验的小室购于美国Corning公司;BCA蛋白定量试剂盒、细胞周期检测试剂盒和细胞凋亡检测试剂盒购于江苏碧云天生物技术研究所;兔抗人EGFE(货号2085)、HER2(货号4290)、AKT(货号2920)、p-AKT(货号13038)、β-actin单克隆抗体及辣根过氧化物酶标记的羊抗鼠(货号3700)、兔IgG抗体(货号4870)购于美国CST公司。拉帕替尼(GW572016, 50 mg)购于美国MedChemExpress公司,将拉帕替尼溶于二甲亚砜(DMSO)中,并以10 mmol/L的浓度储存。紫杉醇注射液(5 mg/ml)购于北京双鹭药业股份有限公司,用PBS溶液稀释。
1.2 细胞培养EC109细胞用含有体积分数10%胎牛血清、100 g/L链霉素、100 u/ml青霉素的RPMI 1640培养基中培养,在5%CO2、37℃恒温箱中培养。当细胞密度增长至80%~90%融合时,用0.25%胰酶-EDTA将其消化,离心并传代。
1.3 MTT实验检测细胞活性取对数生长的食管癌细胞EC109,用0.25%胰酶-EDTA消化并计数,按照2 000个/孔的密度接种于96孔板中,培养24 h后,加入拉帕替尼使其终浓度为(1、2、4、8 μmol/L)、加入紫杉醇使其终浓度为(5、10、20、40 μg/L)和联合用药(拉帕替尼1 μmol/L+紫杉醇5 μg/L、拉帕替尼2 μmol/L+紫杉醇10 μg/L、拉帕替尼4 μmol/L+紫杉醇20 μg/L、拉帕替尼8 μmol/L+紫杉醇40 μg/L),每个浓度设置六个平行孔。同时设置无药物处理组及无细胞空白对照组,恒温箱中孵育48 h。每孔加入20 μl MTT溶液(5 mg/ml)继续孵育4 h。弃上清液,每孔加入150 μl DMSO溶液,用酶标仪检测570 nm处的吸光度A值。根据公式计算出不同药物浓度药物处理后细胞的增殖抑制率。
增殖抑制率=(无细胞空白对照组A570值-药物处理组A570值)/(无细胞空白对照组A570值-无药物处理组A570值)×100%。
根据金氏公式计算药物联合指数(q),ABi为两药合用的抑制率,Ai和Bi为两种药单独使用的抑制率,q > 1.15表示两药联合效果强于两药效单纯叠加。联合指数(q)=ABi/[Ai +(1- Ai) × Bi]
1.4 Transwell实验将24孔板和小室放置恒温箱中预热,在24孔板中加入500 μl含20%血清的培养基,无血清培养基悬浮的EC109细胞,以2×104个/皿的密度接种至小室中,在不同处理组中分别加入紫杉醇10 μg/L、拉帕替尼2 μmol/L和两药同时加入,然后置于恒温箱中孵育48 h。取出小室,用棉签轻轻擦掉小室中未穿过的细胞,然后放入含1 ml多聚甲醛的24孔板中,室温固定10 min。再放入含有0.1%结晶紫染色液的24孔板中,染色30 min。然后用PBS清洗,放置显微镜下拍照,每组从上至下选择5个视野拍照。
1.5 细胞周期检测EC109细胞以2×104个/皿的密度接种至6孔板中,在恒温箱中孵育24 h后,弃旧培养液,分别单独加入含有拉帕替尼2 μmol/L、紫杉醇10 μg/L的新鲜培养液2 ml,继续培养48 h。胰酶消化收集细胞,PBS溶液洗涤1遍,加入预冷的70%乙醇固定24 h。PBS溶液洗涤1遍,500 μl碘化丙啶(PI)(50 mg/ml)和RNase(100 mg/ml)重悬细胞,37℃避光染色30 min。采用流式细胞仪检测细胞的荧光值,并计算出G1、S、G2/M期细胞的比率。
1.6 细胞凋亡率检测细胞凋亡试剂盒结合流式细胞术检测拉帕替尼、紫杉醇单独和联用对EC109细胞的凋亡诱导作用。将对数生长期的EC109细胞,以每孔3×105个细胞的密度接种至6孔板中,于恒温箱中孵育24 h后分别加入拉帕替尼2 μmol/L、紫杉醇10 μg/L和联合用药,处理48 h后收集细胞,用PBS洗涤2~3遍。然后每管加入500 μl的Annexin V-FITC结合液重悬细胞,再加入5 μl Annexin V-FITC和10 μl的PI,轻轻混匀后在室温下避光孵育10 min,用流式细胞仪检测。流式凋亡图左上象限(Q1)表示坏死的细胞,右上象限(Q2)表示晚期凋亡细胞,左下象限(Q3)表示正常的细胞,右下象限(Q4)表示早期凋亡细胞,细胞凋亡率为早期凋亡率和晚期凋亡率之和。
1.7 Western blot检测EGFR、HER2及其下游信号通路中关键蛋白的表达拉帕替尼(2 μmol/L)、紫杉醇(10 μg/L)单独及联用处理EC109细胞48 h后,提取细胞中的总蛋白。用BCA蛋白定量取30 μg的蛋白,并配置5%的浓缩胶、15%的分离胶进行SDS-PAGE电泳,将蛋白湿转至PVDF膜上。用1%BSA室温封闭2 h、经过一抗孵育(1:1 000稀释,4℃孵育过夜)、TBST洗涤3次、二抗孵育(1:4 000稀释,室温孵育1 h)、TBST洗涤3次后,在膜上滴加适量化学发光显色液并置于Amersham Imager 600凝胶成像系统中拍照。
1.8 统计学方法采用SPSS21.0进行统计分析。计量资料以(x±s)表示,组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 拉帕替尼、紫杉醇单独及联合使用对EC109细胞的增殖抑制作用拉帕替尼联合紫杉醇组对细胞的增殖抑制率均高于拉帕替尼组和紫杉醇组,且联合用药指数q值均大于1.15,说明拉帕替尼联合紫杉可协同抑制细胞增殖,见图 1。
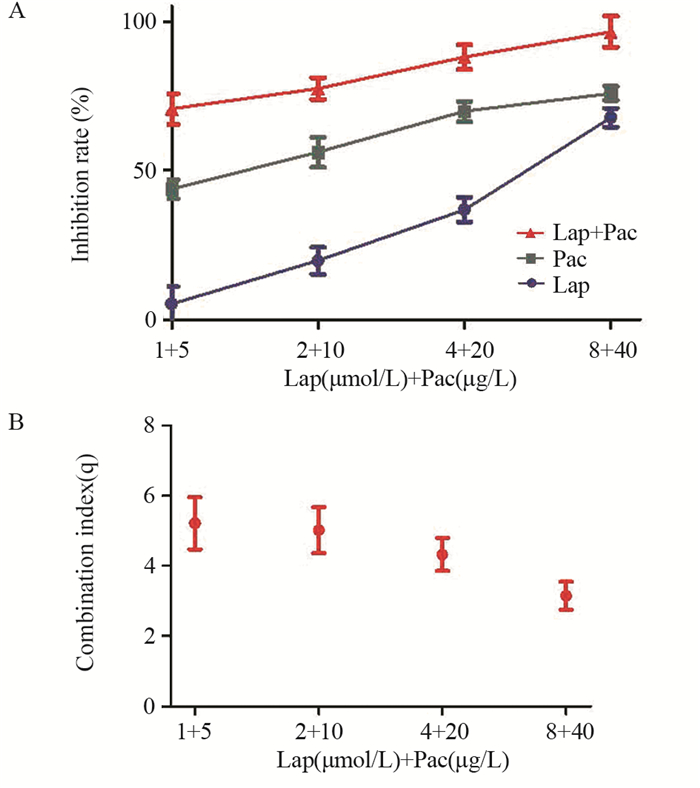
|
| Lap: lapatinib; Pac: paclitaxel; Lap+Pac: lapatinib+paclitaxel. 图 1 拉帕替尼、紫杉醇单独及联合使用对EC109细胞的增殖抑制作用 Figure 1 Inhibitory effect of lapatinib, paclitaxel and their combination on proliferation of EC109 cells |
对照组、拉帕替尼2 μmol/L、紫杉醇10 μg/L单独及联合使用时发生侵袭的细胞数分别为214.5±20.5、152.4±16.1、103.6±12.7、62.0±9.5,四组间发生侵袭的细胞数差异有统计学意义(F=57.241, P < 0.001),且拉帕替尼联合紫杉醇组发生侵袭的细胞数少于拉帕替尼组和紫杉醇组,见图 2。

|
| 图 2 拉帕替尼、紫杉醇单独及联合使用对EC109细胞侵袭的影响 Figure 2 Effect of lapatinib, paclitaxel and their combination on invasion of EC109 cells |
对照组、拉帕替尼组、紫杉醇组和联合处理组G2/M期细胞比率分别为(9.6±1.2)%、(20.3±2.5)%、(26.6±2.8)%和(43.4±3.1)%,四组间G2/M期细胞比率差异有统计学意义(F=15.320, P < 0.001),且拉帕替尼联合紫杉醇组G2/M期细胞比率高于拉帕替尼组和紫杉醇组,见图 3。

|
| 图 3 拉帕替尼、紫杉醇单独及联合使用对EC109细胞周期的影响 Figure 3 Effects of lapatinib, paclitaxel and their combination on cell cycle of EC109 |
对照组、拉帕替尼组、紫杉醇组和联合处理组细胞的凋亡率分别为(5.6±1.2)%、(12.7±2.3)%、(21.4±5.2)%和(47.3±8.4)%。四组之间的凋亡率差异有统计学意义(F=33.612, P < 0.001),且拉帕替尼联合紫杉醇组细胞凋亡率高于拉帕替尼组和紫杉醇组,见图 4。
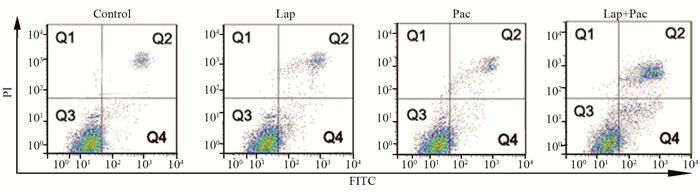
|
| 图 4 拉帕替尼、紫杉醇单独及联合使用对EC109细胞凋亡的影响 Figure 4 Effects of lapatinib, paclitaxel and their combination on apoptosis of EC109 cells |
拉帕替尼为EGFR、HER2的双靶点药物,可减弱磷酸化EGFR、HER2蛋白的表达,而拉帕替尼联合紫杉醇组,对磷酸化EGFR、HER2蛋白的抑制作用增强,单独药物处理组和联合药物处理组对EGFR、HER2蛋白的表达均没影响。另外拉帕替尼和紫杉醇联合处理组与单独药物处理组相比,可明显抑制磷酸化AKT蛋白的表达,见图 5~6。
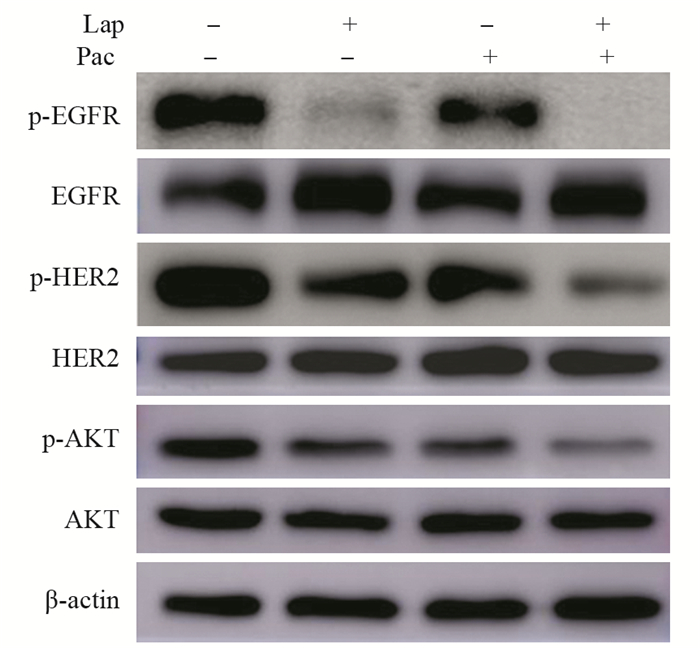
|
| 图 5 拉帕替尼、紫杉醇单独及联合使用对EGFR、HER2及其下游信号通路中关键蛋白AKT表达的影响 Figure 5 Effect of lapatinib, paclitaxel and their combination on expression of key protein AKT in EGFR, HER2 and its downstream signaling pathway |
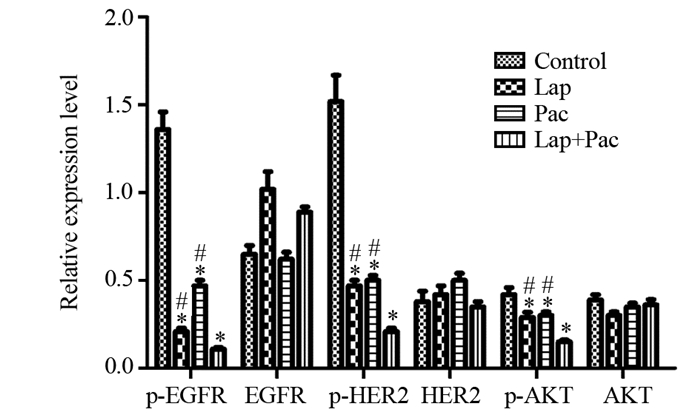
|
| *: P < 0.05, compared with the control group; #: P < 0.05, compared with Lap+Pac group. 图 6 不同组间蛋白灰度值比较 Figure 6 Comparison of protein gray values among different groups |
食管癌是临床上常见的消化道恶性肿瘤之一,由于患者的早期症状不明显或就诊不及时,确诊时大多处于晚期阶段。对于晚期或者有远处转移的患者常采用化疗,临床上常用的化疗药物有紫杉醇和顺铂。有临床数据表明,晚期食管癌患者在接受以铂类为基础的联合化疗药物治疗后表现出明显的不良反应,然而紫杉醇和埃罗替尼联合放疗却取得了良好的治疗效果[9]。因此,对于晚期肿瘤患者的治疗模式从传统的化疗药物转向化疗药物联合靶向药物治疗。靶向药物治疗是近几年的研究热点,抑制血管内皮生长因子的贝伐单抗,与卡培他滨和顺铂联合使用,一线治疗晚期胃癌患者,临床Ⅲ期实验结果表明接受贝伐单抗和化疗药物联合治疗患者的无进展生存期和总生存率高于其他患者[10]。以HER2为靶点的酪氨酸激酶抑制剂曲妥珠单抗(赫赛丁),用于治疗晚期胃癌患者,与化疗药物的联合使用与化疗药物单独使用相比可显著提高患者的总生存率[11]。
拉帕替尼是以EGFR、HER2为双靶点的酪氨酸激酶抑制剂,首次被批准是和卡培他滨联合治疗HER2阳性的晚期乳腺癌患者。随着对药物作用机制的进一步了解,拉帕替尼在结直肠癌、非小细胞肺癌、胃癌、食管癌的临床治疗中也展开了研究[12-15]。本研究主要比较拉帕替尼联合紫杉醇与二者单独使用时对食管癌EC109细胞的增殖、侵袭、周期和凋亡的影响并进一步探讨二者的联合作用机制。拉帕替尼、紫杉醇单独作用EC109细胞时,对其增殖抑制作用均呈剂量依赖性,而这种增殖抑制作用在联合药物处理中表现更加明显。在不同药物浓度联合处理下,联合作用指数q值均 > 1.15,说明拉帕替尼联合紫杉醇可协同抑制EC109细胞的增殖。拉帕替尼联合紫杉醇与单独药物处理组相比,可显著抑制EC109细胞侵袭。周期检测实验结果显示,拉帕替尼联合紫杉醇与单独药物处理组相比,可显著将细胞周期阻滞于G2/M期。拉帕替尼联合紫杉醇对EC109细胞的凋亡诱导作用强于单独药物处理组。经过对EGFR、HER2及其下游主要信号通路PI3K/AKT中关键蛋白AKT的检测,结果显示拉帕替尼联合紫杉醇可协同抑制p-EGFR、p-HER2蛋白的表达,且可抑制PI3K/AKT信号通路的转导。PI3K/AKT信号通路中活化的AKT可调节大量下游介质,参与细胞的存活和代谢过程[16]。
综上所述,EGFR、HER2双靶向药物拉帕替尼联合化疗药物紫杉醇可协同抑制食管癌细胞EC109的增殖、减弱细胞的侵袭能力、阻滞细胞周期于G2/M期、诱导细胞凋亡,以上作用可能与抑制EGFR、HER2及其下游PI3K/AKT信号通路的转导相关。
作者贡献
陈涛:参与实验设计与操作、论文撰写
李雄伟:实验操作和数据统计分析
孙晓东:实验耗材购买和文章校对
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] |
张思维, 郑荣寿, 左婷婷, 等. 中国食管癌死亡状况和生存分析[J]. 中华肿瘤杂志, 2016, 38(9): 709-715. [Zhang SW, Zheng RS, Zuo TT, et al. Mortality and survival analysis of esophageal cancer in China[J]. Zhonghua Zhong Liu Za Zhi, 2016, 38(9): 709-715. DOI:10.3760/cma.j.issn.0253-3766.2016.09.014] |
| [3] |
Holbro T, Civenni G, Hynes NE. The ErbB receptors and their role in cancer progression[J]. Exp Cell Res, 2003, 284(1): 99-110. DOI:10.1016/S0014-4827(02)00099-X |
| [4] |
Gibault L, Metges JP, Conan-Charlet V, et al. Diffuse EGFR staining is associated with reduced overall survival in locally advanced esophageal squamous cell cancer[J]. Br J Cancer, 2005, 93(1): 107-115. DOI:10.1038/sj.bjc.6602625 |
| [5] |
Brien TP, Odze RD, Sheehan CE, et al. Her-2/neu gene amplification by FISH predicts poor survival in Barrett's esophagus-associated adenocarcinoma[J]. Hum Pathol, 2000, 31(1): 35-39. DOI:10.1016/S0046-8177(00)80195-1 |
| [6] |
Reddy D, Wainberg ZA. Targeted therapies for metastatic esophagogastric cancer[J]. Curr Treat Options Oncol, 2011, 12(1): 46-60. DOI:10.1007/s11864-011-0138-4 |
| [7] |
McHugh LA, Kriajevska M, Mellon JK, et al. Combined treatment of bladder cancer cell lines with lapatinib and varying chemotherapy regimens--evidence of schedule-dependent synergy[J]. Urology, 2007, 69(2): 390-394. DOI:10.1016/j.urology.2006.12.003 |
| [8] |
豆巧华, 郭晓芳, 朱小飞, 等. 拉帕替尼联合顺铂抗食管鳞癌的作用及机制[J]. 肿瘤防治研究, 2019, 46(9): 766-772. [Dou QH, Guo XF, Zhu XF, et al. Antitumor efficacy and mechanisms of lapatinib in combination with cisplatin on esophageal squamous cancer cells[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(9): 766-772. DOI:10.3971/j.issn.1000-8578.2019.19.0150] |
| [9] |
Zhao C, Lin L, Liu J, et al. A phase Ⅱ study of concurrent chemoradiotherapy and erlotinib for inoperable esophageal squamous cell carcinoma[J]. Oncotarget, 2016, 7(35): 57310-57316. DOI:10.18632/oncotarget.9809 |
| [10] |
Ohtsu A, Shah MA, Van Cutsem E, et al. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a randomized, double-blind, placebocontrolled phase Ⅲ study[J]. J Clin Oncol, 2011, 29(30): 3968-3976. DOI:10.1200/JCO.2011.36.2236 |
| [11] |
Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial[J]. Lancet, 2010, 376(9742): 687-697. DOI:10.1016/S0140-6736(10)61121-X |
| [12] |
Sartore-Bianchi A, Trusolino L, Martino C, et al. Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial[J]. Lancet Oncol, 2016, 17(6): 738-746. DOI:10.1016/S1470-2045(16)00150-9 |
| [13] |
LaBonte MJ, Yang D, Zhang W, et al. A Phase Ⅱ Biomarker-Embedded Study of Lapatinib plus Capecitabine as First-line Therapy in Patients with Advanced or Metastatic Gastric Cancer[J]. Mol Cancer Ther, 2016, 15(9): 2251-2258. DOI:10.1158/1535-7163.MCT-15-0908 |
| [14] |
Christodoulou C, Kalogera-Fountzila A, Karavasilis V, et al. Lapatinib with whole brain radiotherapy in patients with brain metastases from breast and non-small cell lung cancer: a phase Ⅱstudy of the Hellenic Cooperative Oncology Group (HeCOG)[J]. J Neurooncol, 2017, 134(2): 443-451. DOI:10.1007/s11060-017-2548-z |
| [15] |
Shepard G, Arrowsmith ER, Murphy P, et al. A Phase Ⅱ Study with Lead-In Safety Cohort of 5-Fluorouracil, Oxaliplatin, and Lapatinib in Combination with Radiation Therapy as Neoadjuvant Treatment for Patients with Localized HER2-Positive Esophagogastric Adenocarcinomas[J]. Oncologist, 2017, 22(10): 1152. DOI:10.1634/theoncologist.2017-0186 |
| [16] |
Cheaib B, Auguste A, Leafy A. The P13K/Akt/mTOR pathway in ovarian cancer therapeutic opportunities and challenges[J]. Chin J Cancer, 2015, 34(1): 4-16. DOI:10.5732/cjc.014.10289 |
 2021, Vol. 48
2021, Vol. 48
