文章信息
- 基于血管生成拟态相关分子MIG-7的四肢骨肉瘤预后分析及风险预测模型构建
- Prognostic Analysis and Risk Prediction Model Establishment of Extremity Osteosarcoma Based on Vasculogenic Mimicry-related Molecule MIG-7
- 肿瘤防治研究, 2021, 48(1): 31-37
- Cancer Research on Prevention and Treatment, 2021, 48(1): 31-37
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0521
- 收稿日期: 2020-05-18
- 修回日期: 2020-11-03
2. 210028 南京,南京中医药大学附属中西医结合医院转化医学实验室;
3. 210028 南京,江苏省中医药研究院转化医学实验室;
4. 210002 南京,东部战区总医院骨科(南京大学医学院金陵医院骨科)
2. Laboratory of Translational Medicine, Affiliated Hospital of Integrated Traditional Chinese and Western Medicine, Nanjing University of Chinese Medicine, Nanjing 210028, China;
3. Laboratory of Translational Medicine, Jiangsu Province Academy of Traditional Chinese Medicine, Nanjing 210028, China;
4. Department of Orthopedics, Jinling Hospital, Nanjing University, School of Medicine, Nanjing 210002, China
骨肉瘤是青少年最常见的原发性恶性骨肿瘤,预后差[1]。近30年来骨肉瘤综合治疗成效显著,但不少患者仍死于肺转移。所以探寻骨肉瘤侵袭转移机制有助于揭示新的治疗靶点。一些高侵袭性恶性肿瘤中存在血管生成拟态(vasculogenic mimicry, VM)即肿瘤细胞通过自身变形模仿血管壁结构,形成输送血液的管道系统,建立特殊的肿瘤微循环,并可与内皮依赖性血管相互独立或协同提供肿瘤的灌注和播散[2]。研究显示,VM与多种恶性肿瘤的进展和预后不良密切相关[2]。我们发现,骨肉瘤存在VM结构并与生存时间和转移关系密切[3]。
迁移诱导基因-7(migration inducing gene-7, MIG-7)的蛋白产物位于多种肿瘤细胞的细胞膜和细胞质[4],局部侵袭或体循环中远处播散的肿瘤细胞表达尤其强烈;相反,取自健康人群的25种组织标本均未检测到MIG-7表达[5]。我们则在小样本水平观察到骨肉瘤组织中存在MIG-7阳性表达[3]。近期研究还发现MIG-7在多种肿瘤的VM形成和转移中发挥重要作用[4]。然而,MIG-7对于人骨肉瘤的转移、预后以及VM形成究竟有无影响,尚缺少大样本临床研究。
因此,我们拟在较大样本水平考察MIG-7与四肢骨肉瘤患者VM水平及临床病理特征之间的关系,并分析MIG-7和VM对骨肉瘤预后的影响,初步探讨MIG-7在骨肉瘤发生发展中可能的作用。
1 资料与方法 1.1 组织标本与临床资料收集2000年12月—2016年12月东南大学附属中大医院和东部战区总医院收治的156例经病理确诊的原发性骨肉瘤活检标本。纳入标准:(1)组织学亚型为普通型;(2)原发灶位于四肢骨;(3)美国癌症联合会(American Joint Committee on Cancer, AJCC)分期为Ⅱ期;(4)具备化疗前的组织学观测活检标本;(5)治疗方案为新辅助化疗-根治性手术-辅助化疗,并完成了整个治疗过程。化疗方案如下:第一周期氨甲喋呤(MTX),剂量8~12 g/m2,6 h静滴,8~12 h后甲酰四氢叶酸钙(calcium folinate, CF)解救。第二周期阿霉素(ADM)+顺铂(DDP);ADM剂量60~90 mg/m2,分3天输入;DDP剂量120~150 mg/m2,第1天给药。第三周期异环磷酰胺(IFO),剂量15 g/m2,分5天输入。3周期为一疗程。术前2个疗程,术后8个疗程。各周期之间及相邻两疗程均间隔两周。手术与术前第2疗程以及术后第1疗程也均间隔两周。所有患者的剂量强度均按照体表面积严格计算。排除标准:(1)继发性骨肉瘤;(2)初诊前已有放疗或化疗史;(3)源发于中轴骨骼和骨外组织的骨肉瘤;(4)骨旁骨肉瘤和骨膜骨肉瘤等其他组织学亚型;(5)因剂量不足或给药延迟等原因而影响剂量强度的患者未被纳入本研究;(6)随访期间失访者。
通过病案、门诊和电话方式,收集患者临床病理特征。根据MIG-7分子的表达水平、VM情况、化疗效果及其他若干临床病理特征等暴露因素对患者分组。随访时间截至2019年12月31日。自确诊至死亡的时间定义为总生存时间(overall survival time, OS),自手术至发生转移的时间为无转移生存时间(metastasis-free survival time, MFS)。
1.2 主要试剂兔抗人MIG-7多克隆抗体购自中国北京Bioss公司;兔抗人CD31多克隆抗体购自美国Santa Cruz公司;Periodic acid-Schiff(PAS)染色试剂盒购自美国Sigma-Aldrich公司;EnvisionTM试剂盒购自丹麦Dako公司。
1.3 实验方法 1.3.1 免疫组织化学染色及判定标准石蜡标本4 µm厚切片脱蜡至水,微波热修复,加MIG-7一抗,4℃过夜。根据试剂盒要求滴加相应的试剂,孵育显色。免疫组织化学染色评分标准参照已有文献[3],0~2分为阴性,3~6分为阳性表达。
1.3.2 CD31/PAS双重染色及VM判定标准石蜡切片加抗人CD31一抗,DAB显色,0.5%过碘酸中还原8 min,再于雪夫氏液中反应15 min,0.5%偏重亚硫酸钠液滴洗,苏木精对比染色,最后予分化、返蓝、脱水透明及封片。VM定性标准:CD31/PAS双重染色可见VM内壁呈PAS阳性而CD31阴性,其内含红细胞,其外为肿瘤细胞,并排除坏死、出血及炎性细胞浸润[6]。
1.4 统计学方法采用SPSS(version 17)和R(version 3.2.1)软件进行统计分析和模型构建。计数资料采用χ2检验,计量资料行t检验,生存时间采用Kaplan-Meier法,各因素间比较用Log rank分析。P < 0.05为差异有统计学意义。
1.4.1 独立预后因素的计算为寻找独立预后因素,首先进行单因素生存分析,得出有统计学意义的危险因素。然后在SPSS软件中完成多因素生存分析,对所有单因素生存分析得出的危险因素采用基于最大偏似然估计的向后逐步回归法进行自变量筛选,再纳入Cox比例风险模型分析独立预后因素;然后重新将上述单因素生存分析得出的危险因素纳入全变量Cox比例风险回归方程,再次计算独立预后因素。
1.4.2 风险预测模型的构建为构建风险预测模型,在R软件中加载nomogram()函数和cph()函数,建立3年和5年的生存概率预测列线图,命令每个变量的分值最大为10。最后调用相关函数进行验证,计算一致性指数(index of concordance, C-index)评价模型的预测能力;并绘制校准曲线。
2 结果 2.1 四肢骨肉瘤中MIG-7的表达及其与临床病理参数的关系156例患者中男92例(59.0%)、女64例(41.0%);年龄5~56岁,中位年龄18.2岁。随访时间6~160月,中位随访时间55.0月;5年总生存率为52.7%。92例(59.0%)MIG-7阳性、64例(41.0%)阴性,染色部位主要在肿瘤细胞的细胞质,部分细胞膜亦有染色,见图 1A~B。一些病例可见MIG-7阳性的肿瘤细胞构成VM管壁,内含红细胞,且VM管壁的肿瘤细胞染色稍深于其他区域的肿瘤细胞,见图 1C。CD31/PAS双重染色进一步证实这些病例中瘤细胞构成了CD31-/PAS+的管道结构,且管腔内存在红细胞,符合VM判定标准,见图 1D。正常松质骨标本和阴性对照均未见MIG-7表达,见图 1E。

|
| A: MIG-7 was expressed in 59.0% (92/156) of osteosarcoma cells. Tumor cells exhibited cytoplasmic and sometimes membranous immunoreactivity for MIG-7; B: negative MIG-7 immunohistochemical staining was observed in 64 osteosarcoma patients; C: the osteosarcoma cells lining the VM channel (black arrows) were positive for MIG-7. RBCs were observed in these VM channels; D: CD31/PAS double staining of VM channel (black arrows). The thin wall of the VM channel was positive for PAS staining, whereas tumor cells lining the external wall were negative for CD31 staining. There were translucent RBCs in the channel (blue arrows). The picture also showed CD31 positive endothelium-dependent vessels (red arrows), some of which contained RBCs (green arrows) as well; E: no MIG-7 immunohistochemical staining was observed in normal bone tissues. 图 1 骨肉瘤组织中MIG-7的表达以及血管生成拟态CD31/PAS双重染色情况(×400) Figure 1 Representative images of immunohistochemical staining for MIG-7 expression and CD31/PAS double staining for vasculogenic mimicry in osteosarcoma tissues (×400) |
统计分析显示,MIG-7与患者的性别、年龄、AJCC ⅡA/ⅡB期、肿瘤部位、术式(保肢/截肢)、术前化疗的肿瘤坏死率等临床病理参数均无相关性,但MIG-7阳性患者的VM存在率高于MIG-7阴性患者,33.7%(31/92)vs. 12.5%(8/64),P=0.003,提示MIG-7与VM之间显著相关,见表 1。
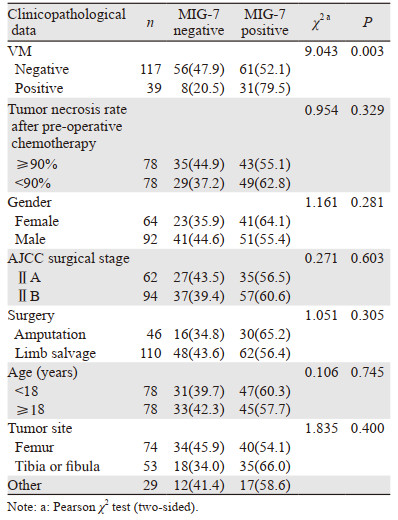
|
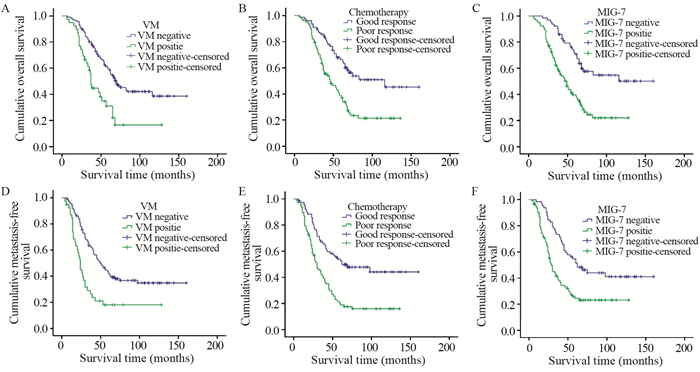
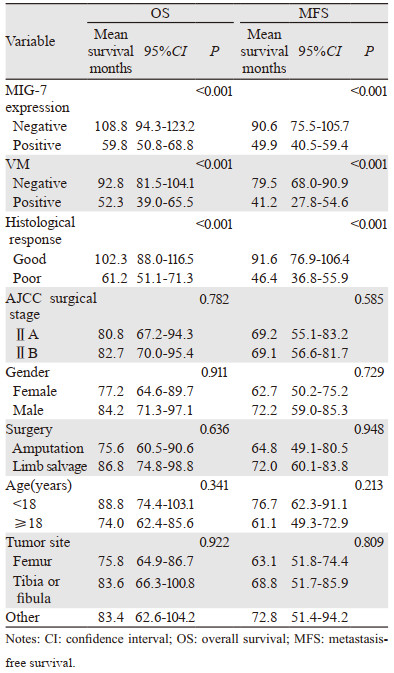
MIG-7(-)组平均OS为108.8月,平均MFS为90.2月,5年总生存率为70.8%,5年无转移生存率为54.6%;MIG-7(+)组平均OS为59.8月,平均MFS为49.9月,5年总生存率为39.7%,5年无转移生存率为24.4%。Kaplan-Meier单因素生存分析显示MIG-7的阳性表达与OS和MFS显著相关。Log rank成对比较显示,MIG-7(+)组的OS和MFS均明显短于MIG-7(-)组(P < 0.001)。VM(-)组平均OS为92.8月,平均MFS为79.5月;VM(+)组平均OS为52.3月,平均MFS为41.2月。Kaplan-Meier单因素生存分析显示VM(+)组OS和MFS均明显短于VM(-)组(P < 0.001),见图 2。
|
| 图 2 MIG-7表达情况、VM水平及术前化疗效果不同的各组患者总生存时间和无转移生存时间的Kaplan-Meier单因素分析 Figure 2 Kaplan-Meier analysis of overall survival and metastasis-free survival of osteosarcoma patients with different levels of MIG-7 expression, VM and histological responses to pre-operative chemotherapy |
Kaplan-Meier单因素分析还显示,术前化疗效果对患者的OS和MFS亦有显著影响,见图 2,但其他临床病理特征与患者生存期及转移均无关,见表 2。
|
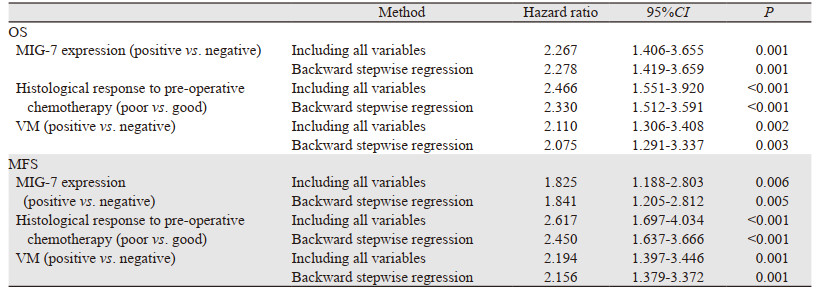
将上述单因素生存分析得出的三个危险因素(MIG-7表达情况、VM水平和术前化疗效果)作为多因素生存分析的自变量直接纳入全变量Cox比例风险回归方程,或者经基于最大偏似然估计的向后逐步回归法筛选之后再纳入Cox比例风险回归方程,均得出同样结论:MIG-7表达情况、VM水平和术前化疗效果是预测四肢骨肉瘤患者生存时间和转移时间的独立预后因素,见表 3。
|
根据Cox比例风险回归模型结果,建立基于MIG-7表达情况、VM水平和术前化疗效果的列线图模型,用于预测3年和5年总体生存概率及无转移生存概率。各变量不同取值对应的评分,将各变量评分相加得到总评分,总评分投射在3年和5年生存概率轴上的点即为个体患者对应的生存概率,见图 3。

|
| A: 3-and 5-year overall survival; B: 3-and 5-year metastasis-free survival 图 3 预测AJCCⅡ期四肢骨肉瘤患者总生存期和无转移生存期的列线图 Figure 3 Prognostic nomogram for prediction of AJCC stage Ⅱ extremity osteosarcoma patients |
一致性指数(C指数)本质上是估计预测结果与实际观察结果相一致的概率。我们得到OS的C指数为0.716±0.047,MFS的C指数为0.707±0.041,提示该模型准确度尚可。
进一步绘制校准曲线,进行一致性测试。患者3年和5年的总生存率和无转移生存率的校准曲线均比较靠近对角线,显示预测列线图与实际观察的生存概率有较好的一致性,见图 4。
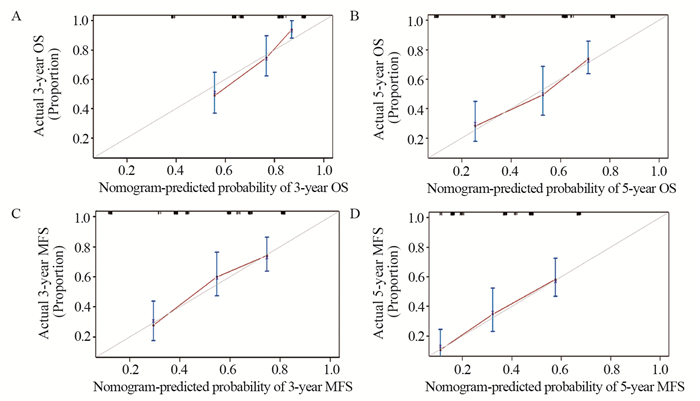
|
| 图 4 列线图模型预测患者累积生存率的校准曲线 Figure 4 Calibration curves for assessing consistency between predicted and actual postoperative survival rates |
长期以来,骨肉瘤缺乏有效的预后指标和治疗靶点,而VM的发现为肿瘤精准诊疗提供了一类潜在的观察指标和治疗靶点[2-3]。MIG-7是肿瘤细胞膜和细胞质中一种富含半胱氨酸的蛋白,可促进肿瘤细胞的迁移和重排,在多种恶性肿瘤的VM活动中发挥至关重要的作用[4, 7]。基因敲除或特异性抗体抑制MIG-7功能后,肿瘤细胞的趋化和侵袭能力明显减弱[5]。因此我们认为MIG-7是肿瘤细胞侵袭性表型的重要标志,并可能作为肿瘤治疗的潜在特异靶点。
本研究发现骨肉瘤中MIG-7染色主要位于细胞质和细胞膜,与其他肿瘤相似;约60%的AJCCⅡ期患者表达MIG-7,而正常骨组织则不表达。单因素生存分析显示,MIG-7表达水平与四肢骨肉瘤患者的总生存时间和无转移生存时间密切相关,MIG-7阳性者生存时间短,转移发生早。提示MIG-7在骨肉瘤的病程进展中发挥重要作用。而且,Cox比例风险模型进一步显示MIG-7表达水平是独立预后因素之一。因此,考虑MIG-7表达水平可能具备鉴别高危骨肉瘤患者的潜在价值。
实体肿瘤的增殖和转移依赖于新生血供,新生脉管为肿瘤提供新陈代谢所需的氧气和营养,也为肿瘤远处转移提供了通路[8],而VM仅有肿瘤细胞围成管腔,不含内皮细胞,其管腔结构的不完善使肿瘤细胞更易发生血行转移[7]。EphA2、COX-2和FAK等分子都介导VM形成[9],但这些分子也在内皮细胞、上皮细胞及炎性细胞中表达,参与胚胎发育、伤口愈合及炎性反应等多种生理过程[10]。相比之下,MIG-7不仅促进多种肿瘤VM形成,而且除胚胎滋养层之外的正常组织细胞均不表达MIG-7,所以其VM靶向特异性可能更好[3-5]。研究显示,MIG-7经半胱氨酸开关机制促进了(MT1)-MMP和MMP-2表达。MMP-2通过降解细胞外基质成分促进瘤细胞迁移和侵袭,进而形成VM[11]。另外,(MT1)-MMP和MMP-2通过PI3-K/MMPs/Ln-5γ2通路促发Ln-5γ2链裂解,增加Ln-5γ2链domainⅢ促迁移片段(D Ⅲfragment)的释放,而该片段中的EGF样重复区域可激活EGF受体及其下游信号通路,降低肿瘤细胞与层粘连蛋白附着的能力并导致血管样结构的生成[4, 12]。MIG-7与上述VM介导分子也密切相关。如,EphA2与MIG-7相似,也通过上调肿瘤细胞MT1-MMP增加Ln-5γ2链domain Ⅲ促迁移片段(D Ⅲ fragment)释放,促进VM形成[13]。COX-2/PGE2则经Akt/GSK-3β途径提高MIG-7表达水平,进而上调MT1-MMP和MMP-2表达量,促进肿瘤细胞EMT及迁移、侵袭,最终形成VM[12-13]。所以MIG-7不仅是肿瘤VM的标志分子,还可能作为临床抗VM靶向治疗的潜在靶点。
本研究结果显示,MIG-7阳性的骨肉瘤细胞可以排列成内含红细胞的管腔,且管壁细胞染色稍深于其他区域的肿瘤细胞,CD31/PAS双重染色则证实这些管道属于VM。统计分析显示,MIG-7表达与VM之间存在显著相关关系,而VM水平本身也是骨肉瘤生存时间和转移时间的一个独立预后因素。因此,我们认为MIG-7在人骨肉瘤VM形成中发挥重要作用,并可能由此促进病程进展;同时VM与MIG-7之间也通过相互独立的机制分别促进骨肉瘤的生长和转移,两者对骨肉瘤的预后都有显著影响。
MIG-7与VM的相关关系会引起共线性问题,这可能导致估计值与客观实际不一致,造成单因素分析和多因素分析结果矛盾。主成分分析可以克服共线性干扰,但提取的主成分对原始变量解释能力较弱,求解出的独立因素往往不具有临床意义[14]。另外,该样本不属于高维度、小样本、强相关的生存资料分析,所以也未采用基于LASSO算法的自变量筛选消除共线性,而是选用逐步回归法解决共线性问题[15]。又因为基于Walds统计量的检验未充分考虑各因素的综合作用,所以选用更可靠的基于最大偏似然估计的向后逐步回归筛选方法。逐步回归分析后,再行全变量的Cox比例风险回归分析,两次得出的独立预后因素相同,提示逐步回归未将有意义的变量排除在模型之外。另外,MIG-7与VM分别成为一个独立预后因素,也提示MIG-7还通过VM之外的其他机制促使骨肉瘤进展。
骨肉瘤预后具有异质性,建立精准的个体预后预测模型颇具临床价值。国外学者在Cox回归模型基础上建立了多种肿瘤的生存概率列线图,但国内将列线图用于测算亚洲人种骨肉瘤的生存概率还鲜有报道。我们基于多因素分析结果,选取MIG-7表达情况、VM水平和术前化疗效果三个独立预后因素构建列线图模型,一致性指数在0.7以上,校准曲线显示预测风险与理想预测值接近,表明该列线图预测模型具有较好的区分度与准确性,可以准确快捷的对骨肉瘤预后进行个体化评估预测,也便于针对预后较差的患者进行更积极的随访和辅助治疗。另外,列线图特有的可视化效果还直观显示了各预后因素及其各水平对生存时间的贡献权重[16]。本研究中,三个独立预后因素均为二分类变量,列线图直观显示三个独立预后因素对生存时间的贡献相差不大;相比之下,术前化疗效果对无转移生存期的影响较MIG-7稍大一些。
综上所述,VM及其相关分子MIG-7均与四肢骨肉瘤病情进展密切相关,两者均为骨肉瘤的独立预后因素,可为判断生存期及转移时间提供一定参考。MIG-7可能通过促进VM形成加速病情进展,并可能还通过其他机制影响骨肉瘤预后。使用列线图可以快速精确地对患者预后作出判断,对于制定骨肉瘤个体化诊疗策略颇有意义。又因为骨肉瘤的传统化疗已进入平台期,所以对MIG-7和VM的深入研究不仅有助于揭示骨肉瘤发病机制,也可能为骨肉瘤的精准治疗提供潜在靶点。
作者贡献
任可:研究设计、病例筛选、论文写作
姚楠:组织标本的实验操作
吴苏稼:病例诊治和随访
施鑫:病例诊治
李超:留取和收集标本
陆军:病例诊治、病案资料检索和整理、数据统计分析
| [1] |
Huayllani MT, Restrepo DJ, Boczar D, et al. Osteosarcoma of the Upper Extremities: A National Analysis of the US Population[J]. Anticancer Res, 2019, 39(10): 5663-5668. DOI:10.21873/anticanres.13763 |
| [2] |
Cai H, Liu W, Liu X, et al. Advances and Prospects of Vasculogenic Mimicry in Glioma: A Potential New Therapeutic Target?[J]. Onco Targets Ther, 2020, 13: 4473-4483. DOI:10.2147/OTT.S247855 |
| [3] |
Ren K, Yao N, Wang G, et al. Vasculogenic mimicry: a new prognostic sign of human osteosarcoma[J]. Hum Pathol, 2014, 45(10): 2120-2129. DOI:10.1016/j.humpath.2014.06.013 |
| [4] |
Pan Z, Zhu Q, You W, et al. Silencing of Mig-7 expression inhibits in-vitro invasiveness and vasculogenic mimicry of human glioma U87 Cells[J]. Neuroreport, 2019, 30(17): 1135-1142. DOI:10.1097/WNR.0000000000001317 |
| [5] |
Tapaneeyakorn S, Chantima W, Thepthai C, et al. Production, characterization, and in vitro effects of a novel monoclonal antibody against Mig-7[J]. Biochem Biophys Res Commun, 2016, 475(2): 149-153. DOI:10.1016/j.bbrc.2016.05.062 |
| [6] |
Zhang Z, Imani S, Shasaltaneh MD, et al. The role of vascular mimicry as a biomarker in malignant melanoma: a systematic review and meta-analysis[J]. BMC Cancer, 2019, 19(1): 1134. DOI:10.1186/s12885-019-6350-5 |
| [7] |
Czekierdowski A, Czekierdowska S, Stachowicz N, et al. Mig-7 expression and vasculogenic mimicry in malignant ovarian tumors[J]. Ginekol Pol, 2017, 88(10): 552-561. DOI:10.5603/GP.a2017.0100 |
| [8] |
Li X, Li Y, Lu W, et al. The Tumor Vessel Targeting Strategy: A Double-Edged Sword in Tumor Metastasis[J]. Cells, 2019, 8(12): 1602. DOI:10.3390/cells8121602 |
| [9] |
Kim HS, Won YJ, Shim JH, et al. Role of EphA2-PI3K signaling in vasculogenic mimicry induced by cancer-assiociated fibroblasts in gastric cancer cells[J]. Oncol Lett, 2019, 18(3): 3031-3038. DOI:10.3892/ol.2019.10677 |
| [10] |
Rusell-Puleri S, Dela Paz NG, Adams D, et al. Fluid shear stress induces upregulation of COX-2 and PGI2 release in endothelial cells via a pathway involving PECAM-1, PI3K, FAK, and p38[J]. Am J Physiol Heart Circ Physiol, 2017, 312(3): H485-H500. DOI:10.1152/ajpheart.00035.2016 |
| [11] |
Yang F, Wen M, Pan D, et al. IL-33/ST2 Axis Regulates Vasculogenic Mimicry via ERK1/2-MMP-2/9 Pathway in Melanoma[J]. Dermatology, 2019, 235(3): 225-233. DOI:10.1159/000498857 |
| [12] |
Czekierdowski A, Czekierdowska S, Stachowicz N, et al. Mig-7 expression and vasculogenic mimicry in malignant ovarian tumors[J]. Ginekol Pol, 2017, 88(10): 552-561. DOI:10.5603/GP.a2017.0100 |
| [13] |
Lu XS, Sun W, Ge CY, et al. Contribution of the PI3K/MMPs/Ln-5γ2 and EphA2/FAK/Paxillin signaling pathways to tumor growth and vasculogenic mimicry of gallbladder carcinomas[J]. Int J Oncol, 2013, 42(6): 2103-2115. DOI:10.3892/ijo.2013.1897 |
| [14] |
Zhang Z, Castelló A. Principal components analysis in clinical studies[J]. Ann Transl Med, 2017, 5(17): 351. DOI:10.21037/atm.2017.07.12 |
| [15] |
Ternès N, Rotolo F, Michels S. Empirical extensions of the lasso penalty to reduce the false discovery rate in high-dimensional Cox regression models[J]. Stat Med, 2016, 35(15): 2561-2573. DOI:10.1002/sim.6927 |
| [16] |
Tattersall HL, Callegaro D, Ford SJ, et al. Staging, nomograms and other predictive tools in retroperitoneal soft tissue sarcoma[J]. Chin Clin Oncol, 2018, 7(4): 36. DOI:10.21037/cco.2018.08.01 |
 2021, Vol. 48
2021, Vol. 48


