文章信息
- 基于增强CT构建鉴别肾透明细胞癌ISUP分级的神经网络模型
- A Neural Network Model Based on Enhanced CT for Distinguishing ISUP Grade of Clear Cell Renal Cell Carcinoma
- 肿瘤防治研究, 2021, 48(1): 55-59
- Cancer Research on Prevention and Treatment, 2021, 48(1): 55-59
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0440
- 收稿日期: 2020-04-29
- 修回日期: 2020-08-31
2. 712000 咸阳,陕西中医药大学医学技术学院
2. Department of Medical Technology, Shaanxi University of Chinese Medicine, Xianyang 712000, China
肾细胞癌(renal cell carcinoma, RCC)是成人肾脏最常见的恶性肿瘤。在组织学方面,高级别RCC预后更差[1]。NCCN2018也指出组织分级是RCC患者5年生存率的预后决定因素之一。因此,组织分级对于RCC患者预后评价和治疗方法选择有重要意义。2016年国际泌尿病理协会(ISUP)发布了新的ISUP分级系统用于评价RCC[2]。已有文献报道ISUP分级系统与患者的预后相关[3]。RCC中以肾透明细胞癌(clear cell RCC, ccRCC)最常见,相对其他亚型ccRCC有更差的预后[4]。增强CT是肾肿瘤早期发现及诊断的最常用影像学方法[5],一些CT特征可反映肿瘤的生物学行为,不同级别的ccRCC出现不同的影像特征。神经网络作为非参数化建模的代表,具较强的非线性映射及泛化能力,近年来在医学影像领域表现出巨大潜力。故本研究拟利用神经网络算法及增强CT构建术前预测ccRCC ISUP分级模型,为评价患者的预后提供参考依据。
1 资料与方法 1.1 患者资料本回顾性研究放弃患者知情同意,遵守2013年修订版《赫尔辛基宣言》。收集陕西中医药大学附属医院2014年3月—2019年12月的ccRCC患者。纳入标准:(1)包括中腹部的增强CT扫描完整数据;(2)经手术或穿刺活检病理确诊的ccRCC;(3)临床资料齐全。排除标准:(1)图像质量差、图像分析受影响;(2)CT增强扫描前接受过针对肾癌的治疗。最后共纳入131名患者,其中女性45例、男性86例,平均年龄61.63±11.56岁。采用分层抽样按照5:5比例并随机将患者分为训练集和验证集。
1.2 ccRCC ISUP级别的确定每位ccRCC患者的组织切片经两名有经验的病理科医师根据2016版肾癌ISUP病理分级重新分级。将Ⅰ~Ⅱ级定义为低级别组,Ⅲ~Ⅳ级定义为高级别组。两名医师分级不一致时通过共同商议决定,并以此简化分级作为因变量。
1.3 影像数据采集增强CT扫描采用64排CT扫描仪(GE Discovery CT 750HD,GE医疗),扫描范围为双肾上腺水平至右肾下极水平,视情况适当调整使扫描覆盖整个肿瘤。管电压120 kV,电流为自动毫安技术(噪声指数为10),螺距1.375:1。增强扫描对比剂采用非离子型对比剂碘海醇(300 mgI/ml),采用Ulrich(Ulrich, 德国)高压注射器经右肘前静脉注射对比剂,注射流率为3.5~4.0 ml/s。皮质期、髓质期和排泄期延迟时间分别为35s、70s及90s(排泄期延迟时间根据患者肾功能情况调整)。采用自适应迭建重建算法将扫描数据重建为512×512,层厚为1.25 mm薄层图像用于分析。
1.4 ccRCC增强CT影像特征由两名有经验的腹部影像科医师对每位患者的平扫及增强各期CT图像进行评价,包括肿瘤的位置、大小、生长方式、假包膜、坏死、囊变、钙化、肿瘤内血管、肾周脂肪侵犯、静脉瘤栓、区域淋巴结肿大、远处转移、强化模式以及强化均匀性。最终结果由两位医师共同商议决定。
1.5 统计学方法患者一般资料及增强CT的统计描述采用SPSS 25.0软件,P < 0.05为差异有统计学意义。特征降维、神经网络模型构建及验证采用R-studio(R语言版本3.6.2)软件。其中降维采用caret包用于实现基于支持向量机的递归特征消除(recursive feature elimination, RFE),采用10折交叉验证。神经网络模型构建及验证采用“neuralnet”包,采用ROC曲线评价模型,计算AUC、敏感度及特异性。
2 结果 2.1 患者一般资料及CT表现比较一般资料中,低、高级别患者的年龄差异无统计学意义(P > 0.05)。患者性别、出现肉眼血尿、腹痛、腹部肿块及非泌尿系恶性肿瘤史的构成比差异均无统计学意义(P > 0.05)。
增强CT中,高级别组ccRCC大小为(66.37±26.12)mm大于低级别组的(45.69±25.43)mm,差异有统计学意义(P < 0.01);高级别组呈浸润性生长、出现坏死、肿瘤内血管、肾周脂肪侵犯、静脉瘤栓、区域淋巴结肿大及远处转移的构成比高于低级别组,差异均有统计学意义(P < 0.01);高级别组ccRCC出现假包膜及囊变的构成比低于低级别组,差异均有统计学意义(P < 0.01);ccRCC的位置、出现钙化、强化模式及强化均匀性构成比差异无统计学意义(P > 0.05),见表 1。
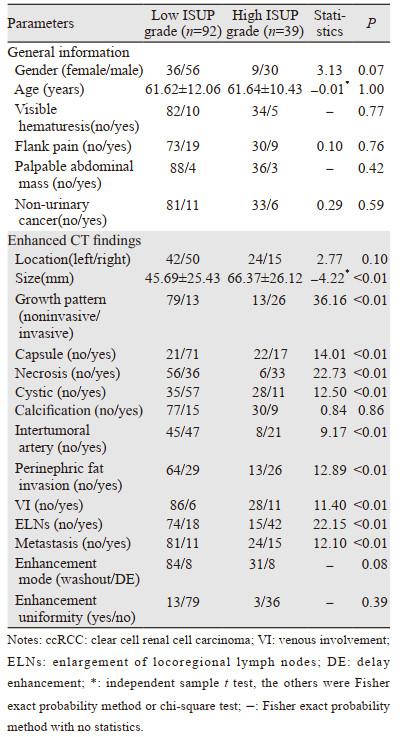
|
增强CT的20个特征存在不同程度的相关性。为避免过拟合,采用RFE法经10折交叉验证后降维为14个特征(均方根误差为0.3758),见图 1。特征经重要性排序后为:生长方式、坏死、区域淋巴结肿大、肿瘤大小、假包膜、肾周脂肪侵犯、囊变、远处转移、静脉侵犯、瘤内血管、年龄、强化模式、性别以及肿瘤位置。程序自动报告前5个特征为最关键特征,故采用该5个特征用于神经网格建模。
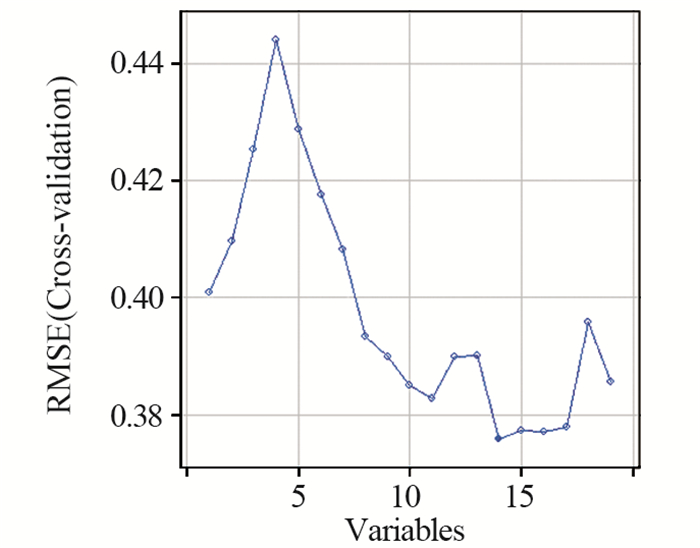
|
| When the number of features was 14, the RMSE was smallest (the blue real point). 图 1 递归特征消除中不同特征数的模型与均方根误差的关系 Figure 1 Relation between models with different feature numbers and RMS error in recursive feature elimination |
以生长方式、坏死、区域淋巴结肿大、肿瘤大小及假包膜作为输入特征,以ccRCC的ISUP简化分级为因变量,在训练集构建非参数化有监督的神经网络模型。最终获得的神经网络包含三层:(1)输入层:包含5个神经元,即5个增强CT的影像特征;(2)隐藏层:包含4个神经元;(3)输出层:包含一个神经元,输出ccRCC是高级别的概率。整个训练共执行2324步,结束条件为误差函数绝对偏导数小于0.008116659,误差为21.47964,模型权重范围为-232.2072~9.099047,见图 2。
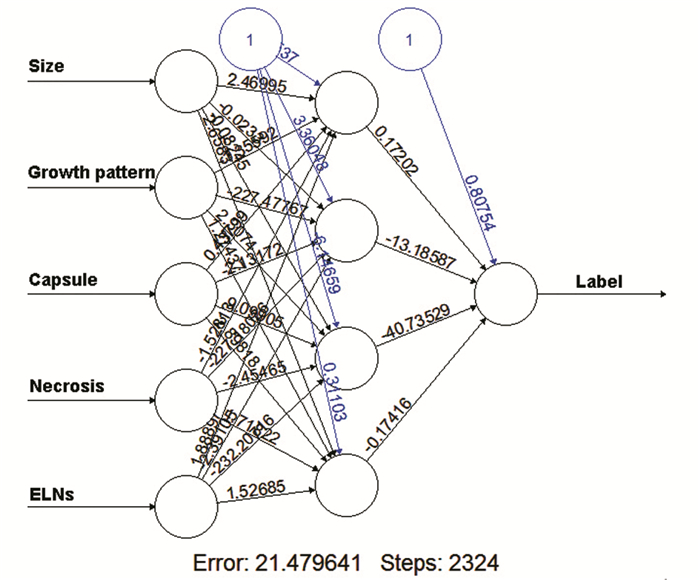
|
| 图 2 训练集的神经网络拓扑图(蓝色神经元为截距项) Figure 2 Neural network topology of the training set (blue neuron was the intercept term) |
根据神经网络输出ccRCC是高级别的概率进行ROC曲线分析,结果表明该神经网络在训练集鉴别低、高级别ccRCC的AUC为0.8844(95%CI: 0.8062~0.9626),敏感度为89.47%,特异性为82.61%。验证集中的AUC为0.7924(95%CI: 0.6567~0.9280),敏感度为75.00%,特异性为86.96%,见图 3。
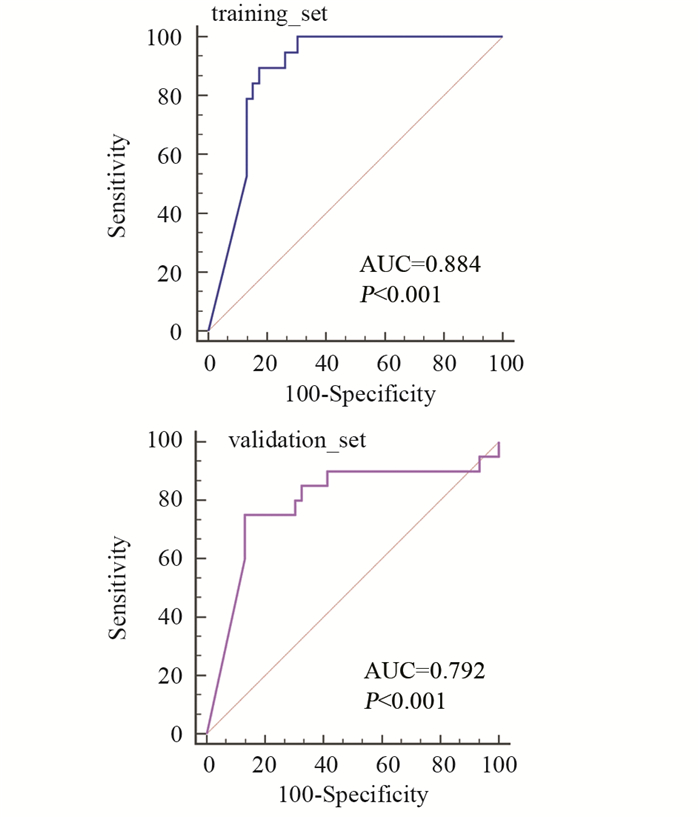
|
| 图 3 神经网络模型的ROC曲线分析 Figure 3 ROC curves of neural network model |
随非侵入性影像学检查应用的逐渐广泛,RCC检出率增加。手术切除仍是局限性RCC的标准治疗方法,但目前出现很多保守治疗方案,如保留肾单位手术、射频消融及冷冻消融等。因此临床需评价肿瘤的生物学行为并指导选择治疗方法,保留肾单位手术存在切缘阳性风险,且术后复发常发生在组织分级较高(Ⅲ~Ⅳ级)的RCC中。对于中晚期已无法手术的患者,高级别的预后也较低级别预后差。因此术前如能评价肿瘤分级,对患者治疗方案的选择和预后判断有较高参考价值。
Fuhrman细胞核分级系统于1982年发布,是以往广泛应用于ccRCC细胞核的分级标准,也是ccRCC患者预后独立的危险因素[6],但该分级系统在实际工作中存在判读困难,可重复性差,也未涉及肾脏肿瘤的新组织亚型分类。因此2016年ISUP推荐发布了ISUP 4级分类系统,本研究采用了该分级标准。同时参考以往各研究Fuhrman分级的简化分级标准,将ISUP中Ⅰ~Ⅱ级定义为低级别,Ⅲ~Ⅳ级定义为高级别。大多数肾肿瘤仅通过影像学就能准确诊断,尤其增强CT具有高度敏感度和特异性[7]。同时临床指南也推荐应用多期增强CT对肾癌进行诊断和分期[8]。加之ccRCC相比非ccRCC具有较明显的动态强化特点,如皮质期强化幅度高、出现假包膜及快速廓清等特点,因此对于ccRCC的影像诊断难度不大。
一些增强CT特征可以对ccRCC组织分化程度的评价提供鉴别信息。本研究共纳入20个增强CT特征,因特征间可能存在不同程度的相关性,且采用过多的特征训练模型既会导致计算成本增加,又容易过拟合。因此本研究将20个增强CT特征采用RFE降维,随后按重要性排序,取前5个特征进行非参数化的神经网络建模,保证模型的简洁性及可解释性。最终获得的5个特征为生长方式、坏死、区域淋巴结肿大、肿瘤大小及假包膜,与以往多个文献报道相近[9-13]。
生长方式方面,一般呈浸润性生长的肿瘤会表现出恶性程度更高的生物学行为[10]。坏死方面,Ahmed等[14]及Sengupta等[15]的研究都表明肾癌出现坏死是ccRCC患者预后的独立危险因子,应定期报告并用于临床评价,与本研究结果类似。病理学领域ccRCC出现坏死也已作为确定的危险因素之一,专家共识也认为ccRCC是否坏死应列入病理报告中[16]。ccRCC区域淋巴结肿大是肿瘤N分期的重要组成部分,出现区域淋巴结肿大会使患者有更晚的临床分期,患者的死亡风险也会增加。肿瘤大小适用于不同组织亚型RCC患者的预后评估[17],肿瘤越大反映肿瘤增殖程度高,侵犯肾窦及肾周结构的风险增加[18]。Chow等[19]认为相对小于4 cm的RCC、直径大于7 cm的肿瘤,其5年生存率从92%下降到了55%,另外肿瘤大小也是T分期的重要指标。ccRCC假包膜一般为纤维成分和被压缩的肾实质构成。当肿瘤生长较缓慢,纤维组织才有反应性增生的时间窗,故出现假包膜提示肿瘤恶性程度较低[20],是ccRCC ISUP分级的保护因素之一。本研究结果表明采用上述5个特征构建鉴别ccRCC ISUP简化分级的神经网络模型在训练集和验证集均有较好的诊断效能,敏感度及特异性均较高。
本研究存在一些局限性:(1)高级别ccRCC样本量较低级别少,最终结果可能存在研究对象的选择偏倚;(2)患者增强CT扫描虽选择了固定的对比剂浓度、扫描条件和图像重建参数,但并未消除个体循环差异对肾灌注造成的影响,从而存在潜在因素影响影像医师对CT图像的评价;(3)本研究部分患者ISUP分级是根据穿刺活检标本确定,虽然穿刺活检的小标本可以评估ISUP分级,但小活检组织弱代表性和肿瘤异质性对ccRCC准确分级可能存在不稳定性。
综上所述,基于增强CT构建鉴别ccRCC ISUP分级的神经网络模型具有较高的鉴别诊断效能,可为ccRCC患者的预后评估提供参考依据。
作者贡献
韩冬:文章设计与撰写
张喜荣、贾永军、任革、贺太平:数据采集及影像评价
吕蕊花、史琳娜:数据分析
| [1] |
Zimpfer A, Glass Ä, Zettl H, et al. Renal cell carcinoma diagnosis and prognosis within the context of the WHO classification 2016[J]. Urologe A, 2019, 58(9): 1057-1065. DOI:10.1007/s00120-019-0952-z |
| [2] |
Moch H, Cubilla AL, Humphrey PA, et al. The 2016 WHO classification of tumours of the urinary system and male genital organs-part a: renal, penile, and testicular tumours[J]. Eur Urol, 2016, 70(1): 93-105. DOI:10.1016/j.eururo.2016.02.029 |
| [3] |
Khor LY, Dhakal HP, Jia X, et al. Tumor necrosis adds prognostically significant information to grade in clear cell renal cell carcinoma: a study of 842 consecutive cases from a single institution[J]. Am J Surg Pathol, 2016, 40(9): 1224-1231. DOI:10.1097/PAS.0000000000000690 |
| [4] |
Keegan KA, Schupp CW, Chamie K, et al. Histopathology of surgically treated renal cell carcinoma: survival differences by subtype and stage[J]. J Urol, 2012, 188(2): 391-397. DOI:10.1016/j.juro.2012.04.006 |
| [5] |
Tsili AC, Argyropoulou MI. Advances of multidetector computed tomography in the characterization and staging of renal cell carcinoma[J]. World J Radiol, 2015, 7(6): 110-127. DOI:10.4329/wjr.v7.i6.110 |
| [6] |
Han D, Yu Y, Yu N, et al. Prediction models for clear cell renal cell carcinoma ISUP/WHO grade: comparison between CT radiomics and conventional contrast-enhanced CT[J]. Br J Radiol, 2020, 20200131. DOI:10.1259/bjr.20200131 |
| [7] |
Kuusk T, Grivas N, de Bruijn R, et al. The current management of renal cell carcinoma[J]. Minerva Med, 2017, 108(4): 357-369. DOI:10.23736/S0026-4806.17.05058-3 |
| [8] |
张树栋, 马潞林. 2017年欧洲泌尿外科学会年会肾癌指南更新及研究进展[J]. 中华泌尿外科杂志, 2017, 38(7): 485-488. [Zhang SD, Ma LL. Update and research progress of renal cancer guidelines at the 2017 annual meeting of European Society of Urology[J]. Zhonghua Mi Niao Wai Ke Za Zhi, 2017, 38(7): 485-488. DOI:10.3760/cma.j.issn.1000-6702.2017.07.002] |
| [9] |
Oh S, Sung DJ, Yang KS, et al. Correlation of CT imaging features and tumor size with Fuhrman grade of clear cell renal cell carcinoma[J]. Acta Radiol, 2017, 58(3): 376-84. DOI:10.1177/0284185116649795 |
| [10] |
Coy H, Young JR, Douek ML, et al. Association of qualitative and quantitative imaging features on multiphasic multidetector CT with tumor grade in clear cell renal cell carcinoma[J]. Abdom Radiol (NY), 2019, 44(1): 180-189. DOI:10.1007/s00261-018-1688-8 |
| [11] |
Chen C, Kang Q, Xu B, et al. Differentiation of low- and high-grade clear cell renal cell carcinoma: Tumor size versus CT perfusion parameters[J]. Clin Imaging, 2017, 46: 14-19. DOI:10.1016/j.clinimag.2017.06.010 |
| [12] |
Wu J, Xu WH, Wei Y, et al. An integrated score and nomogram combining clinical and immunohistochemistry factors to predict high ISUP grade clear cell renal cell carcinoma[J]. Front Oncol, 2018, 8: 634. DOI:10.3389/fonc.2018.00634 |
| [13] |
Zhang X, Wang Y, Yang L, et al. Delayed enhancement of the peritumoural cortex in clear cell renal cell carcinoma: correlation with Fuhrman grade[J]. Clin Radiol, 2018, 73(11): 982. DOI:10.1016/j.crad.2018.06.010 |
| [14] |
Ahmed FS, Akin O, Shaish H, et al. Nonenhancing component of clear cell renal cell carcinoma on computed Tomography correlates with tumor necrosis and stage and serves as a size-independent prognostic biomarker[J]. J Comput Assist Tomogr, 2019, 43(4): 628-633. DOI:10.1097/RCT.0000000000000877 |
| [15] |
Sengupta S, Lohse CM, Leibovich BC, et al. Histologic coagulative tumor necrosis as a prognostic indicator of renal cell carcinoma aggressiveness[J]. Cancer, 2005, 104(3): 511-520. DOI:10.1002/cncr.21206 |
| [16] |
Delahunt B, Egevad L, Samaratunga H, et al. Gleason and Fuhrman no longer make the grade[J]. Histopathology, 2016, 68(4): 475-481. DOI:10.1111/his.12803 |
| [17] |
文娟娟, 周晓军. 肾细胞癌预后的影响因素[J]. 中华病理学杂志, 2013, 42(12): 850-853. [Wen JJ, Zhou XJ. Prognostic factors of renal cell carcinoma[J]. Zhonghua Bing Li Xue Za Zhi, 2013, 42(12): 850-853. DOI:10.3760/cma.j.issn.0529-5807.2013.12.019] |
| [18] |
任金武, 马聪敏, 张立红, 等. 基于Logistic判别模型初步分析肾透明细胞癌CT征象与预后的关系[J]. 临床放射学杂志, 2018, 37(5): 789-792. [Ren JW, Ma CM, Zhang LH, et al. The relation of CT features and prognosis of renal cell carcinoma: preliminary analysis based on logistic discrimination model[J]. Lin Chuang Fang She Xue Za Zhi, 2018, 37(5): 789-792.] |
| [19] |
Chow WH, Shuch B, Linehan WM, et al. Racial disparity in renal cell carcinoma patient survival according to demographic and clinical characteristics[J]. Cancer, 2013, 119(16): 388-394. |
| [20] |
Choi SY, Sung DJ, Yang KS, et al. Small (< 4 cm) clear cell renal cell carcinoma: correlation between CT findings and histologic grade[J]. Abdom Radiol (NY), 2016, 41(6): 1160-1169. DOI:10.1007/s00261-016-0732-9 |
 2021, Vol. 48
2021, Vol. 48


