文章信息
- Bcl-2、miR-451和Th17细胞在食管癌中的诊断价值及其与复发的关系
- Diagnostic Value of Bcl-2, miR-451 and Th17 Cells in Esophageal Cancer and Their Relation with Recurrence
- 肿瘤防治研究, 2021, 48(1): 38-42
- Cancer Research on Prevention and Treatment, 2021, 48(1): 38-42
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0292
- 收稿日期: 2020-04-02
- 修回日期: 2020-07-19
2. 450000 郑州,河南省人民医院检验科
2. Department of Laboratory, He'nan People's Hospital, Zhengzhou 450000, China
食管癌是临床常见消化道肿瘤之一,其发生与遗传、饮食习惯、环境等多种因素有关[1]。此疾病患病情况在中国呈地域性差异,一定区域绝对高发率与附近地区相对低发率形成鲜明对比,是中国食管癌典型的流行病学特征[2]。尽管近年食管癌诊断、治疗技术不断进步,但预后仍较差,中晚期患者5年生存率不足20%[3]。因此,继续加强食管癌早期诊断、预后评估,为临床完善针对性治疗方案提供客观依据是当前研究热点、重点之一。已有研究显示,食管癌病因、机制与细胞凋亡、炎性反应等多种因素协同作用有关[4]。B淋巴细胞瘤-2基因(Bcl-2)是凋亡相关基因家族主要成员之一,在恶性细胞增殖、凋亡中发挥关键调控作用,参与多种恶性肿瘤的演变过程[5];微小RNA-451(miR-451)是病理状态下机体组织细胞重要组成部分,已有研究表明,其在食管癌中存在异常表达情况[6];辅助性T细胞17(Th17细胞)是近年新发现的CD4+T细胞亚群成员,能特异性分泌IL-17介导机体炎性反应,可能与炎性反应相关性肿瘤形成有关[7]。目前鲜见外周血Bcl-2、miR-451和Th17细胞在食管癌患者中表达的相关研究,本研究旨在为临床完善诊断机制提供参考。
1 资料与方法 1.1 一般资料选取2016年10月—2018年10月河南省中医药研究院附属医院收治的101例食管癌患者作为研究组,另选取95例健康体检者作为对照组。纳入标准:经病理初次确诊,未经任何免疫治疗、抗肿瘤治疗;健康体检者经查体无器质性病变疾病,健康状态良好;所有患者的签署知情研究同意书。排除标准:继发性食管癌患者;存在免疫系统疾病者;伴感染性疾病者。研究组男62例,女39例,年龄38~75岁,平均61.89±5.26岁,体质量指数18~24 kg/m2,平均20.96±1.13 kg/m2;对照组男58例,女37例,年龄39~76岁,平均62.16±5.08岁,体质量指数18~24 kg/m2,平均21.03±1.08 kg/m2。两组年龄、性别、体质量指数基础资料均衡可比(均P > 0.05)。本研究经伦理委员会审批通过。
1.2 方法检测方法:(1)Th17细胞检测:乙二胺四乙酸抗凝管取静脉血2 ml,全自动流式细胞仪(贝克曼库尔特,CytoFLEX型)检测Th17细胞水平;(2)Bcl-2检测:非抗凝管取静脉血2 ml,离心15 min(半径8 cm,转速3 500 r/min)取上清液,Bcl-2酶联免疫吸附法试剂盒(上海沪震生物科技有限公司)检测Bcl-2水平;(3)miR-451检测:取上清液,荧光测量法试剂盒提取RNA,脱洗后进行反转录,合成目的基因,采取荧光测量法检测miR-451水平。
治疗方法:根据不同患者食管癌分期、侵犯程度选取不同的治疗方法,包括食管癌根治术、食管癌根治术联合放化疗治疗或单纯放化疗治疗。
随访方法:随访1年,患者自治疗周期结束开始随访计时1年随访终止,采用电话或门诊形式进行随访。研究组失访5例,18例复发,78例未复发。
1.3 观察指标(1)对比两组外周血Bcl-2、miR-451和Th17细胞水平;(2)对比研究组不同临床病理特征患者外周血Bcl-2、miR-451和Th17水平;(3)Pearson相关性系数分析分化程度、临床分期、肿瘤直径、淋巴结转移与外周血Bcl-2、miR-451、Th17细胞水平相关性;(4)受试者工作特征(ROC)曲线分析外周血Bcl-2、miR-451、Th17细胞水平单一或联合诊断食管癌的价值;(5)随访1年,对比复发、未复发患者外周血Bcl-2、miR-451、Th17细胞水平;(6)ROC曲线分析外周血Bcl-2、miR-451、Th17细胞单一或联合预测食管癌复发的价值。
1.4 统计学方法采用SPSS21.0统计分析软件进行统计分析,符合正态分布的计量资料以(x±s)表示,两组间比较采用t检验;计数资料以率表示,两组间比较采用χ2检验。Pearson相关性系数分析相关性;ROC曲线分析诊断及预测价值。P < 0.05为差异有统计学意义。
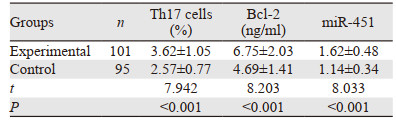
2 结果 2.1 两组外周血指标水平研究组外周血Bcl-2、miR-451、Th17细胞水平高于对照组(P < 0.05),见表 1。
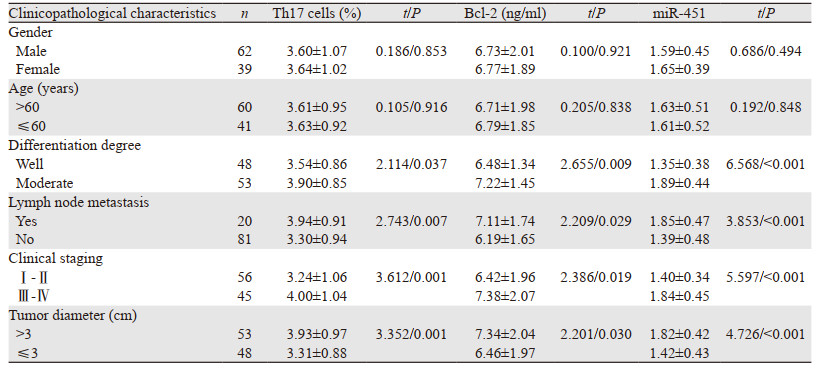
随分化程度降低、临床分期升高、淋巴结转移、肿瘤直径增加外周血Bcl-2、miR-451、Th17细胞水平呈升高趋势(均P < 0.05),见表 2。
|
研究组患者分化程度、临床分期、肿瘤直径、淋巴结转移与外周血Bcl-2、miR-451、Th17细胞水平呈正相关(均P < 0.05),见表 3。

|
ROC曲线分析得到,外周血Bcl-2、miR-451、Th17细胞联合诊断食管癌的AUC值最大,为0.850(95%CI: 0.792~0.897),敏感度及特异性分别为73.27%、90.53%;其次为Th17细胞,AUC为0.803(95%CI: 0.741~0.857),当临界值> 3.63%时,敏感度及特异性分别为59.41%、88.42%;Bcl-2的AUC为0.792(95%CI: 0.729~0.847),当临界值> 6.40 ng/ml时,敏感度及特异性分别为57.43%、55.79%;miR-451的AUC为0.717(95%CI: 0.649~0.779),当临界值> 1.17时,敏感度及特异性分别为78.22%、55.79%,见图 1。

|
| 图 1 各外周血指标单一(A)及联合(B)诊断食管癌的价值 Figure 1 Value of each peripheral blood index for single(A) and combined(B) diagnoses of esophageal cancer |
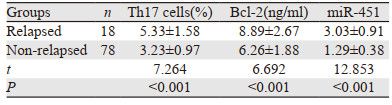
复发患者外周血Bcl-2、miR-451、Th17细胞水平高于未复发患者(均P < 0.05),见表 4。
|
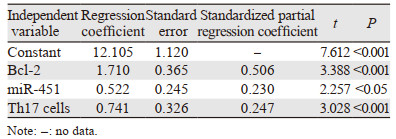
控制分化程度、临床分期、肿瘤大小、淋巴结转移等其他因素后,外周血Bcl-2、miR-451、Th17细胞水平与复发显著相关(均P < 0.05),见表 5。
食管癌属我国多发恶性肿瘤之一,早期隐匿性强,多数患者确诊时已进展至中晚期,丧失最佳根治时机[8]。从细胞分子生物学层面加强食管癌早期筛查、诊断机制对临床具有重要意义。
miR-451是外周血中小分子非编码RNA,参与调节多种细胞凋亡过程。病理研究显示,miR-451结合靶信使RNA后可控制、影响mRNA翻译过程,继而加快机体健康细胞凋亡,诱导癌性因子释放,同时还参与恶性肿瘤生物学行为及耐药基因调控[9]。本研究显示,研究组外周血miR-451水平高于对照组,提示外周血miR-451水平升高可能与食管癌发病、发展有关。但荣忠厚等[10]检测107例胃癌组织中miR-451表达,发现组织内miR-451表达下调患者生存时间较上调患者显著缩短。本研究结论与此不一致,分析可能是因检测靶部位不同,miR-451主要介导细胞凋亡过程,随细胞凋亡、裂解会释放入血,而在外周血中miR-451能逃避RNA酶降解而长时间稳定存在,并随凋亡细胞增多呈升高趋势。陈志平等[11]报道中也表明,miR-451在结肠癌患者外周血中呈高表达,诊断早期原位结肠癌的阳性率为88%。进一步ROC曲线分析显示,外周血miR-451诊断食管癌的敏感度为78.22%,特异性为55.79%,提示其可为临床诊断提供一定参考依据。
Bcl-2是当前已发现与凋亡密切相关的原癌基因之一,阻滞细胞凋亡的作用主要体现在延长细胞生存期,而非刺激细胞增殖。目前研究已证实,在多种恶性组织内Bcl-2过表达,采取Bcl-2小分子抑制剂可提高肿瘤细胞放疗敏感度,其机制是阻断Bcl-2所参与线粒体途径细胞凋亡过程而提高放疗效果[12]。有研究显示,胃癌组织Bcl-2阴性表达患者经放化疗完全缓解率较高[13]。本研究显示,研究组外周血Bcl-2水平高于对照组,提示外周血Bcl-2可能参与食管癌发病过程。有研究采用三维适形精确放射治疗50例食管癌,结果发现,外周血Bcl-2水平与疗效无相关性,得出结论外周血Bcl-2可能与食管癌发病发展无密切关系[14]。进一步对比发现,随分化程度降低、临床分期升高、淋巴结转移、肿瘤直径增加外周血Bcl-2水平呈升高趋势,Pearson相关性系数分析,外周血Bcl-2水平与分化程度、临床分期、肿瘤直径、淋巴结转移呈正相关(P < 0.05),证实外周血Bcl-2水平与食管癌患者发病发展关系密切。与上述研究结论不一致,可能是因其例数较少,缺乏代表性,本研究进一步扩大样本量可客观反映不同患者Bcl-2表达的差异。
Th17细胞是近年肿瘤免疫层面研究的热点方向。研究证实,Th17细胞及其效应因子IL-17能促进肿瘤病理进展,导致患者生存期缩短,预后较差[15-16]。有研究报道了Th17细胞在恶性肿瘤中的特征及表现,进展期黑色素瘤鼠模型中Th17表现高水平,除病灶引流淋巴结外,在骨髓、脾脏、外周血中Th17细胞占比显著升高[17]。进一步研究证实,在人体恶性肿瘤内Th17分布与鼠模型一致[18]。本研究亦发现,食管癌患者外周血Th17细胞水平显著升高,且随分化程度降低、临床分期升高、淋巴结转移、肿瘤直径增加其水平呈升高趋势。分析原因可能是:(1)食管癌微环境内恶性细胞可分泌促Th17细胞增殖必需因子,促进Th17细胞增殖、分化;(2)恶性细胞所分泌CCL20趋化因子可特异性结合Th17细胞表面受体CCR6,刺激Th17细胞在病灶局部增殖,并致外周血Th17细胞水平升高。相关性分析显示,外周血Th17细胞水平与食管癌分化程度、临床分期、肿瘤直径、淋巴结转移呈正相关,证实外周血Th17细胞与食管癌发病发展关系密切,可为临床诊断提供参考依据。
此外,食管癌患者预后5年生存率较低,其预后评价亦是临床重点内容之一,本研究发现,复发患者外周血Bcl-2、miR-451、Th17细胞水平高于未复发患者,且在控制分化程度、临床分期、肿瘤大小、淋巴结转移等其他因素后,外周血Bcl-2、miR-451、Th17细胞水平仍与复发显著相关,说明外周血Bcl-2、miR-451、Th17细胞异常表达可能是预后复发率高的主要原因之一,可能与三者均具有介导健康细胞凋亡、促进恶性组织生长、降低恶性细胞分化能力等原因有关。
综上,食管癌患者存在外周血Bcl-2、miR-451、Th17细胞水平异常表达情况,且表达水平与分化程度、临床分期及复发等关系密切,联合检测可为临床诊断、预后评估提供客观依据,以便临床针对性制定治疗方案。
作者贡献
陈恋恋:实验设计、实施、论文撰写
朱春凯:数据收集、标本检测
郑培明:文献查阅、数据统计
| [1] |
Andreou A, Pesthy S, Struecker B, et al. Incidence and Risk Factors of Symptomatic Hiatal Hernia after Resection for Gastric and Esophageal Cancer[J]. Anticancer Res, 2017, 37(12): 7031-7036. DOI:10.1016/j.jamcollsurg.2016.08.547 |
| [2] |
朱珠, 刘晴, 庹吉妤, 等. 柴湖地区食管癌及癌前病变风险评估模型建立[J]. 现代预防医学, 2019, 46(15): 2701-2704, 2712. [Zhu Z, Liu Q, Tuo JY, et al. Establishment of risk assessment model for esophageal cancer and precancerous lesions, Chaihu[J]. Xian Dai Yu Fang Yi Xue, 2019, 46(15): 2701-2704, 2712.] |
| [3] |
Nguyen T, Bartscht T, Schild SE, et al. A Scoring Tool to Estimate the Survival of Elderly Patients With Brain Metastases from Esophageal Cancer Receiving Whole-brain Irradiation[J]. Anticancer Res, 2020, 40(3): 1661-1664. DOI:10.21873/anticanres.14116 |
| [4] |
Deswaerte V, Nguyen P, West A, et al. Inflammasome Adaptor ASC Suppresses Apoptosis of Gastric Cancer Cells by an IL18-Mediated Inflammation-Independent Mechanism[J]. Cancer Res, 2018, 78(5): 1293-1307. DOI:10.1158/0008-5472.CAN-17-1887 |
| [5] |
Inoue-Yamauchi A, Jeng PS, Kim K, et al. Targeting the differential addiction to anti-apoptotic BCL-2 family for cancer therapy[J]. Nat Commun, 2017, 8: 16078. DOI:10.1038/ncomms16078 |
| [6] |
Wang WC, Hang CW, Zhang YQ, et al. Dietary miR-451 protects erythroid cells from oxidative stress via increasing the activity of Foxo3 pathway[J]. Oncotarget, 2017, 8(63): 107109-107124. DOI:10.18632/oncotarget.22346 |
| [7] |
Wang Y, Xu G, Wang J, et al. Relationship of Th17/Treg Cells and Radiation Pneumonia in Locally Advanced Esophageal Carcinoma[J]. Anticancer Res, 2017, 37(8): 4643-4647. DOI:10.21873/anticanres.11866 |
| [8] |
Short MW, Burgers KG, Fry VT. Esophageal Cancer[J]. Am Fam Physician, 2017, 95(1): 22-28. |
| [9] |
Shen Y, Gong JM, Zhou LL, et al. Correction: MiR-451 as a new tumor marker for gastric cancer[J]. Oncotarget, 2019, 10(59): 6396. DOI:10.18632/oncotarget.27291 |
| [10] |
荣忠厚, 苏忠学, 耿文茂, 等. 微小RNA-451表达和胃癌临床病理特征及预后的关系[J]. 中华实验外科杂志, 2016, 33(2): 318-320. [Rong ZH, Su ZX, Geng WM, et al. The relations between expression quantity of microRNA-451 and clinicopathological features and prognosis in gastric cancer[J]. Zhonghua Shi Yan Wai Ke Za Zhi, 2016, 33(2): 318-320. DOI:10.3760/cma.j.issn.1001-9030.2016.02.013] |
| [11] |
陈志平, 林志彬, 邹文兵, 等. 微小RNA-451靶向调控c-Myc影响结肠癌细胞的增殖与凋亡[J]. 中华实验外科杂志, 2019, 36(4): 660-662. [Chen ZP, Lin ZB, Zou WB, et al. Effect of microRNA-451 on proliferation and apoptosis of colon cancer cells via targeting regulation of c-Myc[J]. Zhonghua Shi Yan Wai Ke Za Zhi, 2019, 36(4): 660-662. DOI:10.3760/cma.j.issn.1001-9030.2019.04.022] |
| [12] |
Ni XB, Ou CW, Guo JB, et al. Lentiviral vector-mediated co-overexpression of VEGF and Bcl-2 improves mesenchymal stem cell survival and enhances paracrine effects in vitro[J]. Int J Mol Med, 2017, 40(2): 418-426. DOI:10.3892/ijmm.2017.3019 |
| [13] |
檀碧波, 李勇, 范立侨, 等. 胃癌组织对奥沙利铂化疗敏感性及其与微小RNA-150表达的关系[J]. 中华实验外科杂志, 2018, 35(10): 1934-1936. [Tan BB, Li Y, Fan LQ, et al. Relationship between drug sensitivity of gastric cancer tissues to L-oxaliplatin and microRNA-150[J]. Zhonghua Shi Yan Wai Ke Za Zhi, 2018, 35(10): 1934-1936. DOI:10.3760/cma.j.issn.1001-9030.2018.10.047] |
| [14] |
杜兰宁, 王丽娜, 李淑萍. p53和Bcl-2在食管鳞癌组织中的表达及与放化疗疗效的关系[J]. 兰州大学学报(医学版), 2016, 42(4): 43-46. [Du LN, Wang LN, Li SP. Expression of p53, Bcl-2 in esophageal squamous cancer tissues and their relationship with chemoradiotherapy efficacy[J]. Lanzhou Da Xue Xue Bao (Yi Xue Ban), 2016, 42(4): 43-46.] |
| [15] |
Knochelmann HM, Dwyer CJ, Bailey SR, et al. When worlds collide: Th17 and Treg cells in cancer and autoimmunity[J]. Cell Mol Immunol, 2018, 15(5): 458-469. DOI:10.1038/s41423-018-0004-4 |
| [16] |
Liu F, Bu ZY, Zhao F, et al. Increased T-helper 17 cell differentiation mediated by Exosome-mediated miR-451 redistribution in gastric cancer infiltrated T cells[J]. Cancer Sci, 2018, 109(1): 65-73. DOI:10.1111/cas.13429 |
| [17] |
Purvis HA, Clarke F, Jordan CK, et al. Protein Tyrosine Phosphatase PTPN22 regulates IL dependent Th17 responses by modulating dectinsignaling in mice[J]. Eur J Immunol, 2018, 48(2): 306-315. DOI:10.1002/eji.201747092 |
| [18] |
Koerner J, Brunner T, Groettrup M. Inhibition and deficiency of the immunoproteasome subunit LMP7 suppress the development and progression of colorectal carcinoma in mice[J]. Oncotarget, 2017, 8(31): 50873-50888. DOI:10.18632/oncotarget.15141 |
 2021, Vol. 48
2021, Vol. 48