文章信息
- 结直肠癌组织中NEK2的表达及其对HCT116细胞增殖、侵袭和迁移能力的影响
- Expression of NEK2 in Colorectal Cancer Tissue and Its Effect on Proliferation, Invasion and Migration of HCT116 Cells
- 肿瘤防治研究, 2021, 48(2): 159-165
- Cancer Research on Prevention and Treatment, 2021, 48(2): 159-165
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0269
- 收稿日期: 2020-03-27
- 修回日期: 2020-08-19
2. 450008 郑州,郑州大学附属肿瘤医院病理科
2. Department of Pathology, Affiliated Tumor Hospital of Zhengzhou University, Zhengzhou 450008, China
结直肠癌(colorectal cancer, CRC)是一种常见的消化道恶性肿瘤,在我国患病率和死亡率分别居于第三位和第五位[1],尽管近年来在诊断和治疗技术上取得了较好的进展,但进展期结直肠癌尤其伴发远端转移的患者预后仍然较差[2]。中心体相关激酶2(NIMA-related kinase 2, NEK2)是一种周期性表达的丝氨酸/苏氨酸蛋白激酶,调控多种细胞周期相关蛋白活性,也是中心体的重要组成部分,对维持有丝分裂进展和双极纺锤体的正确形成发挥重要的调控作用,它还与细胞中心体上的微管相结合促进G2/M期细胞中心体分离。研究发现NEK2异常活化将导致中心体的复制失败和不成熟的中心粒分离,出现染色体不稳定和非整倍体,从而参与了癌症的起始过程。目前已经在胃癌[3]、小细胞肺癌[4]、前列腺癌[5]等多种肿瘤中发现NEK2表达上调并促进肿瘤细胞增殖及侵袭,然而NEK2的表达水平与结直肠癌的关系目前还鲜有报道,本研究旨在探明NEK2在结直肠癌组织中的表达水平及其与临床病理特征的关系,研究沉默NEK2对结直肠癌细胞HCT116增殖及侵袭迁移能力的影响及可能的作用机制。
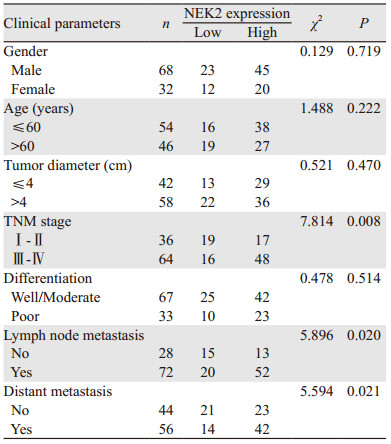
1 资料与方法 1.1 资料 1.1.1 临床资料收集2016年1月—12月在河南省人民医院行结直肠癌根治术的100例患者的癌组织及癌旁组织(距癌灶边缘 > 5 cm取材),其中男68例、女32例,中位年龄59岁(24~76岁)。所有患者术前均未接受放化疗,术后病理结果均经2名以上病理医师确认,且都有完整的临床病例资料,本研究遵循医学伦理学要求。
1.1.2 细胞株及主要试剂人结直肠癌细胞株HCT116、SW480、SW620和人正常结直肠黏膜细胞FHC均保存于河南省人民医院中心实验室。胎牛血清(FBS)、RPMI1640培养基、胰蛋白酶及流式细胞术单染试剂碘化丙锭(PI)购自美国Gibco公司;RNA提取液、qRT-PCR试剂盒及反转录试剂盒均购自武汉赛维尔生物科技有限公司;引物由武汉擎科创新生物科技有限公司合成;免疫组织化学试剂盒及DAB显色液、兔抗人多克隆抗体NEK2(PAH562)、E-cadherin(PAB290)、N-cadherin(PAE582)、CDK4(PAC045)及兔抗人单克隆抗体cyclin D1(PAB021)均购自武汉云克隆科技股份有限公司;CCK8试剂盒购自美国Sigma-Aldrich公司;Transwell小室(孔径3.0 μm)购自美国Corning公司;脂质体转染试剂LipofectamineTM2000购自美国Invitrogen公司。
1.2 实验方法 1.2.1 免疫组织化学染色法检测结直肠癌组织中NEK2表达结直肠癌组织石蜡块以4 μm连续切片,S-ABC法染色;二甲苯脱蜡,乙醇水化后行抗原修复,4%H2O2阻断10 min,5%BSA于37℃封闭1 h,滴加兔抗人多克隆抗体(1:100)4℃过夜。生物素化二抗(1:500)孵育1 h后加入新鲜配置的DAB液显色,苏木精对比染色后树胶封片,观察染色情况。结果判定参照文献报道[6],采用5点评分系统评价阳性细胞数:无阳性细胞数为0分,1%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分;采用4点评分系统评价细胞染色强度:无染色(-)为0分,染色弱为(+)为1分,染色呈棕黄色(++)为2分,呈深棕色(+++)为3分。两项计分的乘积为免疫反应性分数(immunoreactivity scores, IRSs),IRSs≤4为NEK2蛋白低表达,> 4为NEK2蛋白高表达。
1.2.2 实时荧光定量PCR(qRT-PCR)法检测NEK2基因在不同结直肠癌细胞系中的表达水平以细胞生长融合度达80%~90%时收集细胞,根据TRIzol操作说明书提取细胞总RNA。根据反转录试剂盒和荧光定量试剂盒操作说明书进行PCR定量反应。引物序列分别为:NEK2正义链为5'-TGCTTCGTGAACTGAAACATCC-3',反义链为5'-CCAGAGTCAACTGAGTCATCACT-3';GAPDH正义链为5'-GGAGCGAGATCCCTCCAAAAT-3',反义链为5'-GGCTGTTGTCATAC TTCTCATGG-3'。PCR反应条件如下,反转录反应为42℃ 60 min,70℃ 10 min,冰上降温,PCR预变性95℃ 10 min,然后95℃ 15 s、60℃ 60 s、每20 s升温1℃,共40次循环。根据目的基因NEK2和内参基因GAPDH测得CT值差异,运用2-ΔΔCt(RQ)法计算NEK2的相对表达量,实验重复3次。
1.2.3 细胞分组与转染取对数生长期的HCT116细胞,以2×105个/孔接种至6孔培养板,培养24 h。待细胞达到70%~80%融合时,按照LipofectamineTM 2000脂质体试剂盒说明书转染细胞,实验细胞分为阳性转染组(si-NEK2)、阴性对照组(si-CTRL)和空白组。NEK2 siRNA干扰正义链:5'-GCUUGUUUCUGAAGUGAAUTT-3';CTRL siRNA干扰正义链:5'-AAGTAGCCGAGCTTCGATTGC-3',均由吉玛基因合成。
1.2.4 免疫印迹法检测敲低NEK2对HCT116细胞NEK2、E-cadherin、N-cadherin、CDK4及cyclin D1蛋白表达的影响收集细胞并用细胞裂解液裂解提取细胞总蛋白,取50 μg蛋白进行SDS聚丙烯酰胺凝胶电泳1.5 h,然后将蛋白转移到PVDF膜上,1%BSA封闭过夜,分别加入NEK2(1:500)、N-cadherin(1:500)、E-cadherin(1:500)、CDK4(1:200)、cyclin D1(1:400)及GAPDH(1:1 000)一抗37℃孵育2 h,TBST漂洗后,加入1:1 000稀释的羊抗兔二抗37℃孵育1 h,将PVDF膜浸于1 ml显色液中避光约10 min后观察结果,用凝胶图像处理系统分析目标条带的相对分子质量和净吸光度值。实验重复3次。
1.2.5 CCK8法检测敲低NEK2对HCT116细胞增殖能力的影响将100 μl密度为每毫升5×104个细胞的悬液加入96孔板中,细胞贴壁后加入CCK8试剂,分别在24、48、72 h后应用酶标仪测定450 nm处的光密度(OD)值,代表细胞增殖水平。实验重复3次。
1.2.6 流式细胞学检测敲低NEK2对HCT116细胞周期分布的影响细胞按照每毫升5×105个接种于培养瓶中常规培养,细胞融合度达到80%时转染细胞并继续培养48 h,胰酶消化并收集细胞,2 500 r/min离心5 min取细胞沉淀,PBS洗涤两次,细胞经预冷的70%乙醇4℃固定18 h,离心弃固定液,PBS洗涤3次,调整细胞浓度为每毫升1×106,取1 ml细胞悬液,与含20 μg/ml RNA酶的Tris-HCL缓冲液37 ℃孵育30 min,用50 μg/ml碘化丙锭(PI)进行细胞DNA染色。样品用Beckman counter公司FC500MCL/MPL流式细胞仪测细胞周期,采用Multicycle for windows数据分析系统进行数据分析,实验重复3次。
1.2.7 Transwell小室法检测敲低NEK2对HCT116细胞侵袭能力的影响紫外线照射消毒8 μm膜孔Transwell板,下室加入含趋化因子的细胞培养液,各实验组细胞以5×104/ml接种于含人工基底膜成份的Transwell小室并套入下室,37℃培养箱孵育24 h。取出上室,吸取残液。在下室中添加70%甲醛固定30 min,常规结晶紫染色,在高倍镜视野下计数小室面细胞数即为穿透细胞数。
1.2.8 细胞划痕实验检测敲低NEK2对HCT116细胞迁移能力的影响各实验组细胞胰酶消化后以5×105个/毫升接种于6孔板中,待细胞融合度达到100%时用10 µl移液器枪头在培养孔底部划痕,空白组作为对照,继续培养48 h后显微镜下观察细胞迁移距离并拍照,测量多个点划痕宽度,计算平均划痕愈合率。划痕愈合率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。实验重复3次。
1.3 统计学方法SPSS17.0软件进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间均数差异的比较采用单因素方差分析,两两比较采用t检验。采用秩和检验分析NEK2表达水平与临床病理特征的关系。P < 0.05为差异有统计学意义。
2 结果 2.1 NEK2蛋白在CRC组织中的表达及其与CRC临床病理特征的关系免疫组织化学结果显示NEK2蛋白主要定位于肿瘤细胞胞质,少部分定位于胞核内,染色呈棕黄色和深黄色,而在癌旁组织中不表达或弱阳性表达于正常黏膜细胞胞质内,见图 1;根据免疫组织化学评分标准,NEK2蛋白在癌组织中阳性表达率为65%(65/100),明显高于癌旁组织38%(38/100),差异有统计学意义(χ2=14.593, P < 0.01);结果发现NEK2表达与结直肠癌TNM分期、淋巴结转移和远处转移显著相关(均P < 0.05),而与性别、年龄、肿瘤直径大小及肿瘤分化程度无显著相关(均P > 0.05),见表 1。
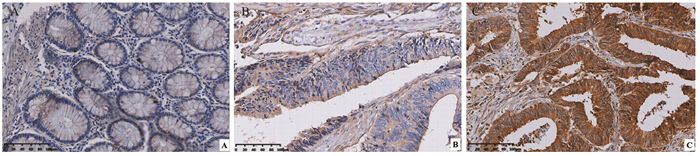
|
| A: negative expression in adjacent normal tissues; B: weakly positive expression in cancer tissues; C: strongly positive expression in cancer tissues. 图 1 NEK2蛋白在结直肠癌及癌旁组织中的表达(免疫组织化学×200) Figure 1 Expression of NEK2 protein in colorectal cancer and adjacent normal tissues (IHC ×200) |
|
qRT-PCR结果显示NEK2 mRNA在结直肠癌细胞SW480、SW620和HCT116中的表达含量明显高于正常结直肠黏膜细胞FHC(均P < 0.01),以低分化HCT116细胞表达含量最高,见图 2A;Western blot结果显示,NEK2蛋白在结直肠癌细胞SW480(3.78±0.17)、SW620(2.62±0.36)和HCT116(4.35±0.18)中的表达含量明显高于正常结直肠黏膜细胞FHC(均P < 0.01),以低分化HCT116细胞表达含量最高,见图 2B。
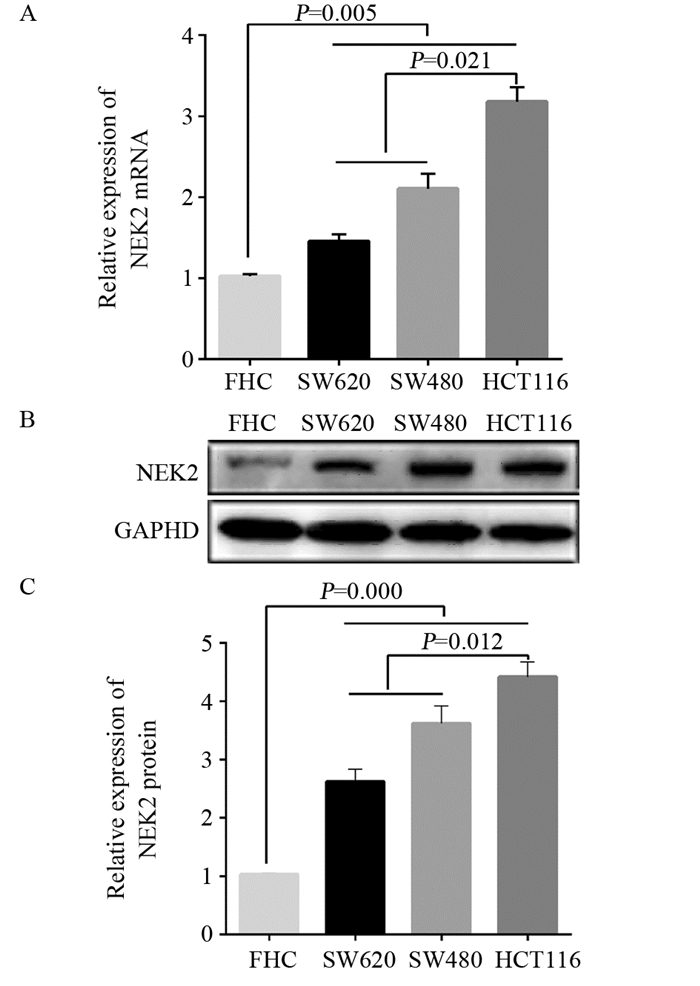
|
| 图 2 NEK2 mRNA(A)和蛋白(B, C)在结直肠癌细胞中的表达 Figure 2 Expression of NEK2 mRNA(A) and protein(B, C) in CRC cells |
si-NEK2及si-CTRL转染细胞后,阳性转染(si-NEK2 HCT116)组的NEK2 mRNA表达水平(0.28±0.07)显著低于阴性对照(si-CTRL HCT116)组(1.03±0.14)及空白(HCT116)组(均P < 0.01),阳性干扰组NEK2蛋白相对表达含量(0.18±0.07)显著低于阴性对照组(1.03±0.14)及空白组(均P < 0.01),见图 3,阴性对照组与空白组间NEK2 mRNA及蛋白表达水平差异无统计学意义(P > 0.05)。
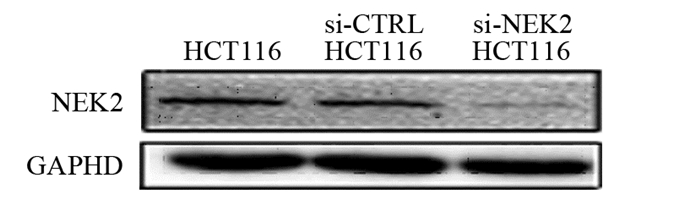
|
| 图 3 转染si-NEK2或si-CTRL的HCT116细胞中NEK2蛋白表达 Figure 3 Expression of NEK2 protein in HCT116 cells transfected with si-NEK2 or si-CTRL |
CCK8检测结果显示细胞转染24~72 h后,阳性转染组细胞HCT116的增殖能力较阴性对照组和空白组明显下降(均P < 0.01),而空白组与阴性对照组间差异无统计学意义(均P > 0.05),表明干扰NEK2表达可显著抑制结直肠癌细胞的增殖能力,见图 4。
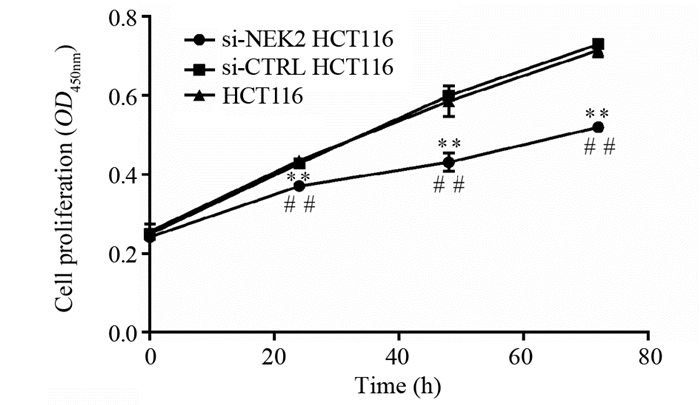
|
| **: P < 0.01, compared between si-NEK2 HCT116 cells and si-CTRL HCT116 cells; ##: P < 0.01, compared between si-NEK2 HCT116 cells and HCT116 cells. 图 4 敲低NEK2对结直肠癌细胞HCT116增殖能力的影响 Figure 4 Effects of NEK2 knockdown on proliferation capability of HCT116 cells |
流式细胞学检测结果显示,与阴性对照组和空白组相比,阳性对照组G0/G1期细胞比例升高,S期比例下降,差异均有统计学意义(均P < 0.01),而阴性对照组和空白组间的细胞周期比例差异无统计学意义(P > 0.05),见图 5。
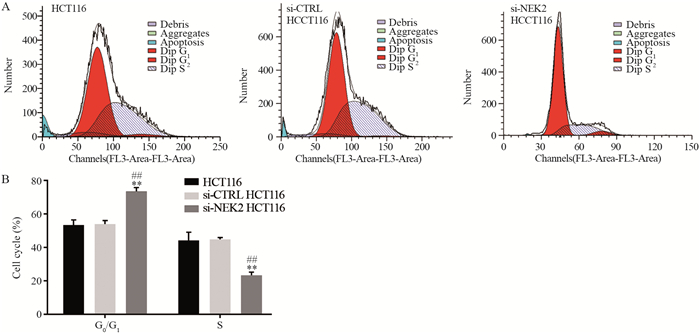
|
| **: P < 0.01, compared between si-NEK2 HCT116 cells and si-CTRL HCT116 cells; ##: P < 0.01, compared between si-NEK2 HCT116 cells and HCT116 cells. 图 5 敲低NEK2对结直肠癌细胞HCT116周期的影响 Figure 5 Effects of NEK2 knockdown on cell cycle of colorectal cancer HCT116 cells |
Transwell小室法检测结果显示,阳性转染组的穿膜细胞数明显低于阴性对照组和空白组((95.67±7.77)vs.(163.00±13.08)、(171.33±13.05),均P < 0.01),阴性对照组和空白组间穿膜细胞数差异无统计学意义(P > 0.05),见图 6A、B;划痕实验结果显示,阳性转染组的划痕愈合率明显低于阴性对照组和空白组((31.80±4.10)% vs.(70.57±2.32)%、(72.77±3.25)%,均P < 0.01),阴性对照组和空白组间划痕愈合率差异无统计学意义(P > 0.05),图 6C、D。
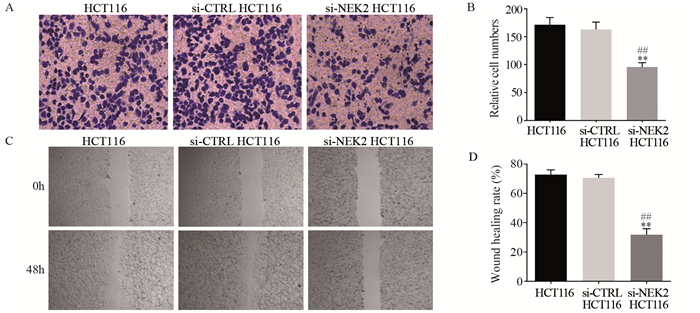
|
| **: P < 0.01, compared between si-NEK2 HCT116 cells and si-CTRL HCT116 cells; ##: P < 0.01, compared between si-NEK2 HCT116 cells and HCT116 cells. 图 6 敲低NEK2对结直肠癌细胞HCT116侵袭(A, B)和迁移(C, D)能力的影响 Figure 6 Effects of NEK knockdown on invasion(A, B) and migration(C, D) abilities of colorectal cancer HCT116 cells |
Western blot检测结果显示,对比阴性对照组和空白组,细胞周期相关蛋白CDK4和cyclin D1,EMT相关分子标志物N-cadherin在阳性对照组的表达量显著下降(P < 0.01),EMT相关分子标志物E-cadherin在阳性对照组的表达量显著升高(P < 0.01)。上述蛋白在阴性对照组和空白组间的表达差异无统计学意义(P > 0.05),见图 7。
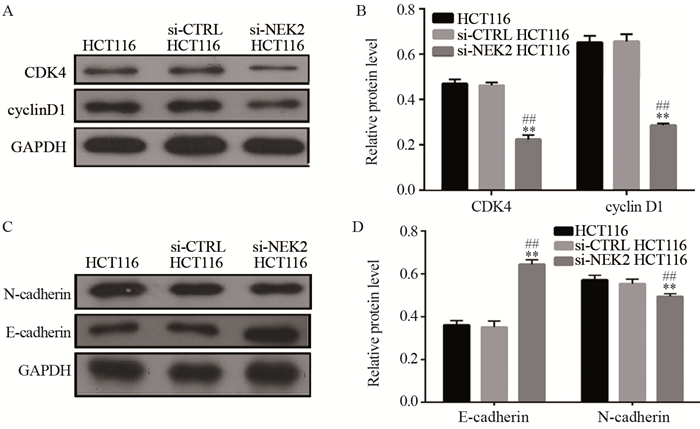
|
| **: P < 0.01, compared between si-NEK2 HCT116 cells and si-CTRL HCT116 cells; ##: P < 0.01, compared between si-NEK2 HCT116 cells and HCT116 cells. 图 7 细胞周期蛋白CDK4和cyclin D1(A, B),EMT相关分子标志物E-cadherin和N-cadherin(C, D)在结直肠癌细胞HCT116中的表达 Figure 7 Expression of CDK4 and cyclin D1(A, B), E-cadherin and N-cadherin(C, D) in colorectal cancer HCT116 cells |
NEK2基因定位于染色体1q32.2~1q41,其表达蛋白是一种与中心体(never in mitosis A,NIMA)有丝分裂调节器结构相似的丝氨酸/苏氨酸激酶,它包含一个N端的催化激酶结构域,C端结构域包含亮氨酸拉链、卷曲螺旋、中心体结合位点、核仁定位和微管结合位点、PP1结合位点和APC结合位点等多种结构基团[7],NEK2通过结合并磷酸化有丝分裂相关蛋白参与染色体的复制和分离[8]、微管稳定[9]、着丝点附着和纺锤体组装等细胞周期过程[10-11]。近年来研究发现,NEK2异常活化会导致染色体不稳定和染色体包含异常内容,最终导致肿瘤发生[12]。Zhang等[13]研究发现NEK2在肝细胞癌中的表达水平与患者的预后呈负相关,NEK2通过激活Wnt、NF-κB、VEGF及P53信号通路介导EMT机制促进了肝癌细胞的侵袭和转移,另有研究表明NEK2可通过活化蛋白激酶磷酸酶(mitogen-activated protein kinase, MAPK)信号通路调控HepG2细胞的增殖、凋亡及其他生物学行为[14]。在前列腺癌的研究中,Zeng等[15]发现NEK2在人前列腺癌细胞和原发性前列腺癌组织中表达升高并与患者的Gleason评分及病理分期呈正相关,通过siRNA技术沉默NEK2表达可抑制前列腺癌细胞的体外增殖和异种移植体的体内生长。此外,Kokuryo等[16]也发现NEK2在胰腺癌细胞株中高表达,NEK2 siRNA可抑制胰腺癌皮下移植瘤小鼠模型的肿瘤生长,延长腹腔内移植瘤小鼠模型的生存时间,并利用门静脉导管系统有效地阻止肝转移的进展。以上结果表明,NEK2的异常表达促进了肿瘤的增殖、侵袭和转移,而针对NEK2的siRNA治疗有可能作为肿瘤治疗的一个有效手段。
本研究采用免疫组织化学技术、qRT-PCR和Western blot检测NEK2在结直肠癌组织及细胞中的表达,结果显示NEK2蛋白及mRNA在结直肠癌组织及细胞中高表达,并与结直肠癌TNM分期、淋巴结转移和远处转移相关,提示NEK2可能与结直肠癌的发生发展有关。为探究NEK2在结直肠癌中的作用机制,我们选取结直肠癌细胞HCT116作为研究对象,通过体外瞬时转染NEK2 siRNA抑制HCT116中NEK2 mRNA表达。CCK8实验及流式细胞学检测结果显示,NEK2干扰后,HCT116细胞G1期比例增加,S期比例减低,提示出现G0/G1期阻滞,并且细胞增殖率较对照组显著下降。CDK4是细胞G1/S期转换的关键调控因子,它与细胞cyclin D1形成复合物后可使视网膜母细胞瘤蛋白发生磷酸化失活,驱动细胞周期进展[17],目前在乳腺癌研究中已发现NEK2与CDK4的表达存在分子连接性[18]。NEK2是否通过与CDK4和cyclin D1的相互作用参与结直肠癌细胞的周期调控,本研究结果显示在NEK2干扰阳性转染组中CDK4和cyclin D1的表达量显著降低,表明NEK2下调可通过改变CDK4和cyclin D1表达量使结直肠癌细胞发生周期阻滞,抑制细胞生长。此外Transwell小室法和划痕实验的检测结果显示,NEK2干扰后HCT116细胞穿膜细胞数及划痕愈合率均显著下降,表明NEK2下调能显著降低HCT116细胞的侵袭转移能力。高度保守的Wnt/β-catenin信号通路在调控胚胎发育、器官形成、组织再生及决定细胞命运方面发挥着重要作用,而多种肿瘤癌基因则通过调控Wnt/β-catenin信号通路使其异常活化促进结直肠癌细胞的增殖、侵袭和转移[19-21]。在肝细胞癌的研究中发现NEK2的异常活化可改变β-catenin在细胞内定位,进而促进肿瘤细胞EMT进程并获得侵袭性表型[22]。为研究结直肠癌中NEK2表达与EMT机制的关系,本研究通过Western blot检测EMT关键组件E-cadherin和N-cadherin在HCT116细胞中的变化,结果显示敲低NEK2后HCT116细胞E-cadherin蛋白高表达,N-cadherin低表达,表明NEK2在EMT过程中及结直肠癌侵袭转移的肿瘤促进功能上发挥着关键作用,然而NEK2具体通过何种信号通路参与调控EMT进程仍有待进一步的研究。
本研究结果表明,NEK2在结直肠癌组织中高表达,下调NEK2表达可抑制人结直肠癌细胞的增殖及侵袭转移能力,提示NEK2在结直肠癌的发生发展过程中发挥着重要的作用,可作为结直肠癌基因治疗的有效靶点。
作者贡献:
崔发财:文献查阅与论文撰写
陈瑜:免疫组织化学结果判读
胡敏:整体实验思路设计及论文指导
毋小玉:细胞学实验操作
魏晓霞:临床资料收集与数据分析
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
Gallagher DJ, Kemeny N. Metastatic Colorectal Cancer: From Improved Survival to Potential Cure[J]. Oncology, 2010, 78(3-4): 237-248. DOI:10.1159/000315730 |
| [3] |
Li Y, Chen L, Feng L, et al. NEK2 promotes proliferation, migration and tumor growth of gastric cancer cells via regulating KDM5B/H3K4me3[J]. Am J Cancer Res, 2019, 9(11): 2364-2378. |
| [4] |
Zhao D, Han W, Liu X, et al. Deguelin inhibits epithelial-to-mesenchymal transition and metastasis of human non-small cell lung cancer cells by regulating NIMA-related kinase 2[J]. Thoracic Cancer, 2017, 8(4): 320-327. DOI:10.1111/1759-7714.12444 |
| [5] |
Zhang FB, Du Y, Tian Y, et al. MiR-1299 functions as a tumor suppressor to inhibit the proliferation and metastasis of prostate cancer by targeting NEK2[J]. Eur Rev Med Pharmacol Sci, 2019, 23(2): 530-538. |
| [6] |
Lu L, Zhai X, Yuan R. Clinical significance and prognostic value of Nek2 protein expression in colon cancer[J]. Int J Clin Exp Pathol, 2015, 8(11): 15467-15473. |
| [7] |
Hames RS, Fry AM. Alternative splice variants of the human centrosome kinase Nek2 exhibit distinct patterns of expression in mitosis[J]. Biochemical J, 2002, 361(Pt 1): 77-85. |
| [8] |
Faragher AJ, Fry AM. Nek2A kinase stimulates centrosome disjunction and is required for formation of bipolar mitotic spindles[J]. Mol Biol Cell, 2003, 14(7): 2876-2889. DOI:10.1091/mbc.e03-02-0108 |
| [9] |
Jeong Y, Lee J, Kim K, et al. Characterization of NIP2/centrobin, a novel substrate of Nek2, and its potential role in microtubule stabilization[J]. J Cell Sci, 2007, 120(Pt 12): 2106-2116. |
| [10] |
Hardy T, Lee M, Hames RS, et al. Multisite phosphorylation of C-Nap1 releases it from Cep135 to trigger centrosome disjunction[J]. J Cell Sci, 2014, 127(Pt 11): 2493-2506. |
| [11] |
Liu Q, Hirohashi Y, Du X, et al. Nek2 targets the mitotic checkpoint proteins Mad2 and Cdc20: A mechanism for aneuploidy in cancer[J]. Exp Mol Pathol, 2010, 88(2): 225-233. DOI:10.1016/j.yexmp.2009.12.004 |
| [12] |
Wang X, Chen K, Liu H, et al. Prognostic significance of NEK2 in human solid tumors: a systematic review and meta-analysis[J]. Biosci Rep, 2018, 39(1): BSR20180618. |
| [13] |
Zhang Y, Wang W, Wang Y, et al. NEK2 promotes hepatocellular carcinoma migration and invasion through modulation of the epithelial-mesenchymal transition[J]. Oncol Rep, 2018, 39(3): 1023-1033. |
| [14] |
Zhang MX, Xu XM, Zhang P, et al. Effect of silencing NEK2 on biological behaviors of HepG2 in human hepatoma cells and MAPK signal pathway[J]. Tumor Biol, 2016, 37(2): 2023-2035. DOI:10.1007/s13277-015-3993-y |
| [15] |
Zeng YR, Han ZD, Wang C, et al. Overexpression of NIMA-related kinase 2 is associated with progression and poor prognosis of prostate cancer[J]. BMC Urol, 2015, 15: 90. DOI:10.1186/s12894-015-0085-7 |
| [16] |
Kokuryo T, Hibino S, Suzuki K, et al. Nek2 siRNA therapy using a portal venous port-catheter system for liver metastasis in pancreatic cancer[J]. Cancer Sci, 2016, 107(9): 1315-1320. DOI:10.1111/cas.12993 |
| [17] |
Pan Q, Sathe A, Black PC, et al. CDK4/6 Inhibitors in Cancer Therapy: A Novel Treatement Strategy for Bladder Cancer[J]. Bladder Cancer, 2017, 3(2): 79-88. DOI:10.3233/BLC-170105 |
| [18] |
Zeng X, Shaikh FY, Harrison MK, et al. The Ras oncogene signals centrosome amplification in mammary epithelial cells through cyclin D1/Cdk4 and Nek2[J]. Oncogene, 2010, 29(36): 5103-5112. DOI:10.1038/onc.2010.253 |
| [19] |
Yu FB, Sheng J, Yu JM, et al. MiR-19a-3p regulates the Forkhead box F2-mediated Wnt/β-catenin signaling pathway and affects the biological functions of colorectal cancer cells[J]. World J Gastroenterol, 2020, 26(6): 627-644. DOI:10.3748/wjg.v26.i6.627 |
| [20] |
Sun J, Zhang T, Cheng M, et al. TRIM29 facilitates the epithelial-to-mesenchymal transition and the progression of colorectal cancer via the activation of the Wnt/β-catenin signaling pathway[J]. J Exp Clin Cancer Res, 2019, 38(1): 104. DOI:10.1186/s13046-019-1098-y |
| [21] |
Qi J, Yu Y, Öztürk ÖA, et al. New Wnt/β-catenin target genes promote experimental metastasis and migration of colorectal cancer cells through different signals[J]. Gut, 2016, 65(10): 1690-1701. DOI:10.1136/gutjnl-2014-307900 |
| [22] |
Neal CP, Fry AM, Moreman C, et al. Overexpression of the Nek2 kinase in colorectal cancer correlates with beta-catenin relocalization and shortened cancer-specific survival[J]. J Surg Oncol, 2014, 110(7): 828-838. DOI:10.1002/jso.23717 |
 2021, Vol. 48
2021, Vol. 48


