文章信息
- 基于SEER数据库的肿瘤直径大于7.0厘米的非小细胞肺癌患者预后分析
- Prognosis Analysis of Non-small Cell Lung Cancer with Diameter over 7.0 cm Based on SEER Database
- 肿瘤防治研究, 2021, 48(1): 49-54
- Cancer Research on Prevention and Treatment, 2021, 48(1): 49-54
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.19.1587
- 收稿日期: 2020-04-24
- 修回日期: 2020-08-13
肿瘤大小是非小细胞肺癌的已知预后影响因素,通常是分期和治疗的主要决定因素[1]。在第八版IASLC(International Association for the Study of Lung Cancer)肺癌分期系统中建议将1.0 cm作为Cut-off值来区分肿瘤风险,即肿瘤最大径每增加1.0 cm,患者的预后更差[2]。同时第八版TNM肺癌分类修订中,也将较大的(> 7.0 cm)肿瘤从第七版的T3期升级至第八版的T4期[2]。这些变化均强调了肿瘤大小对于非小细胞肺癌的预后价值,然而对于肿瘤直径 > 7.0 cm的非小细胞肺癌未进一步区分风险[3],目前尚不明确肿瘤大小对于这部分患者在治疗方式或预后上的影响。
肿瘤大小是决定不同非小细胞肺癌术式的重要因素。多项研究已证实:肺段切除术、肺叶切除术、双叶切除术、全肺切除术等不同术式不但影响术后并发症,还对患者远期生存具有重要影响[4],而且肿瘤大小本身就是预测肺癌切除术围手术期死亡率的独立危险因素[5]。尽管肿瘤大小对非小细胞肺癌的预后意义已得到认可,但是有关进一步区分更大肿瘤(> 7.0 cm)死亡风险的临床研究很少。
因此,为了进一步区分肿瘤直径 > 7.0 cm非小细胞肺癌的死亡风险,以及手术、非手术治疗的临床价值,我们基于SEER数据库获得大量临床数据进行统计学分析,以期为肿瘤直径 > 7.0 cm的非小细胞肺癌患者临床治疗提供参考。
1 资料与方法 1.1 数据来源本研究纳入的非小细胞肺癌患者样本均来源于SEER(Surveillance, Epidemiology and End Results)数据库,SEER数据库由美国国家癌症研究所于1973年创立,覆盖28%美国人口,收集了大量循证医学的相关数据[6]。
1.2 研究人群通过SEER*Stat软件提取数据库2010—2015年间病理诊断为非小细胞肺癌患者数据。收集患者临床资料包括:年龄、性别、种族、婚姻状况、病理类型、肿瘤大小、淋巴结N分期、远处转移情况、治疗方法、生存时间、生存状态及死亡原因等。
纳入标准:(1)依据ICD-O-3代码,病理诊断明确为原发性非小细胞肺癌;(2)肿瘤直径大于7.0 cm。排除标准:(1)M分期为M1;(2)多源性肿瘤;(3)侵犯纵隔、膈肌、心脏、大血管、喉返神经、隆突、气管、椎体等特定器官;(4)同侧不同肺叶内孤立病灶;(5)年龄、性别、种族、分期、治疗方法、预后等病例资料信息不完整;(6)30天内死亡的病例。
经筛选,本研究收集了符合标准的患者5 519例,并将患者按照瘤体直径大小分为7.0 cm < D < 8.0 cm组(即7.0~8.0 cm组;D: Diameter, 直径)、8.0 cm≤D < 9.0 cm组(即8.0~9.0 cm组)、9.0 cm≤D < 10.0 cm(即9.0~10.0 cm组)和D≥10.0 cm组。
1.3 统计学方法通过SPSS24.0软件对数据进行统计学分析,采用寿命表法计算生存率,Kaplan-Meier法绘制生存曲线,生存率比较采用Log rank法。对有统计学差异的因素分别进行单因素和多因素Cox回归分析,P < 0.05为差异有统计学意义。
2 结果 2.1 肿瘤直径大于7.0 cm非小细胞肺癌患者的生存率全部患者1、2、3年累计生存率分别为51.8%、33.0%、25.0%,患者生存曲线见图 1。

|
| 图 1 肿瘤直径大于7.0 cm非小细胞肺癌患者的生存曲线 Figure 1 Survival curve of NSCLC patients with tumor diameter > 7.0 cm |
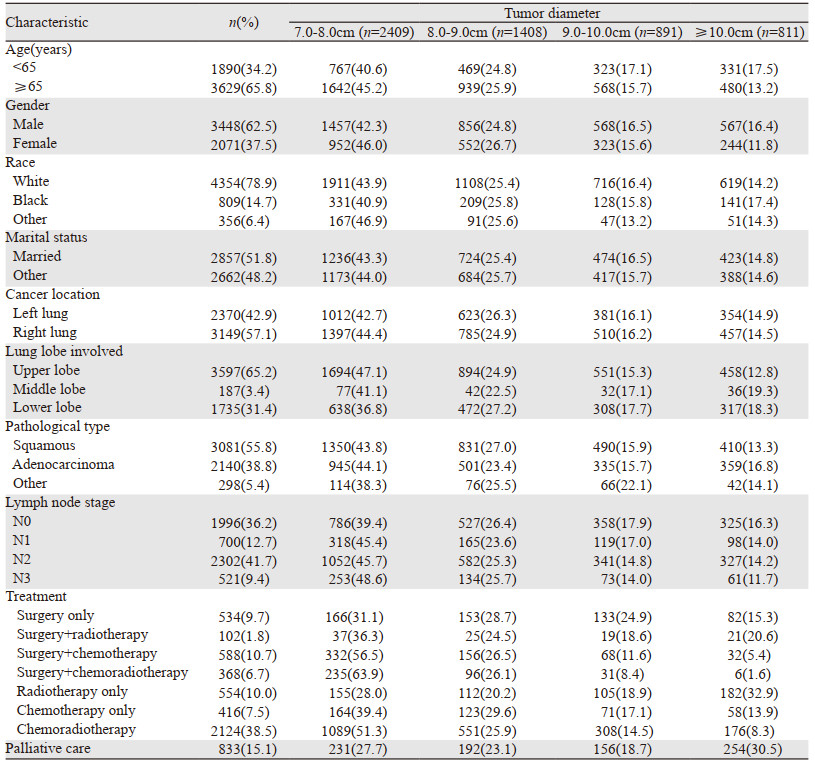
5 519例肿瘤直径大于7.0 cm非小细胞肺癌患者的中位生存时间为12.5月。其中2 409例(43.7%)患者肿瘤大小为7.0~8.0 cm,其次为8.0~9.0 cm的患者1 408例(25.5%),9.0~10.0 cm的患者有891例(16.1%),≥10.0 cm的患者有811例(14.6%)。大多数患者为老年(65.8%)、男性(62.5%)、白种人(78.9%)、已婚(51.8%),病灶多出现在右肺(57.1%)及上叶(65.2%)。对于淋巴结N期,大多数患者被诊断为N2期(41.7%),其次是N0期(36.2%),N1期(12.7%),N3期(9.4%)。鳞癌(55.8%)是最常见的组织学类型,其次是腺癌(38.8%),再次为其他分化差和未分化的组织亚型(5.4%)。在治疗选择方面,7.0~8.0 cm的N0~N1期患者大多选择手术治疗方式(分别为54.0%和50.9%),N2~N3期患者多数选择非手术治疗方式(分别为73.2%和87.7%)。对于8.0~9.0 cm的N0~N1期患者选择手术治疗方式居多(分别为45.1%和55.7%),N2~N3期患者多选择手术治疗方式(分别为68.9%和86.5%)。对于9.0~10.0 cm的N0期患者选择非手术及手术治疗方式的比例相近,分别为42.4%和42.4%,N1期患者选择手术及非手术治疗方式的比例分别50.4%和38.6%,N2及N3患者多接受非手术治疗方式(分别为66.2%和82.1%)。而对于D≥10.0 cm组的N0~N3分期患者选择非手术治疗方式居多,分别为40.6%、42.8%、60.5%和72.1%,见表 1。
|
通过Kaplan-Meier单因素生存分析显示,患者性别、肿瘤大小、淋巴结N分期及治疗方面具有统计学意义(P < 0.001),见图 2。而在年龄、种族、婚姻、肿瘤部位、肿瘤分叶、病理类型方面均未见明显差异(P > 0.05)。

|
| 图 2 性别、肿瘤大小、淋巴结N分期和治疗方式与肿瘤直径大于7.0 cm非小细胞肺癌患者预后分析 Figure 2 Prognosis of NSCLC patients with tumor diameter > 7.0 cm by gender, tumor size, lymph node N stage and treatments |
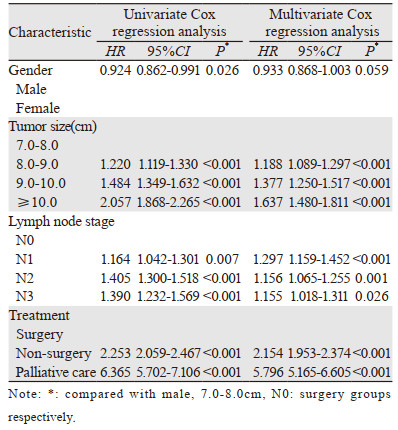
将上述Kaplan-Meier单因素分析中有统计学差异的变量纳入Cox回归模型分别进行单因素及多因素分析。相较于肿瘤7.0~8.0 cm患者,8.0~9.0 cm、9.0~10.0 cm及≥10.0 cm组患者死亡风险明显增加(P < 0.001)。N3期相较于N0期的死亡风险增高。姑息治疗相较于手术治疗的死亡风险明显增高,约为5~6倍。结果显示:肿瘤大小(P < 0.001)、淋巴结分期(P < 0.001)、治疗手段(P < 0.001)是影响肿瘤直径 > 7.0 cm非小细胞肺癌患者的预后独立危险因素,见表 2。同时结果也提示在临床治疗中,治疗手段的选择对于非小细胞肺癌患者预后具有重要意义。
|
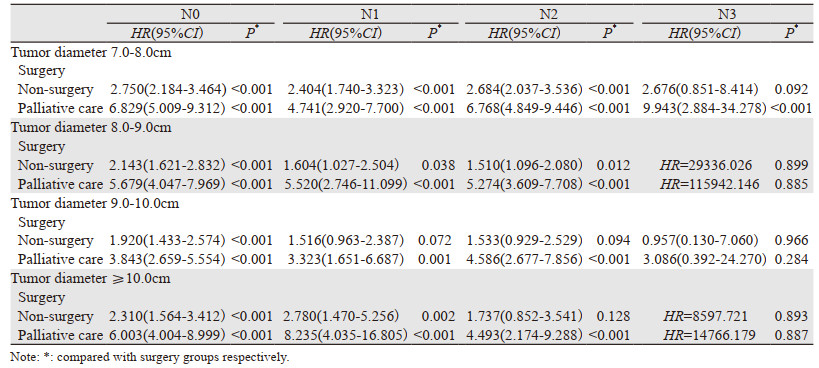
Kaplan-Meier单因素生存分析结果显示在治疗手段(手术、非手术、姑息治疗)方面,不论是7.0~8.0 cm的N0期患者,还是肿瘤直径更大的N3期患者,治疗手段对预后都具有统计学意义(P < 0.001),且是非小细胞肺癌患者的独立预后危险因素。Cox回归分析结果显示,在N0及N1期患者中,7.0~8.0 cm、8.0~9.0 cm、9.0~10.0 cm和≥10.0 cm四组患者手术治疗方式与非手术治疗、姑息治疗相比,手术治疗在改善患者生存预后方面显示出明显的优势(P < 0.05)。而在N2期患者中,当肿瘤直径 < 9.0 cm时,手术治疗更有利于改善患者预后。而一旦肿瘤直径≥9.0 cm时,手术与非手术治疗方式相比,在预后方面差异无统计学意义(P > 0.05)。在淋巴结N3期患者中仍出现同样的结果,即手术与非手术组在预后方面差异无统计学意义(P > 0.05)。然而不管是淋巴结N0期或N3期,姑息性治疗都不能提高患者总生存率。因此,不管是肿瘤直径≥10.0 cm的患者,还是淋巴结分期为N3期的患者,应该积极选择手术或者非手术治疗,而不是姑息治疗,见表 3。
|
肺癌是全球肿瘤相关性死亡的主要原因之一,NSCLC约占肺癌的80%[7]。对于局部晚期患者,预后具有异质性。肿瘤大小是临床分期和治疗方式的重要影响因素。
本研究通过Cox单因素及多因素分析结果显示:肿瘤大小、淋巴结N分期及治疗是影响肿瘤直径 > 7.0 cm NSCLC的独立预后危险因素。我们基于SEER数据库纳入的5 519例患者临床数据,进一步分为7.0~8.0 cm、8.0~9.0 cm、9.0~10.0 cm和≥10.0 cm四组进行分层分析。结果显示在四组患者中,淋巴结N0~N1患者接受手术治疗比接受其他治疗(非手术、姑息治疗)具有较好的生存优势。对于T4N0M0和T4N1M0分期患者,手术仍然是最主要的治疗手段。临床中,手术前还需要充分评估患者肿瘤可切除性、患者对于手术的耐受性以及手术方式。对于高龄或者合并严重并发症的患者,选择手术仍需要谨慎。手术在完全切除的基础上尽可能保留残存肺组织功能[8],根据患者基本情况及详尽术前评估,可行肺叶切除术、袖式切除术和全肺叶切除术[9]。Lucchi等在2007年对60期病理分期为T4N0~2M0非小细胞肺癌患者进行回顾性研究,结果发现对于没有纵隔淋巴结受累(N2)的患者,T4N0~1M0分期患者从手术治疗中获益更多,且预后既不受肿瘤亚型的影响,也不受辅助疗法及新辅助化疗的影响[10]。还有研究把98例ⅢA期NSCLC患者随机分为同期放化疗组和术后化疗组,术后化疗组术后3~4周开始紫杉醇联合卡铂化疗,结果显示同期放化疗组1、2、3年的生存率分别为76.19%、45.24%和23.81%,而术后化疗组分别为82.14%、51.79%和37.50%,术后化疗组年生存率明显优于同期放化疗组。与同期放化疗相比, ⅢA期患者接受手术结合术后化疗的治疗方式可明显延长患者生存期[11],同样也肯定了手术治疗在ⅢA期NSCLC患者预后的临床意义,因此ⅢA期患者手术后可行辅助性化疗,而不建议术后放疗。
临床N2期非小细胞肺癌患者的治疗模式一直存在争议。临床中认为只有少部分ⅢB期可行手术切除治疗,特指T3N2期,且为直径 < 3 cm、单一的淋巴结转移,而大部分T4N2期患者包括多站淋巴结转移或发生对侧肺门/纵隔淋巴结转移,及部分器官转移(如心脏、气管、椎体等),临床上定义为不可手术切除,或者不适合手术切除。Albain等在一项临床研究中发现具有同侧纵隔淋巴结转移的T4期非小细胞肺癌患者接受手术切除治疗后,预后不佳。患者不能从手术中获益在很大程度上认为与肺切除术后并发症的高死亡率有关,主要由ARDS和其他严重并发症引起[12]。Gillaspie等研究发现巨块型ⅢA-N2期非小细胞肺癌患者,外科治疗并不能使患者获益[13]。而根治性同步放化疗具有较好的远期生存率[14]。Hofmann等研究发现,具有纵隔淋巴结受累的Ⅲ期非小细胞肺癌患者接受肿瘤切除术的患者与接受保守治疗的患者相比,前者中位生存期明显更好(39.8月vs.19.6月,P=0.014),在N2分期特定病例中应推荐手术切除,可以使患者达到长期生存[15]。Collaud等对2000—2015年5 416例非小细胞肺癌患者进行回顾性分析,其中60例患者(1%)为临床ⅢB期,其中32例T4N2非小细胞肺癌患者累及隆突或上腔静脉(n=25, 78%)、左心房(n=5, 16%)或其他部位(n=2, 6%),患者手术完全切除率为92%,3、5年生存率分别为51%和39%[4]。研究结果显示患者在可耐受手术的情况下,手术可被视为多模式治疗的一个重要组成部分。同时手术治疗可以减轻患者肿瘤负荷,使鳞癌对放化疗更敏感[16]。本研究中,肿瘤直径7.0~9.0 cm的N2期患者接受手术与非手术在预后方面差异有统计学意义,接受非手术治疗的死亡风险明显高于手术组(7.0~8.0 cm组:HR=2.684, 95%CI: 2.037~3.536, P < 0.001; 8.0~9.0 cm组:HR=1.510, 95%CI: 1.096~2.080, P < 0.05)。而肿瘤直径≥9.0 cm的N2期Cox回归分析结果显示接受手术治疗和非手术治疗差异无统计学意义(9.0~10.0 cm组:HR=1.533, 95%CI: 0.929~2.529, P=0.094;≥10.0 cm组:HR=1.737, 95%CI: 0.852~3.541, P=0.128)。上述结果可能是接受手术治疗的患者并发症更多,以及两组患者临床基线特征不同形成混杂因素干扰所致。在以往研究中,对于局部晚期以及晚期非小细胞肺癌,临床中常常推荐同步放化疗[8]或者检测靶基因进行靶向治疗或者行免疫治疗,有关手术治疗在临床多模式综合治疗中价值的探讨较少。因此,具有同侧纵隔淋巴结转移(N2期)且肿瘤直径 > 7.0 cm非小细胞肺癌患者还需要多学科团队进一步进行综合评估。
对于肿瘤直径 > 7.0 cm N3期非小细胞肺癌患者接受手术与非手术在预后方面无统计学差异(P > 0.05)。有临床研究证实Ⅲ-N3期患者接受根治性放化疗后, 生存获益更多,因此放化疗被认为是Ⅲ-N3期非小细胞肺癌患者的标准治疗方式[17]。最后,研究还发现姑息治疗不能改善肿瘤直径 > 7.0 cm非小细胞肺癌患者预后,包括N0~N3期。
近年来,基于传统治疗,以程序性死亡蛋白1(PD-1)和程序性死亡蛋白配体(PD-L1)为代表的免疫治疗和以表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)为代表的靶向治疗进一步改善了晚期NSCLC患者的治疗反应和生存预后[18]。然而SEER数据库并没有提供基因靶向治疗和免疫治疗方案,进而无法评估靶向治疗和免疫治疗效果,这些都可能对治疗决策产生影响。有关PS评分、患者生活质量等无法从SEER数据库中获得。因此,仍需要前瞻性、多学科、大样本量的临床研究的循证医学证据来证实手术治疗的价值。
作者贡献
冯婷婷:文献查阅、病例收集、数据统计分析及论文撰写
陈众众、闫文锦:文献查阅、数据统计分析
王玉秀、张峻:数据校正
徐兴祥、闵凌峰:研究方案制定、审阅
陈勇、杨俊俊:论文修改
| [1] |
Zhang J, KA Gold, HY Lin, et al. Relationship between tumor size and survival in non-small-cell lung cancer (NSCLC): an analysis of the surveillance, epidemiology, and end results (SEER) registry[J]. J Thorac Oncol, 2015, 10(4): 682-690. DOI:10.1097/JTO.0000000000000456 |
| [2] |
Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer[J]. J Thorac Oncol, 2016, 11(1): 39-51. DOI:10.1016/j.jtho.2015.09.009 |
| [3] |
Yoon JY, Sigel K, Martin J, et al. Evaluation of the Prognostic Significance of TNM Staging Guidelines in Lung Carcinoid Tumors[J]. J Thorac Oncol, 2019, 14(2): 184-192. DOI:10.1016/j.jtho.2018.10.166 |
| [4] |
Collaud S, Provost B, Besse B, et al. Should surgery be part of the multimodality treatment for stage ⅢB non-small cell lung cancer?[J]. J Surg Oncol, 2018, 117(7): 1570-1574. DOI:10.1002/jso.25042 |
| [5] |
Huang WW, Zhu WZ, Mu DL, et al. Perioperative Management May Improve Long-term Survival in Patients After Lung Cancer Surgery: A Retrospective Cohort Study[J]. Anesth Analg, 2018, 126(5): 1666-1674. DOI:10.1213/ANE.0000000000002886 |
| [6] |
Xie G, Wang R, Shang L, et al. Calculating the overall survival probability in patients with cervical cancer: a nomogram and decision curve analysis-based study[J]. BMC Cancer, 2020, 20(1): 833. DOI:10.1186/s12885-020-07349-4 |
| [7] |
Shen HT, Chien PJ, Chen SH, et al. BMI1-Mediated Pemetrexed Resistance in Non-Small Cell Lung Cancer Cells Is Associated with Increased SP1 Activation and Cancer Stemness[J]. Cancers(Basel), 2020, 12(8): E2069. DOI:10.3390/cancers12082069 |
| [8] |
Yoon SM, Shaikh T, Hallman M. Therapeutic management options for stage Ⅲ non-small cell lung cancer[J]. World J Clin Oncol, 2017, 8(1): 1-20. DOI:10.5306/wjco.v8.i1.1 |
| [9] |
Boffa DJ, Hancock JG, Yao X, et al. Now or later: evaluating the importance of chemotherapy timing in resectable stage Ⅲ (N2) lung cancer in the National Cancer Database[J]. Ann Thorac Surg, 2015, 99(1): 200-208. DOI:10.1016/j.athoracsur.2014.08.040 |
| [10] |
Lucchi M, Viti A, Melfi F, et al. ⅢB-T4 non-small cell lung cancer: indications and results of surgical treatment[J]. J Cardiovasc Surg (Torino), 2007, 48(3): 369-374. |
| [11] |
Van Schil PE, Yogeswaran K, Hendriks JM, et al. Advances in the use of surgery and multimodality treatment for N2 non-small cell lung cancer[J]. Expert Rev Anticancer Ther, 2017, 17(6): 555-561. DOI:10.1080/14737140.2017.1319766 |
| [12] |
Albain KS, Swann RS, Rusch VW, et al. Radiotherapy plus chemotherapy with or without surgical resection for stage Ⅲ non-small-cell lung cancer: a phase Ⅲ randomised controlled trial[J]. Lancet, 2009, 374(9687): 379-386. DOI:10.1016/S0140-6736(09)60737-6 |
| [13] |
Gillaspie EA, Wigle DA. Management of Stage ⅢA (N2) Non-Small Cell Lung Cancer[J]. Thorac Surg Clin, 2016, 26(3): 271-285. DOI:10.1016/j.thorsurg.2016.04.001 |
| [14] |
Guo SX, Jian Y, Chen YL, et al. Neoadjuvant Chemoradiotherapy vesus Chemotherapy alone Followed by Surgery for Resectable Stage Ⅲ Non-Small-Cell Lung Cancer: a Meta-Analysis[J]. Sci Rep, 2016, 6: 34388. DOI:10.1038/srep34388 |
| [15] |
Hofmann HS, Braess J, Leipelt S, et al. Multimodality therapy in subclassified stage ⅢA-N2 non-small cell lung cancer patients according to the Robinson classification: heterogeneity and management[J]. J Thorac Dis, 2018, 10(6): 3585-3594. DOI:10.21037/jtd.2018.05.203 |
| [16] |
Qin A, Lusk E, Daignault-Newton S, et al. Chemotherapy and Radiation Versus Chemotherapy Alone for Elderly Patients With N3 Stage ⅢB NSCLC[J]. Clin Lung Cancer, 2019, 20(4): e495-e503. DOI:10.1016/j.cllc.2019.04.003 |
| [17] |
Tan AC, Teh YL, Lai GGY, et al. Third generation EGFR TKI landscape for metastatic EGFR mutant non-small cell lung cancer (NSCLC)[J]. Expert Rev Anticancer Ther, 2019, 19(6): 431-435. DOI:10.1080/14737140.2019.1604228 |
| [18] |
Berger KN, Pu JJ. PD-1 pathway and its clinical application: A 20year journey after discovery of the complete human PD-1 gene[J]. Gene, 2018, 638: 20-25. DOI:10.1016/j.gene.2017.09.050 |
 2021, Vol. 48
2021, Vol. 48


