文章信息
- PD-L1、PD-L2、CD30、CD23和BCL-6在原发纵隔大B细胞淋巴瘤诊断和预后评估中的应用价值
- Application of PD-L1, PD-L2, CD30, CD23 and BCL-6 in Diagnosis and Prognostic Evaluation of Primary Mediastinal Large B-cell Lymphoma
- 肿瘤防治研究, 2021, 48(10): 941-946
- Cancer Research on Prevention and Treatment, 2021, 48(10): 941-946
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0307
- 收稿日期: 2021-03-19
- 修回日期: 2021-06-10
原发性纵隔大B细胞淋巴瘤(primary mediastinal B-cell lymphoma, PMBL)是一种侵袭性B细胞淋巴瘤,占非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)的2%~3%,多见于30~40岁女性[1]。尽管采用了免疫治疗方案,10%~30%的PMBL患者仍有复发。难治性(relapsed/refractory, RR)疾病需要挽救治疗,且效果并不令人满意[2]。PMBL利用PD-1/PD-L轴抑制抗肿瘤反应[3],抗CD30单抗(brentuximab vedotin, BV)在CD30阳性PMBL患者中表现出较好的疗效[4]。文献报道60%~85%的PMBL表达CD23,而在非纵隔DLBCL和结外DLBCL中表达率较低[5]。GATA3是鉴别PMBL和纵隔经典霍奇金淋巴瘤(classic Hodgkin’s lymphoma, CHL)的最有帮助的标志物[6],BCL-2在静息B细胞和T细胞上表达而在正常生发中心细胞上不表达,相反BCL-6在生发中心内的B和CD4+T细胞中表达,MUM1/IRF4和CD138反映了生发中心内B细胞成熟为浆细胞的最后步骤,但有关PMBL中的BCL-6和MUM1表达情况的研究还较少。与其他淋巴瘤不同,PMBL缺乏预后生物标志物,并且当非纵隔原发的非特指型弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, not otherwise specified, DLBCL-NOS)累及纵隔时,临床上很难与原发性纵隔大B细胞淋巴瘤进行区分,因此我们选取了非纵隔DLBCL-NOS作为对照组,运用免疫组织化学法对诊断为PMBL、DLBCL-NOS组织中的治疗相关标志物PD-L1、PD-L2、CD30及CD23、BCL-2、BCL-6、MUM1、GATA3的表达进行检测及分析,探讨上述8种蛋白在PMBL诊断和预后评估中的应用价值,寻求更具特异性的免疫组织化学指标,提高对该病的诊断,以期为判断PMBL预后提供理论参考进而指导临床个体化治疗。
1 资料与方法 1.1 临床资料选取2000—2019年中国医学科学院肿瘤医院病理科确诊的34例PMBL,对照组为随机抽取的同期31例非纵隔原发的DLBCL-NOS,取材涵盖了常见发病部位。34例PMBL患者有完整的随访资料,所有切片均由两位有经验的临床病理医师独立阅片,病理诊断依据WHO标准(2017版),结合临床特点、组织学形态、免疫表型及分子诊断,均已明确诊断。本研究所有患者均知情同意。
1.2 病理形态学观察及分级 1.2.1 制备组织切片34例PMBL和31例DLBCL-NOS的肿瘤组织用4%的中性甲醛固定4~6 h,取1.5 cm×1.5 cm×0.3 cm的组织块,5~10倍固定液中固定3~24 h,脱水、过夜(水洗、脱水、透明、浸蜡),石蜡包埋,切片厚度为3~5 μm,烘烤。
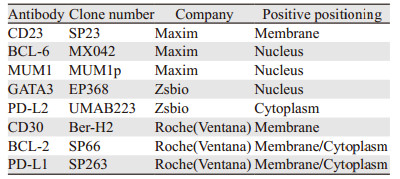
1.2.2 免疫组织化学染色采用4 μm厚FFPE组织切片进行免疫组织化学染色,免疫组织化学采用EnVision法。切片经过脱蜡、水化、抗原修复后滴加一抗,主要一抗为PD-L1、PD-L2、CD30、CD23、GATA3、BCL-2、BCL-6和MUM1,一抗来源及阳性表达部位见表 1。按厂家说明书操作,温浴30~60 min后滴加二抗,DAB显色,苏木精对比染色,常规脱水、透明、封片。染色时每批均包括阴性对照和阳性对照。
PD-L1和PD-L2细胞膜染色肿瘤细胞的百分比,见表 2。针对抗体CD23、CD30和GATA3,选取代表区域计数10个高倍视野下阳性肿瘤细胞占细胞总数的百分比,< 10%阳性细胞判为阴性(-),阳性细胞数≥10%且染色弱阳性为(+),阳性细胞数≥10%且染色中等阳性为(++),阳性细胞数≥10%且染色强阳性为(+++),按照(+)(-)进行记录并分析。抗体BCL-2、BCL-6和MUM1的截断值为30%[7],结果记录见表 3。本研究中染色细胞百分率主要由两位有经验的临床病理专家评分,平均阳性细胞百分率用于分析,有争议的病例由第三位临床病理专家确认。标志物的诊断指标计算公式:敏感度=真阳性/(真阳性+假阴性),特异性=真阴性/(真阴性+假阳性),阳性预测值=真阳性/所有阳性,阴性预测值=真阴性/所有阴性。
|
|
通过常规的复诊或电话对患者进行回顾性随访。主要研究终点是总生存期(overall survival, OS),其定义为从最初确诊到死亡或最后一次随访的时间(2020年11月)。记录以下随访内容:病程、治疗和预后情况、随访结束时的状况(死亡、存活或失访)、死亡原因和存活时间。
1.4 统计学方法所有数据采用统计学软件SPSS20.0进行统计分析,检验水准α=0.05,P < 0.05为差异有统计学意义。各蛋白表达与PMBL和DLBCL-NOS患者临床及病理因素的关系采用卡方检验;PD-L1、PD-L2和CD30在PMBL和DLBCL-NOS中的阳性肿瘤细胞百分比组间比较采用非参数秩和检验;Kaplan-Meier法进行单变量生存分析并绘制生存曲线,Log rank检验比较生存差异。所有指标采用GraphPad Prism 8及SPSS20.0进行作图。
2 结果 2.1 临床特点PMBL患者34例,其中男性19例(55.88%),女性15例(44.12%),中位年龄28岁(15~47岁)。随机选择非纵隔原发的DLBCL-NOS患者31例作为对照组,其中男20例(64.52%),女性11例(35.48%),中位年龄63岁(年龄17~84岁)。两组年龄分布差异有统计学意义(P < 0.01)。在PMBL组中,由纵隔压迫引起的症状是最主要的症状,全部34例病例均有大小不等的纵隔肿块。
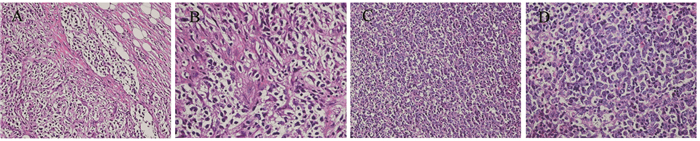
2.2 PMBL病理特征形态上PMBL肿瘤细胞弥漫分布,被纤细或粗大致密胶原分割,呈簇状、巢团状或结节状排列。肿瘤细胞中等大或稍大,胞质淡染,细胞核较圆或卵圆形,部分病例中可见Reed-Sternberg样细胞,见图 1A、B。PMBL组织形态上与累及纵隔的DLBCL-NOS有重叠,见图 1C、D,鉴别诊断需要免疫组织化学标志物的辅助。PMBL组中进行Ki-67标记,阳性细胞比例为30%~80%,其中64.71%(22/34)的病例表达超过60%,DLBCL-NOS组表达相似。
|
| 图 1 PMBL(A, B)与DLBCL-NOS(C, D)的HE染色(A, C: ×200; B, D: ×400) Figure 1 HE staining of PMBL(A, B) and DLBCL-NOS (C, D) (A, C: ×200; B, D: ×400) |
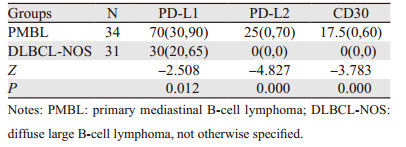
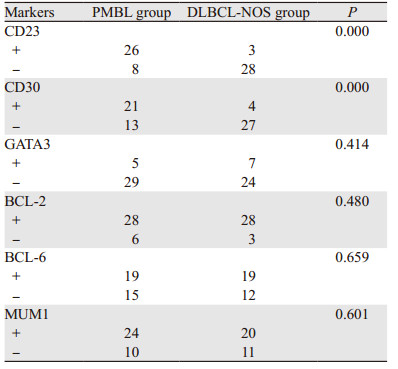
PMBL组和非纵隔原发的DLBCL-NOS组中PD-L1、PD-L2、CD30、CD23、BCL-2、BCL-6、MUM1和GATA3的表达见图 2。PD-L1、PD-L2和CD30在PMBL组阳性肿瘤细胞百分比的中位数分别为70%(30%, 90%)、25%(0, 70%)和17.5%(0, 60%),显著高于DLBCL-NOS组,差异有统计学意义(均P < 0.05),见表 2。PMBL组CD30阳性表达率为61.76%(21/34),DLBCL-NOS组为12.90%(4/31),差异有统计学意义(P=0.000)。与DLBCL-NOS组比较,CD30诊断PMBL的特异性为76.47%(13/17),阳性预测值为84%(21/25),阴性预测值为32.50%(13/40)。PMBL组CD23阳性率为76.47%(26/34),在DLBCL-NOS组中阳性表达率为9.68%(3/31),差异有统计学意义(P=0.000)。与DLBCL-NOS组比较,CD23诊断PMBL的特异性为72.73%(8/11),阳性预测值为89.66%(26/29),阴性预测值为22.22%(8/36)。GATA3(P=0.414)、BCL-2(P=0.480)、BCL-6(P=0.659)和MUM1(P=0.601)的表达在PMBL和DLBCL-NOS组之间差异均无统计学意义,见表 3。
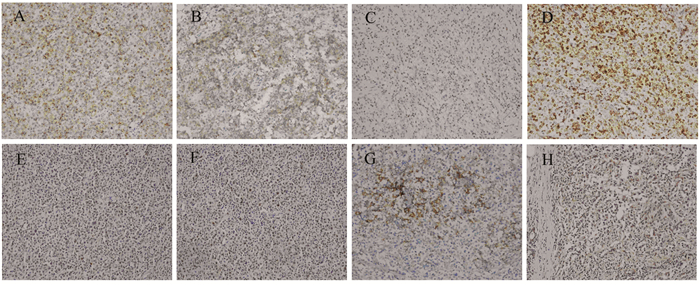
|
| 图 2 CD23(A)、CD30(B)、GATA3(C)、BCL-2(D)、BCL-6(E)、MUM1(F)、PD-L1(G)和PD-L2(H)在PMBL中的阳性表达(×200) Figure 2 Positive expression of CD23(A), CD30(B), GATA3(C), BCL-2(D), BCL-6(E), MUM1(F), PD-L1(G) and PD-L2(H) in PMBL group (×200) |
PMBL组有完整随访资料的患者28例,失访6例,随访率82.4%。死亡6例(6/28,21.43%),中位生存期为30.5月(4.2~166.1月),总体生存曲线见图 3。5例(5/28,17.86%)单纯采用CHOP方案化疗,16例(16/28,57.14%)常规化疗结合利妥昔单抗,1例(1/28,3.57%)PD-1抑制剂联合常规化疗4周期后达到完全缓解(complete response, CR),13例(13/28,46.43%)接受过放射治疗。伴有CD30或BCL-6表达的PMBL患者其生存曲线尽管P > 0.05,但仍显示出预后差的趋势,见图 4。
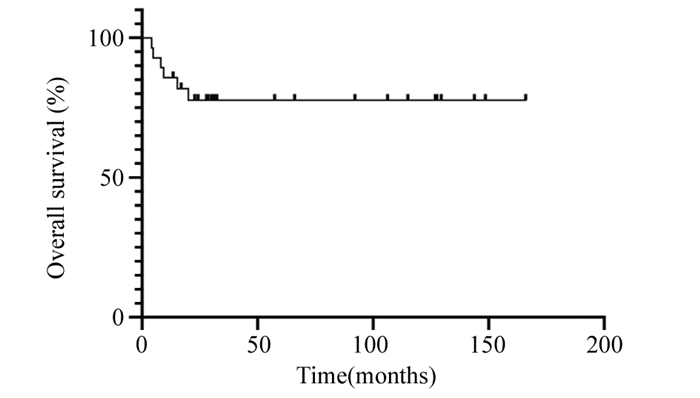
|
| 图 3 原发性纵隔大B细胞淋巴瘤患者总体生存曲线 Figure 3 Overall survival curve of patients with primary mediastinal large B-cell lymphoma |
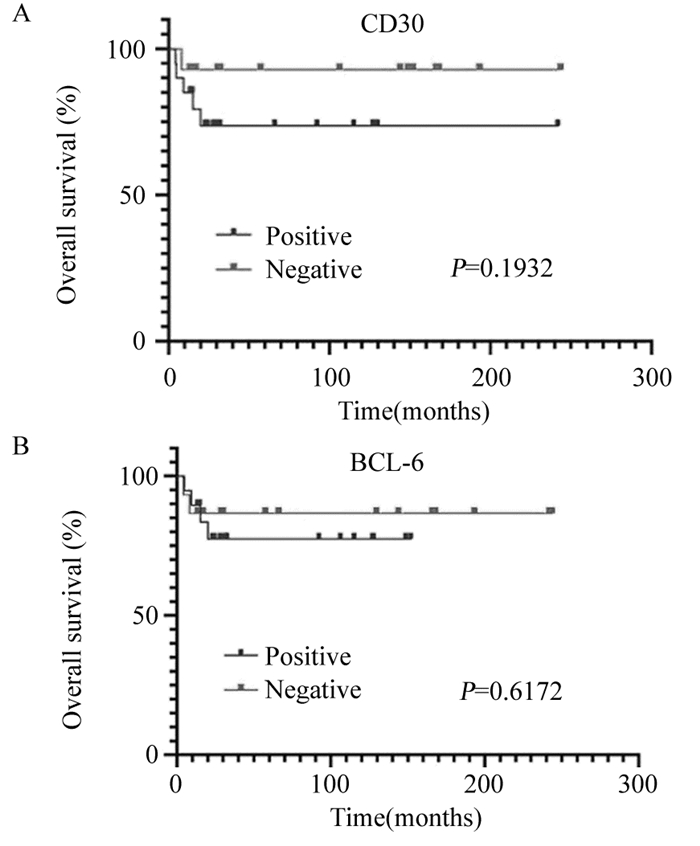
|
| 图 4 伴有CD30(A)或BCL-6(B)表达的PMBL患者的生存曲线 Figure 4 Survival curves of PMBL patients with CD30(A) or BCL-6(B) expression |
原发性纵隔大B细胞淋巴瘤起源于胸腺髓质B细胞,是一种发病率较低但并不罕见的淋巴造血系统疾病,男女比约为1:3。本研究结果显示PMBL发病高峰年龄段为28岁左右,男女性别无差异,与既往文献女性患者居多的特点有所不同,而DLBCL-NOS患者多集中于老年人。组织学上,PMBL的肿瘤细胞多呈透明细胞或R-S(Reed-Sternberg)样细胞形态,且穿刺活检标本易挤压、固定不佳,致使难以识别而漏诊误诊,免疫组织化学可以协助诊断。PMBL表达B细胞抗原(如CD20,CD79α)和B细胞转录因子(如PAX-5、BOB.1、Oct-2等),不表达表面免疫球蛋白(Ig)和κ、λ[8]。PMBL在形态学和细胞学上不同病例间具有较大的变异,CD30阳性率约为80%,个体差异较大且通常染色强度较弱,CD23阳性率约为70%,BCL-2阳性率约为55%~80%,BCL-6阳性率约为45%~100%[9]。免疫组织化学研究对于PMBL和DLBCL-NOS的鉴别诊断必不可少,在本研究中我们探讨了治疗相关标志物PD-L1、PD-L2、CD30及CD23、BCL-2、BCL-6、MUM1和GATA3在PMBL诊断和预后评估中的应用价值,以期为判断PMBL预后提供理论参考进而指导临床的个体化治疗。
PD-L1和PD-L2经常由于特定的遗传突变而过度表达。PD-L1的表达具有时空异质性,PD-L1阴性肿瘤复发时可能变成PD-L1阳性肿瘤(反之亦然)。Ventana的sp263 PD-L1用于免疫组织化学检测时,建议病理学家的报告结果包括阳性肿瘤细胞百分比。对于PD-L2蛋白到目前为止还没有得到广泛的研究。9p24.1染色体异常多见于PMBL,相比之下这种异常在DLBCL中很少见[10-12]。一些研究已经表明,PD-L1位点的畸变是PMBL的一个特征,并且PD-L1的表达与9p24.1的扩增相关[13]。我们在PMBL中的研究结果表明,PD-L1和PD-L2在PMBL组的表达水平较高,与DLBCL-NOS组间差异有统计学意义(P < 0.05),因此PD-L1和PD-L2免疫组织化学检测可作为鉴别PMBL和DLBCL-NOS的辅助实验手段,有助于识别更多对免疫检查点抑制剂有反应的患者,但尚需进一步的前瞻性测试和验证,以确定免疫检查点抑制剂在淋巴瘤亚型中的疗效。基于KEYNOTE-170研究,帕博利珠单抗获得美国食品药品监督管理局(food and drug administration, FDA)复发/难治性(R/R)PMBL适应证批准。KEYNOTE-170研究中,应用帕博利珠单抗治疗R/R PMBL,中位随访43.1月后,76%的患者治疗反应持续时间(duration of response, DOR)超过36月,36月无进展生存(progress free survival, PFS)率达34.2%。因此,帕博利珠单抗单药治疗R/R PMBL显示出持久的抗肿瘤效应且安全可控[3]。另外纳武利尤单抗联合CD30单抗治疗R/R PMBL的Ⅱ期临床研究也显示出纳武利尤单抗与维布妥昔单抗BV(brentuximab vedotin)的协同效应,其可作为桥接治疗方案[4]。这些发现强调了PD-1/PD-L1轴在调节抗肿瘤免疫方面的重要性,以及在临床实践中靶向这一信号通路的好处。
CD30在临床中是一个非常重要的指标,除了淋巴造血系统肿瘤,CD30在非淋巴造血系统肿瘤中也可以表达。CD30能够帮助鉴别多种淋巴肿瘤,如霍奇金淋巴瘤(Hodgkin’s lymphoma, HL)、间变大细胞淋巴瘤(anaplastic cell lymphoma, ALCL)[14]。除此之外,CD30在一些T细胞淋巴瘤和B细胞淋巴瘤中都可以表达,但CD30的专一性、特异性不强,给淋巴瘤的病理诊断带来困难,需要结合形态以及其他免疫组织化学标记进行诊断。PMBL肿瘤细胞存在CD30高表达,本组试验结果亦显示CD30表达在PMBL与DLBCL-NOS组之间差异有统计学意义(P < 0.01),因此治疗相关标志物PD-L1、PD-L2和CD30均有助于区分PMBL与DLBCL-NOS。BV是一类CD30抗体偶联药物,可通过抑制微管蛋白合成和细胞分裂,诱导CD30阳性肿瘤细胞凋亡。BV联合纳武利尤单抗治疗R/R PMBL显现出良好的协同抗肿瘤活性,客观缓解率(objective response rate, ORR)达73%,完全缓解(complete response, CR)率为37%[4]。CD23是一种低亲和力的IgE受体,还可作为成熟滤泡B细胞、活化巨噬细胞、嗜酸性粒细胞和滤泡树突状细胞上的淋巴细胞生长因子。CD23在PMBL中的表达率为70%~85%[5, 15],与本研究在PMBL中观察到的76.47%相符。本研究表明CD23阳性有助于PMBL与DLBCL-NOS的鉴别诊断,与既往的结果[16]一致。PMBL的分子遗传学特征中BCL-2和BCL-6基因重排少见,而有研究表明BCL-2表达是DLBCL的预后标志物[17]。MUM1/IRF4是干扰素和细胞因子介导基因表达的重要调节剂,在既往的研究中,MUM1与DLBCL的不良预后相关[18],但本研究结果显示MUM1表达对PMBL的总体生存无影响,可能与本研究队列较小有关。CD30和BCL-6的预后价值值得下一步在更大的患者队列中进行验证。
综上所述,PMBL是一种起源于胸腺的成熟的侵袭性大B细胞淋巴瘤,具有独特的临床、免疫表型、基因型和分子特征。PMBL中治疗相关标志物PD-L1、PD-L2和CD30的表达水平较高,有助于识别更多可能对免疫或靶向治疗有反应的患者。免疫组织化学标记PD-L1、PD-L2、CD30和CD23有助于PMBL与DLBCL-NOS鉴别诊断,CD30和BCL-6在PMBL的预后方面显示了一定的趋势,但要作为PMBL的候选预后指标应该在更大量的样本中进一步研究。
作者贡献
袁婷:文献查阅、数据分析与论文撰写
曹铮:免疫组织化学结果判读
刘秀云:免疫组织化学实验操作
郑波:临床资料收集
冯晓莉:整体实验思路设计及论文指导
| [1] |
Liu PP, Wang KF, Xia Y, et al. Racial patterns of patients with primary mediastinal large B-cell lymphoma: SEER analysis[J]. Medicine(Baltimore), 2016, 95(27): e4054. |
| [2] |
Jackson MW, Rusthoven CG, JONES BL, et al. Improved Survival with Combined Modality Therapy in the Modern Era for Primary Mediastinal B-Cell Lymphoma[J]. Am J Hematol, 2016, 91(5): 476-480. DOI:10.1002/ajh.24325 |
| [3] |
Armand P, Rodig S, Melnichenko V, et al. Pembrolizumab in Relapsed or Refractory Primary Mediastinal Large B-Cell Lymphoma[J]. J Clin Oncol, 2019, 37(34): 3291-3299. DOI:10.1200/JCO.19.01389 |
| [4] |
Zinzani PL, Santoro A, Gritti G, et al. Nivolumab Combined With Brentuximab Vedotin for Relapsed/Refractory Primary Mediastinal Large B-Cell Lymphoma: Efficacy and Safety From the PhaseⅡCheckMate 436 Study[J]. J Clin Oncol, 2019, 37(33): 3081-3089. DOI:10.1200/JCO.19.01492 |
| [5] |
Aladily TN, MansourA, AlsughayerA, et al. The utility of CD83, fascin and CD23 in the differential diagnosis of primary mediastinal large B-cell lymphoma versus classic Hodgkin lymphoma[J]. Ann Diagn Pathol, 2019, 40: 72-76. DOI:10.1016/j.anndiagpath.2019.04.009 |
| [6] |
Kim HJ, Kim HK, Park G, et al. Comparative pathologic analysis of mediastinal B-cell lymphomas: selective expression of p63 but no GATA3 optimally differentiates primary mediastinal large B-cell lymphoma from classic Hodgkin lymphoma[J]. Diagn Pathol, 2019, 14(1): 133. DOI:10.1186/s13000-019-0918-x |
| [7] |
Maeshima AM, Taniguchi H, Miyamoto K, et al. Prognostic significance of immunophenotypes and a nodular pattern in primary mediastinal large B-cell lymphoma[J]. Pathol Int, 2014, 64(8): 382-387. DOI:10.1111/pin.12186 |
| [8] |
Dunleavy K, Steidl C. Emerging Biological Insights and Novel Treatment Strategies in Primary Mediastinal Large B-Cell Lymphoma[J]. SeminHematol, 2015, 52(2): 119-125. |
| [9] |
Ng AK. Primary Mediastinal (Thymic) Large B-Cell Lymphoma[M]//Dabaja BS, Ng AK. Radiation Therapy in Hematologic Malignancies: An Illustrated Practical Guide. Cham; Springer International Publishing, 2017: 73-83.
|
| [10] |
Chapuy B, Stewart C, Dunford AJ, et al. Genomic analyses of PMBL reveal new drivers and mechanisms of sensitivity to PD-1 blockade[J]. Blood, 2019, 134(26): 2369-2382. DOI:10.1182/blood.2019002067 |
| [11] |
Mottok A, Hung SS, Chavez EA, et al. Integrative genomic analysis identifies key pathogenic mechanisms in primary mediastinal large B-cell lymphoma[J]. Blood, 2019, 134(10): 802-813. DOI:10.1182/blood.2019001126 |
| [12] |
Duns G, Viganò E, Ennishi D, et al. Characterization of DLBCL with a PMBL gene expression signature[J]. Blood, 2021, 138(2): 136-148. DOI:10.1182/blood.2020007683 |
| [13] |
Tanaka Y, Maeshima AM, Nomoto J, et al. Expression pattern of PD-L1 and PD-L2 in classical Hodgkin lymphoma, primary mediastinal large B-cell lymphoma, and gray zone lymphoma[J]. Eur J Haematol, 2018, 100(5): 511-517. DOI:10.1111/ejh.13033 |
| [14] |
Pierce JMR, Mehta A. Diagnostic, prognostic and therapeutic role of CD30 in lymphoma[J]. Expert Rev Hematol, 2017, 10(1): 29-37. DOI:10.1080/17474086.2017.1270202 |
| [15] |
史倩芸, 冯潇, 陈辉, 等. 原发纵隔大B细胞淋巴瘤27例临床病理特征[J]. 中华病理学杂志, 2017, 46(9): 607-612. [Shi QY, Feng X, Chen H, et al. Primary mediastinal large B-cell lymphoma: a clinicopathologic study of 27 cases[J]. Zhonghua Bing Li Xue Za Zhi, 2017, 46(9): 607-612. DOI:10.3760/cma.j.issn.0529-5807.2017.09.004] |
| [16] |
Calaminici M, Piper K, Lee AM, et al. CD23 expression in mediastinal large B-cell lymphomas[J]. Histopathology, 2004, 45(6): 619-624. DOI:10.1111/j.1365-2559.2004.01969.x |
| [17] |
Li L, Zhang X, Zhang T, et al. Prognostic Significance of BCL-2 and BCL-6 Expression in MYC-positive DLBCL[J]. Clin Lymphoma Myeloma Leuk, 2018, 18(10): e381-e389. DOI:10.1016/j.clml.2018.06.010 |
| [18] |
车江雁, 王宝宏. BCL2, BCL6, MUM1蛋白表达及其与弥漫性大B细胞淋巴瘤预后的关系[J]. 现代医药卫生, 2016, 32(1): 25-27, 30. [Che JY, Wang BH. Expressions of BCL2, BCL6 and MUM1 protein and their relationship with prognosis of diffuse large B cell lymphoma[J]. Xian Dai Yi Yao Wei Sheng, 2016, 32(1): 25-27, 30. DOI:10.3969/j.issn.1009-5519.2016.01.009] |
 2021, Vol. 48
2021, Vol. 48