文章信息
- 淋巴细胞相关炎性反应指标与乳腺癌预后的相关性
- Prognostic Value of Lymphocyte-associated Inflammatory Markers in Breast Cancer
- 肿瘤防治研究, 2020, 47(12): 936-941
- Cancer Research on Prevention and Treatment, 2020, 47(12): 936-941
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.1179
- 收稿日期: 2020-10-12
- 修回日期: 2020-11-04
2. 730050 兰州,中国人民解放军联勤保障部队第九四〇医院肿瘤科
2. Department of Oncology, The 940th Hospital of Joint Logistics Support Force of People's Liberation Army, Lanzhou 730050, China
乳腺癌是女性最常见的恶性肿瘤,是女性癌症死亡的第二大原因[1]。乳腺癌的治疗因分子分型而异,局部手术、放疗以及全身系统治疗可以使70%~80%的早期、非转移性乳腺癌患者被治愈,但晚期转移性乳腺癌的治疗现状仍然不容乐观[2]。因此,找出乳腺癌恶性程度和预后的预测指标对乳腺癌的治疗和结局评估具有重要意义。乳腺癌的预后目前主要依赖于TNM临床分期、组织学分级、激素受体表达和HER2扩增等[3],但这些指标在临床应用时存在显著的异质性,不能重复或动态地评估乳腺癌预后。
研究表明,炎性反应通过改变肿瘤免疫微环境影响恶性肿瘤的增殖、转移和预后[4]。常用的反映机体炎性反应状态的生物学指标有血常规、C反应蛋白(C-reactive protein, CRP)和血沉等。外周血淋巴细胞在机体抗肿瘤的细胞毒性免疫反应中发挥重要作用,也能评估患者的健康状况[5]。有研究报道中性粒细胞淋巴细胞比(neutrophil lymphocyte ratio, NLR)、淋巴细胞单核细胞比(lymphocyte monocyte ratio, LMR)和血小板淋巴细胞比(platelet lymphocyte ratio, PLR)能够预测非小细胞肺癌[6]、胃癌[7]、前列腺癌[8]等恶性肿瘤的预后,但是对乳腺癌预后作用的研究较少。本研究将通过回顾性分析189例乳腺癌患者的病例资料,评估治疗前NLR、LMR、PLR与患者临床病理特征及预后的关系。
1 资料与方法 1.1 研究对象本研究纳入2012年1月1日—2014年12月31日在中国人民解放军联勤保障部队第九四〇医院诊断为乳腺癌的189例女性患者。纳入标准:(1)初诊,经穿刺活检或外科手术由病理证实为浸润性乳腺癌;(2)确诊前未接受任何抗肿瘤治疗;(3)临床病理资料完整,含确诊前1周内的血常规数据;(4)无其他可能影响血常规结果的疾病;(5)随访时间≥5年或在随访期间因乳腺癌死亡。排除标准:(1)确诊前接受过手术、放化疗、内分泌治疗等;(2)合并感染性疾病、血液系统疾病或严重肝肾功能异常;(3)确诊前3月内服用抗生素、糖皮质激素等可能影响血常规结果的药物;(4)合并第二原发恶性肿瘤、双侧乳腺癌;(5)因身体原因或个人意愿未接受规范化治疗;(6)血常规、病理结果等临床资料不全。
1.2 资料收集收集纳入对象的一般资料、临床病理特征、治疗方式以及随访资料。一般资料包括确诊时的年龄;临床病理特征包括TNM临床分期、ER/PR/HER2表达情况、Ki67表达情况、确诊前1周内血常规结果(中性粒细胞数、淋巴细胞数、单核细胞数、血小板数)以及NLR、LMR、PLR;治疗方式包括新辅助化疗、手术、术后辅助化疗、放疗、内分泌治疗;随访资料主要包括是否出现转移、复发或死亡。
1.3 病例随访确诊后2年内,每3月复查1次;确诊后3~5年,每6月复查1次;确诊后5年以上,每年复查1次。如果出现异常情况,及时复查。随访的检查项目包括:血常规、肝肾功能,乳腺、腋窝淋巴结以及腹部超声,胸部CT以及乳腺X线,每年完成一次骨密度检测。随访从确诊日期起至2019年12月,主要采用来院复查和电话等方式进行。失访的病例按照删失值进行统计。OS定义为从患者确诊至随访结束或死亡,PFS定义为从患者确诊至随访结束或肿瘤复发或转移。
1.4 统计学方法应用SPSS22.0软件进行统计学分析。通过ROC曲线获得NLR、LMR、PLR的临界值。通过χ2检验或Fisher’s确切概率法比较临床病理特征。采用Kaplan-Meier法分析OS和PFS,组间比较采用Log rank检验。采用Cox比例风险模型进行多因素分析。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料共纳入189例女性乳腺癌患者,中位年龄49岁(26~75岁)。随访期间死亡32例(16.9%),复发或转移54例(28.6%)。
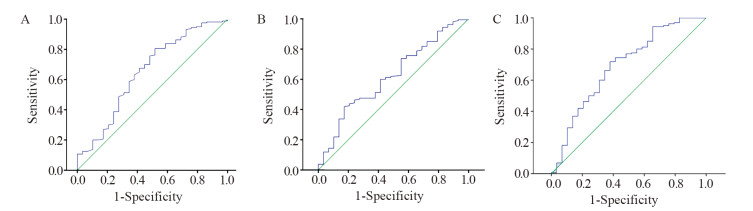
2.2 NLR、LMR和PLR临界值根据治疗前NLR、LMR、PLR与患者预后的比较,绘制出相应ROC曲线,见图 1。ROC曲线显示,治疗前NLR与乳腺癌OS的曲线下面积(AUC)为0.761(95%CI: 0.652~0.870, P=0.000);治疗前LMR与乳腺癌OS的AUC为0.618(95%CI: 0.509~0.728, P=0.043);治疗前PLR与乳腺癌OS的AUC为0.692(95%CI: 0.579~0.804, P=0.001)。治疗前NLR的最佳临界值为2.4,约登指数为0.461,敏感度为0.806,特异度为0.655;治疗前LMR的最佳临界值为5.4,约登指数为0.231,敏感度为0.438,特异性为0.793;治疗前PLR的最佳临界值为113,约登指数为0.265,敏感度为0.575,特异性为0.690。依据NLR、LMR、PLR的最佳临界值,分为高NLR组(NLR≥2.4)与低NLR组(NLR < 2.4)、高LMR组(LMR≥5.4)与低LMR组(LMR < 5.4)、高PLR组(PLR≥113)与低PLR组(PLR < 113)。
|
| NLR: neutrophil lymphocyte ratio; LMR: lymphocyte monocyte ratio; PLR: platelet lymphocyte ratio. 图 1 NLR(A)、LMR(B)、PLR(C)临界值的ROC曲线 Figure 1 Cut-off values of NLR(A), LMR(B) and PLR(C) in ROC curves |
治疗前高NLR组与低NLR组相比,患者在接受新辅助化疗(P=0.026)和手术治疗(P=0.040)方面的差异有统计学意义;治疗前高低LMR组、高低PLR组患者临床病理特征差异均无统计学意义(均P > 0.05),见表 1。
|
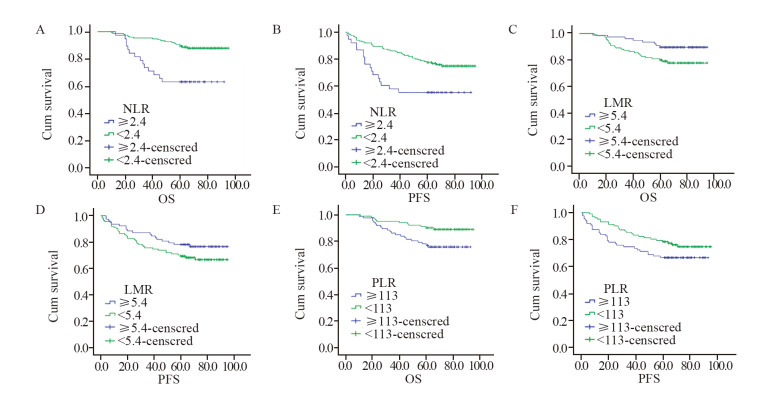
高NLR组患者5年OS及PFS均低于低NLR组(63.2% vs. 89.4%, P=0.000; 55.3% vs. 77.5%, P=0.003);高LMR组患者5年OS高于低LMR组,差异有统计学意义(89.7% vs. 80.2%, P=0.036);高LMR组患者5年PFS高于低LMR组,差异无统计学意义(78.2% vs. 69.4%, P=0.147)。高PLR组患者5年OS低于低PLR组,差异有统计学意义(77.0% vs. 90.2%, P=0.013);高PLR组患者5年PFS低于低PLR组,差异无统计学意义(66.7% vs. 78.4%, P=0.107),见图 2。
|
| 图 2 高低NLR组(A, B)、LMR组(C, D)和PLR组(E, F)乳腺癌患者OS、PFS的Kaplan-Meier分析曲线 Figure 2 Kaplan-Meier analysis of OS and PFS of breast cancer patients in different NLR(A, B), LMR(C, D) and PLR(E, F) groups |
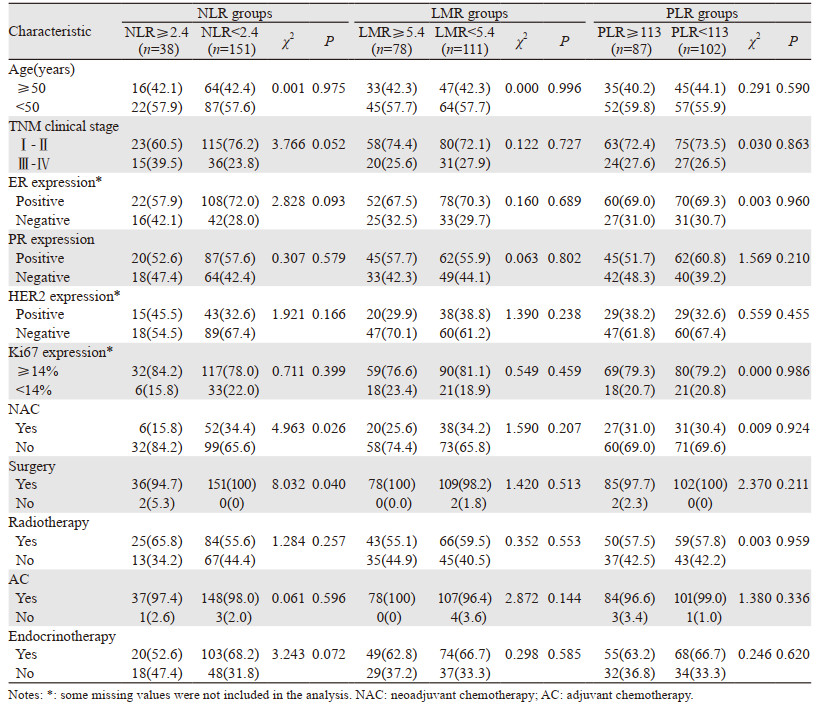
单因素分析结果显示,TNM临床分期、PR表达、NLR、LMR、PLR、手术以及内分泌治疗均与OS有关(均P < 0.05);TNM临床分期、HER2表达、NLR、手术以及内分泌治疗均与PFS有关(均P < 0.05),见表 2。
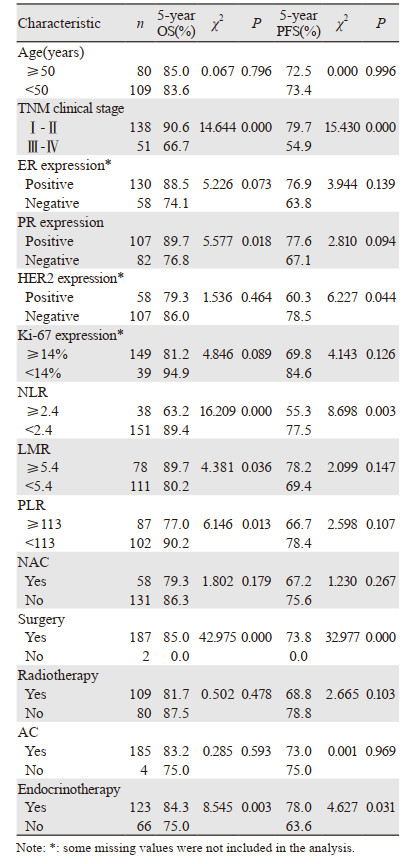
|
将单因素分析中影响OS、PFS的相关性因素纳入Cox比例风险模型进行多因素分析,结果显示TNM临床分期(P=0.003)和NLR(P=0.033)是OS的独立危险因素,患者治疗前NLR水平越高,OS越差。TNM临床分期(P=0.002)是PFS的独立危险因素,手术治疗(P=0.040)是PFS的独立保护因素,见表 3。
有研究表明,反映全身炎性反应状态的多种炎性因子能够作为评估恶性肿瘤预后的生物学标志物[9]。Eggers等[10]研究表明,转移性膀胱癌患者化疗前的CRP水平与患者的临床特征相关。与低CRP患者相比,高CRP患者的中位PFS延长,1年OS更高。格拉斯哥预后评分(Glasgow prognostic score, GPS)是结合CRP和白蛋白预测肿瘤预后的方法,目前已经被证明在非小细胞肺癌、结直肠癌、胃癌、肝癌等恶性肿瘤中具有评估预后的价值[9]。外周血淋巴细胞和CRP也被发现是结直肠癌预后的新指标[11],而外周血的炎性反应指标对乳腺癌患者预后的预测作用仍不明确。本研究全面、系统地回顾了治疗前外周血淋巴细胞相关的炎性反应指标对乳腺癌预后的预测作用。
本研究共纳入189例浸润性乳腺癌患者,分析治疗前NLR、LMR、PLR与临床病理特征的相关性以及其对OS、PFS的预测作用。通过ROC曲线确定NLR、LMR、PLR的最佳临界值分别为2.4、5.4、113。对高低NLR组患者临床病理特征的比较发现,两组患者在新辅助化疗和手术治疗方面差异有统计学意义;高低LMR组和PLR组患者在临床病理特征方面差异无统计学意义。单因素和多因素分析结果表明,TNM临床分期和NLR是OS的独立危险因素;LMR和PLR与OS有显著相关性,但不能作为OS的独立影响因素;TNM临床分期和手术治疗是PFS的独立影响因素;NLR与PFS有显著相关性,但不能作为PFS的独立影响因素;LMR和PLR与PFS无显著相关性。由此可见,NLR、LMR、PLR与乳腺癌的预后密切相关。
TNM临床分期是决定乳腺癌预后的重要因素[3],本研究同样表明,TNM临床分期是乳腺癌患者OS和PFS的独立危险因素。研究还表明,手术治疗是乳腺癌预后的独立保护因素。此外,PR、HER2的表达情况以及内分泌治疗与乳腺癌的预后密切相关,但不是独立影响因素。这些结果意味着PR受体表达、HER2表达以及治疗方法是影响乳腺癌预后的重要因素。
本研究的单因素分析表明,治疗前NLR、PLR水平升高、LMR水平降低均预示着乳腺癌患者的预后不佳,这与炎性细胞在恶性肿瘤中发挥作用的机制相关。外周血淋巴细胞介导细胞毒性免疫反应在机体抗肿瘤过程中发挥重要作用。中性粒细胞通过促进肿瘤细胞增殖[12]、肿瘤血管生成[13]等途径刺激肿瘤的生长,其通过过氧化物酶和精氨酸酶-1的分泌[14-15]抑制包括淋巴细胞、自然杀伤(natural killer, NK)细胞在内的多种免疫细胞的细胞毒性,减弱机体的抗肿瘤免疫反应。单核细胞,尤其是在肿瘤微环境中分化形成的肿瘤相关巨噬细胞能够促进血管生成、抑制免疫反应从而促进肿瘤生长[16]。血小板通过抑制NK细胞裂解肿瘤细胞,从而保护肿瘤细胞、促进肿瘤转移[17]。此外,血小板还能够促进肿瘤细胞产生耐药[18]。因此,NLR、LMR和PLR可以反映机体促肿瘤和抗肿瘤能力的平衡。NLR和PLR越高、LMR越低,机体抗肿瘤能力相对越弱,预后越差。但是,本研究的多因素分析结果显示,NLR是乳腺癌预后的独立危险因素,而LMR和PLR并不是乳腺癌的独立预后因素。这可能是由于本研究存在一定的局限性。
本研究潜在的局限性:(1)单中心的研究,患者主要来自单一省份地区,纳入的患者人数相对较少,可能会增大样本间的异质性,存在一定的偏倚风险;(2)NLR、LMR、PLR临界值的确定,不同研究选择的临界值不完全相同,其预后价值也不尽相同。尽管我们已经采取了绘制ROC曲线的方法尽可能找到最合适的临界值,但是它们的准确性和敏感度可能仍不能满足临床生物标志物应用的要求;(3)纳入的患者中肿瘤进展或患者死亡的比例较低,随访结果可能达不到预期目的。为解决这些局限性的问题,未来需要大规模的前瞻性试验,包括纳入不同地区、不同种族的患者,随访更长时间等,从而进一步确定这些炎性生物标志物的预后价值。
综上所述,治疗前NLR、LMR、PLR与乳腺癌的预后存在显著相关性,但仅NLR是乳腺癌患者预后的独立危险因素,LMR、PLR尚不能作为独立预测因子。治疗前NLR、LMR、PLR可能是预测乳腺癌患者预后的有效生物标志物,值得进行更多大规模的前瞻性研究确定其预后价值。
作者贡献
徐良:设计研究方案,搜集、统计数据,撰写和修改论文
张百红:指导研究方案设计,数据统计,修改论文
| [1] |
DeSantis CE, Ma J, Gaudet MM, et al. Breast cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(6): 438-451. DOI:10.3322/caac.21583 |
| [2] |
Harbeck N, Penault-Llorca F, Cortes J, et al. Breast cancer[J]. Nat Rev Dis Primers, 2019, 5(1): 66. DOI:10.1038/s41572-019-0111-2 |
| [3] |
Giuliano AE, Connolly JL, Edge SB, et al. Breast Cancer-Major changes in the American Joint Committee on Cancer eighth edition cancer staging manual[J]. CA Cancer J Clin, 2017, 67(4): 290-303. DOI:10.3322/caac.21393 |
| [4] |
Deshmukh SK, Srivastava SK, Poosarla T, et al. Inflammation, immunosuppressive microenvironment and breast cancer: opportunities for cancer prevention and therapy[J]. Ann Transl Med, 2019, 7(20): 593. DOI:10.21037/atm.2019.09.68 |
| [5] |
Criscitiello C, Esposito A, Trapani D, et al. Prognostic and predictive value of tumor infiltrating lymphocytes in early breast cancer[J]. Cancer Treat Rev, 2016, 50: 205-207. DOI:10.1016/j.ctrv.2016.09.019 |
| [6] |
Zhang N, Jiang J, Tang S, et al. Predictive value of neutrophil-lymphocyte ratio and platelet-lymphocyte ratio in non-small cell lung cancer patients treated with immune checkpoint inhibitors: A meta-analysis[J]. Int Immunopharmacol, 2020, 85: 106677. DOI:10.1016/j.intimp.2020.106677 |
| [7] |
Zhang X, Zhao W, Yu Y, et al. Clinicopathological and prognostic significance of platelet-lymphocyte ratio (PLR) in gastric cancer: an updated meta-analysis[J]. World J Surg Oncol, 2020, 18(1): 191. DOI:10.1186/s12957-020-01952-2 |
| [8] |
Peng H, Luo X. Prognostic significance of elevated pretreatment systemic inflammatory markers for patients with prostate cancer: a meta-analysis[J]. Cancer Cell Int, 2019, 19: 70. DOI:10.1186/s12935-019-0785-2 |
| [9] |
McMillan DC. The systemic inflammation-based Glasgow Prognostic Score: a decade of experience in patients with cancer[J]. Cancer Treat Rev, 2013, 39(5): 534-540. DOI:10.1016/j.ctrv.2012.08.003 |
| [10] |
Eggers H, Seidel C, Schrader AJ, et al. Serum C-reactive protein: a prognostic factor in metastatic urothelial cancer of the bladder[J]. Med Oncol, 2013, 30(4): 705. DOI:10.1007/s12032-013-0705-6 |
| [11] |
Okugawa Y, Toiyama Y, Yamamoto A, et al. Lymphocyte-C-reactive Protein Ratio as Promising New Marker for Predicting Surgical and Oncological Outcomes in Colorectal Cancer[J]. Ann Surg, 2020, 272(2): 342-351. DOI:10.1097/SLA.0000000000003239 |
| [12] |
Kerros C, Tripathi SC, Zha D, et al. Neuropilin-1 mediates neutrophil elastase uptake and cross-presentation in breast cancer cells[J]. J Biol Chem, 2017, 292(24): 10295-10305. DOI:10.1074/jbc.M116.773051 |
| [13] |
Li TJ, Jiang YM, Hu YF, et al. Interleukin-17-Producing Neutrophils Link Inflammatory Stimuli to Disease Progression by Promoting Angiogenesis in Gastric Cancer[J]. Clin Cancer Res, 2017, 23(6): 1575-1585. DOI:10.1158/1078-0432.CCR-16-0617 |
| [14] |
Yee PP, Wei Y, Kim SY, et al. Neutrophil-induced ferroptosis promotes tumor necrosis in glioblastoma progression[J]. Nat Commun, 2020, 11(1): 5424. DOI:10.1038/s41467-020-19193-y |
| [15] |
Rotondo R, Bertolotto M, Barisione G, et al. Exocytosis of azurophil and arginase 1-containing granules by activated polymorphonuclear neutrophils is required to inhibit T lymphocyte proliferation[J]. J Leukoc Biol, 2011, 89(5): 721-727. DOI:10.1189/jlb.1109737 |
| [16] |
Trac N, Chen LY, Zhang A, et al. CCR2-targeted micelles for anti-cancer peptide delivery and immune stimulation[J]. J Control Release, 2020, S0168-3659(20): 30570-30578. |
| [17] |
Clar KL, Hinterleitner C, Schneider P, et al. Inhibition of NK Reactivity Against Solid Tumors by Platelet-Derived RANKL[J]. Cancers (Basel), 2019, 11(3): 277. DOI:10.3390/cancers11030277 |
| [18] |
Xu SS, Xu HX, Wang WQ, et al. Tumor-infiltrating platelets predict postoperative recurrence and survival in resectable pancreatic neuroendocrine tumor[J]. World J Gastroenterol, 2019, 25(41): 6248-6257. DOI:10.3748/wjg.v25.i41.6248 |
 2020, Vol. 47
2020, Vol. 47