文章信息
- 安罗替尼二线治疗广泛期小细胞肺癌的临床疗效
- Clinical Efficacy of Anlotinib as Second-line Treatment on Patients with Extensive Small Cell Lung Cancer
- 肿瘤防治研究, 2020, 47(12): 953-957
- Cancer Research on Prevention and Treatment, 2020, 47(12): 953-957
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0369
- 收稿日期: 2020-04-17
- 修回日期: 2020-07-20
2. 350001 福州,中国人民解放军联勤保障部队第九〇〇医院肿瘤科;
3. 362000 泉州,中国人民解放军联勤保障部队第九一〇医院肿瘤科
2. Department of Oncology, The 900th Hospital of Joint Logistics Support Force of Chinese People's Liberation Army, Fuzhou 350001, China;
3. Department of Oncology, The 910th Hospital of Joint Logistics Support Force of Chinese People's Liberation Army, Quanzhou 362000, China
肺癌分为非小细胞肺癌和小细胞肺癌(small cell lung cancer, SCLC),SCLC具有肿瘤细胞倍增时间短、恶性程度高、早期转移、化放疗敏感、易耐药等特点,临床上治疗效果和预后欠佳[1-2]。化疗是目前广泛期SCLC患者最佳治疗手段,标准一线化疗方案是足叶乙甙联合铂类或伊立替康联合铂类,为广泛期SCLC患者带来一定的临床获益,但几乎所有患者均在1年内复发。选择二线补救治疗的重要因素是一线治疗的疗效和有效的持续时间,根据上述因素将二线化疗分成三组:难治性复发、耐药复发和敏感复发[3]。难治性复发指复发时间 < 3月,二线治疗可选择紫杉醇、多西他赛、拓扑替康等,有效率为2%~7%;耐药复发指复发时间为3~6月,二线方案可选择拓扑替康(1级)、紫杉醇、多西他赛、吉西他滨等,有效率为10%~14%;敏感复发指复发时间 > 6月,二线方案可继续原始方案化疗,有效率为20%~40%[4-6]。二线化疗患者总存期(overall survival, OS)为4~6月,且化疗不良反应大,需反复住院行静脉化疗,患者满意度低。本研究旨在通过对30例安罗替尼二线治疗铂类联合化疗耐药的广泛期SCLC患者的回顾性分析,为广泛期SCLC治疗提供一定的临床依据。
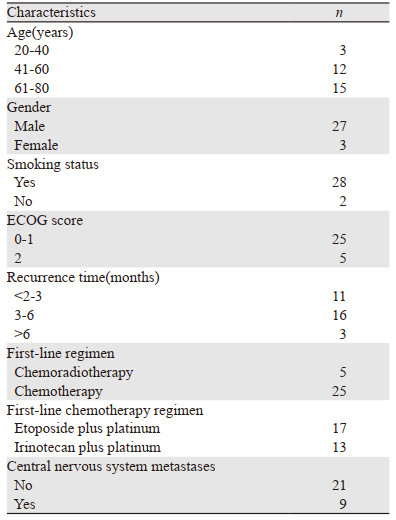
1 资料与方法 1.1 临床资料回顾性分析2018年7月—2019年7月福建医科大学附属第二医院、中国人民解放军联勤保障部队第九〇〇医院、中国人民解放军联勤保障部队第九一〇医院收治的30例接受安罗替尼二线治疗的广泛期SCLC患者临床资料。纳入标准:(1)病理组织确诊SCLC,结合影像学诊断为广泛期SCLC;(2)既往一线使用足叶乙甙联合铂类或伊立替康联合铂类的化疗方案出现进展,且无放疗适应证;(3)患者拒绝拓扑替康、紫杉醇、多西他赛等二线化疗,签署知情同意书选择安罗替尼姑息治疗;(4)美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分≤2分,心电图、血常规、生化、凝血功能无治疗禁忌证;(5)根据实体瘤RECIST1.1标准,有影像学(CT或PET-CT或MRI)可测量的临床观察病灶。排除标准:(1)活动性出血患者,包括消化道出血、肺咯血、脑部转移病灶出血等;(2)使用三联降压药,血压仍无法控制在140/90 mmHg以内的患者;(3)排除病理组织为复合型小细胞癌患者。本研究通过福建医科大学附属第二医院伦理委员会批准。具体资料见表 1。
|
安罗替尼(商品名:福可维)每次12 mg,每日1次,早餐前口服,连续服药2周,停药1周,3周为一周期,每两周期后进行一次疗效评价。如果出现不良反应分级标准4.0版(CTC AE4.0)规定的3/4级不良反应及大于2级的出血不良反应,考虑与药物有关,给予对症处理及剂量调整。第一次调整剂量为10 mg,第二次调整剂量为8 mg。如8 mg剂量无法耐受,则永久停药。
1.2.2 评价标准安罗替尼的疗效评价按照实体瘤RECIST1.1标准进行,分为完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、疾病稳定(stable disease, SD)和疾病进展(progression disease, PD);客观缓解率(objective response rate, ORR)为(CR+PR)例数/总例数,疾病控制率(disease control rate, DCR)为(CR+PR+SD)例数/总例数。不良反应按CTC AE 4.0评价。
1.2.3 随访患者均以门诊、住院、电话、微信形式随访,随访终点为死亡,随访截止时间为2020年3月1日,中位随访时间为9(3~12)月,无失访病例。
1.3 统计学方法本研究数据均采用SPSS23.0软件进行统计分析,采用Kaplan-Meier法进行生存分析。
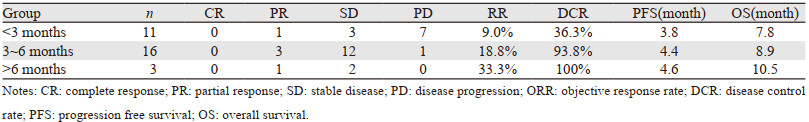
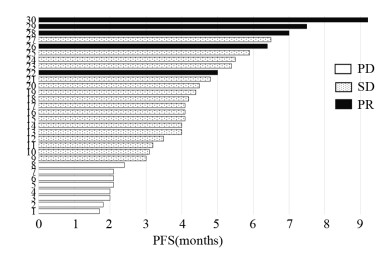
2 结果 2.1 近期疗效平均每例患者口服安罗替尼5.4周期,30例患者ORR为16.7%(5/30),DCR为73.3%(22/30),见表 2、图 1。
|
|
| 图 1 30例接受安罗替尼二线治疗的广泛期SCLC患者治疗时间与疗效瀑布图 Figure 1 Waterfall diagram of treatment time and efficacy in 30 extensive small cell lung cancer patients treated with anlotinib as second-line treatment |
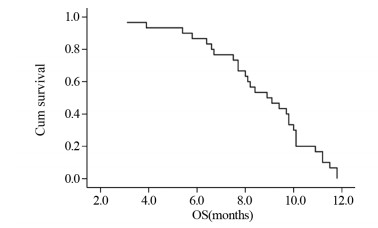
截至随访终点,30例患者已全部死亡,无进展生存期(progression free survival, PFS)为4.2月,OS为8.6月,见图 2。其中复发时间 < 3月患者,PFS为3.8月,OS为7.8月;复发时间3~6月患者,PFS为4.4月,OS为8.9月;复发时间 > 6月患者,PFS为4.6月,OS为10.5月,见表 2。另外入组的9例SCLC脑转移患者,4例患者治疗前已行脑部姑息性放疗;9例脑转移患者PFS为3.5月,OS为7.9月。
|
| 图 2 30例接受安罗替尼二线治疗的广泛期SCLC患者生存曲线 Figure 2 Survival curve of 30 extensive small cell lung cancer patients treated with anlotinib as second-line treatment |
30例患者中16.7%(5/30)发生第一次剂量下调,其中不良反应是高血压2例、尿蛋白1例、疲劳乏力1例、手足综合征1例;6.7%(2/30)出现第二次剂量下调,其中不良反应是高血压1例、尿蛋白1例;3.3%(1/30)患者因高血压无法控制予以永久停药。无安罗替尼相关的死亡事件,大部分患者在剂量下调或对症处理后能够耐受安罗替尼引起的不良反应。
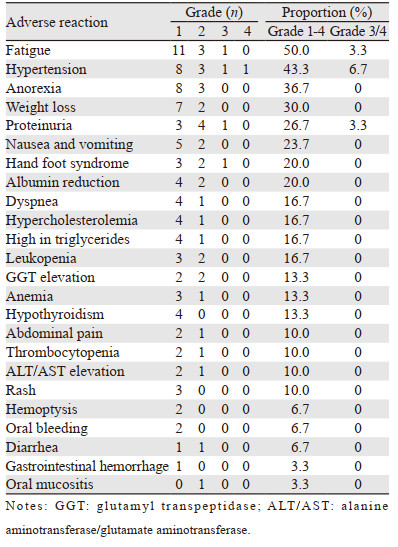
30例患者中最常见不良反应为疲劳乏力、高血压、厌食、体重减轻、尿蛋白、恶心呕吐、白蛋白降低、手足综合征等,其中3/4级不良反应主要是高血压(2例)、疲劳乏力(1例)、尿蛋白(1例)、手足综合征(1例),3级及以上不良反应发生率为16.7%(5/30),见表 3。
|
SCLC作为难治性恶性肿瘤,突破性药物非常匮乏,前期的化疗新药氨柔比星及吡铂在Ⅲ期临床试验中均失败;而免疫药物Atezolizumab联合化疗在SCLC的一线治疗中取得了一定成功(Impower-133临床试验)[7],总生存期延长2月,曾经让免疫治疗看到希望。但在二线免疫治疗晚期SCLC各大临床研究中,无论是Nivolumab的Ⅲ期CheckMate 331研究[8]、Atezolizumab的Ⅱ期IFCT-1603研究[9],还是Keytruda的Ⅱ期KEYNOTE-158研究[1]均以失败告终,小细胞肺癌的治疗再次进入困境。安罗替尼是一种新开发的多受体酪氨酸激酶的口服小分子抑制剂[10],作用靶点为VEGFR1、VEGFR2、VEGFR3、c-Kit、PDGFR-α、FGFR1、FGFR2及FGFR3,可抑制肿瘤血管生成和肿瘤细胞增殖[11-15]。国内的《CSCO原发性肺癌诊疗指南》基于程颖教授ALTER1202研究[16]的结果,推荐安罗替尼作为SCLC三线及以上治疗的Ⅱ级推荐(2A类证据),安罗替尼成为目前在中国唯一一个获批的SCLC治疗新药。
本研究分析安罗替尼二线治疗SCLC患者,共入选30例患者,ORR为16.7%(5/30),DCR为73.3%(22/30),PFS为4.2月,OS为8.6月。程颖教授[16]开展的安罗替尼三线及三线以上治疗广泛期SCLC的Ⅱ期临床试验(ALTER1202研究),安罗替尼的ORR为4.9%,DCR为71.6%,PFS为4.1月,OS为7.3月。本研究与ALTER1202试验数据[16]相比,二线治疗的ORR明显优于三线治疗,且PFS也优于三线治疗,提示二线使用安罗替尼,能更好地缓解肿瘤负荷及症状。2001年德国von Pawel教授[17]牵头的口服拓扑替康对比静脉注射拓扑替康的二线治疗广泛期SCLC的随机、多中心Ⅱ期临床试验,纳入复发时间 > 3月的患者,ORR分别为23%和15%,OS分别为8.0和6.2月。与上述标准二线化疗比较可发现,安罗替尼二线治疗的疗效不劣于标准拓扑替康。
本研究中,难治性复发患者(复发时间 < 2~3月)ORR为9%,OS为7.8月;耐药复发患者(复发时间 < 3月)ORR为18.8%,OS为8.9月;敏感复发患者(复发时间 > 6月)ORR为33.3%,OS为10.5月。既往的拓扑替康二线化疗研究中,耐药复发患者对拓扑替康的缓解率为14%~38%,OS为4~9月;而难治性复发患者缓解率仅为2%~7%,OS为4~5月[17-18]。提示与拓扑替康二线化疗相比,安罗替尼在治疗难治性复发患者可能效果更好;同时安罗替尼二线治疗敏感复发患者具有较高的缓解率及较长的OS,值得进一步研究。另外,本研究9例SCLC脑转移患者中,4例患者治疗前已行脑部姑息性放疗;PFS为3.6月,OS为7.9月。在ALTER1202临床试验[15]中,亚组分析提示脑转移患者PFS为3.8月,OS为6.3月。本研究的结果及ALTER1202结果,与既往的拓扑替康二线化疗脑转移患者OS 4.5月相比,安罗替尼显著延长SCLC脑转移患者生存时间。
本研究出现剂量下调的不良反应主要是疲劳乏力、高血压、尿蛋白、手足综合征,1例患者因高血压无法控制予以永久停药,3/4级不良反应发生率为16.7%。在ALTER1202研究[16]中,安罗替尼最常见的不良反应为高血压、厌食、乏力、手足综合征等,3/4级不良反应发生率为35.8%,5%患者因不良反应永久停药。与ALTER1202对比,本研究中3/4级不良反应相对较低,可能与患者未接受二线化疗,总体体力状态、肝肾功能及骨髓功能较好有关,也提示安罗替尼二线使用安全性相对较高。而作为标准二线化疗的拓扑替康[17],口服拓扑替康和静脉使用拓扑替康4级不良反应发生率为35.3%和67.3%。提示安罗替尼二线治疗广泛期SCLC安全性较高。
综上所述,安罗替尼二线治疗广泛期SCLC患者疗效确切、安全性较高、口服方便、无需住院治疗。对于拒绝静脉化疗或者畏惧化疗的SCLC患者,如经济条件允许可考虑口服靶向药物安罗替尼二线治疗。同时,本研究不足之处为回顾性分析且样本量较小,下一步可考虑开展前瞻性、大样本临床研究来进一步验证上述结果。
作者贡献
林建光:选题设计,数据收集,文章撰写和修改
陈平:数据收集
解方为、蔡忠福:提供病例资料
许天文:指导选题与设计
| [1] |
Chung HC, Piha-Paul SA, Lopez-Martin J, et al. Pembrolizumab After Two or More Lines of Previous Therapy in Patients With Recurrent or Metastatic SCLC: Results From the KEYNOTE-028 and KEYNOTE-158 Studies[J]. J Thorac Oncol, 2020, 15(4): 618-627. DOI:10.1016/j.jtho.2019.12.109 |
| [2] |
Lo Russo G, Macerelli M, Platania M, et al. Small-Cell Lung Cancer: Clinical Management and Unmet Needs New Perspectives for an Old Problem[J]. Curr Drug Targets, 2017, 18(3): 341-362. DOI:10.2174/1389450117666160502152331 |
| [3] |
Kalemkerian GP, Loo BW, Akerley W, et al. NCCN Guidelines Insights: Small Cell Lung Cancer, Version 2.2018[J]. J Natl Compr Canc Netw, 2018, 16(10): 1171-1182. DOI:10.6004/jnccn.2018.0079 |
| [4] |
Baize N, Monnet I, Greillier L, et al. Second-line treatments of small-cell lung cancers[J]. Expert Rev Anticancer Ther, 2017, 17(11): 1033-1043. DOI:10.1080/14737140.2017.1372198 |
| [5] |
张也, 张艳, 贾刚. 小细胞肺癌的治疗现状及进展[J]. 中国医药指南, 2019, 17(26): 23-25, 29. [Zhang Y, Zhang Y, Jia G. Current Status and Progress in the Treatment of Small Cell Lung Cancer[J]. Zhongguo Yi Yao Zhi Nan, 2019, 17(26): 23-25, 29.] |
| [6] |
Zhao Y, Wan B, Zhang T, et al. Irinotecan, topotecan, paclitaxel or docetaxel for second-line treatment of small cell lung cancer: a single-center retrospective study of efficiency comparation and prognosis analysis[J]. Transl Lung Cancer Res, 2019, 8(6): 829-837. DOI:10.21037/tlcr.2019.10.21 |
| [7] |
Pacheco J, Bunn PA. Advancements in Small-cell Lung Cancer: The Changing Landscape Following IMpower-133[J]. Clin Lung Cancer, 2019, 20(3): 148-160. DOI:10.1016/j.cllc.2018.12.019 |
| [8] |
Reck M, Vicente D, Ciuleanu T, et al. Efficacy and safety of nivolumab (nivo) monotherapy versus chemotherapy (chemo) in recurrent small cell lung cancer (SCLC): Results from CheckMate 331[J]. Ann Oncol, 2018, 29: x43. https://www.sciencedirect.com/science/article/pii/S0923753419327619.
|
| [9] |
Pujol JL, Greillier L, Audigier-Valette C, et al. A Randomized Non-Comparative Phase Ⅱ Study of Anti-Programmed Cell Death-Ligand 1 Atezolizumab or Chemotherapy as Second-Line Therapy in Patients With Small Cell Lung Cancer: Results From the IFCT-1603 Trial[J]. J Thorac Oncol, 2019, 14(5): 903-913. DOI:10.1016/j.jtho.2019.01.008 |
| [10] |
Chen DF, Xu JL, Zhao YZ, et al. Prognostic value of tumor cavitation in extensive-stage small-cell lung cancer patients treated with anlotinib[J]. J Cancer Res Clin Oncol, 2020, 146(2): 401-406. DOI:10.1007/s00432-019-03064-1 |
| [11] |
Lin B, Song X, Yang D, et al. Anlotinib inhibits angiogenesis via suppressing the activation of VEGFR2, PDGFRbeta and FGFR1[J]. Gene, 2018, 654: 77-86. DOI:10.1016/j.gene.2018.02.026 |
| [12] |
Shen GS, Zheng FC, Ren DF, et al. Anlotinib: a novel multi-targeting tyrosine kinase inhibitor in clinical development[J]. J Hematol Oncol, 2018, 11(1): 120. DOI:10.1186/s13045-018-0664-7 |
| [13] |
Syed YY. Anlotinib: First Global Approval[J]. Drugs, 2018, 78(10): 1057-1062. DOI:10.1007/s40265-018-0939-x |
| [14] |
Xie CY, Wan XZ, Quan HT, et al. Preclinical characterization of anlotinib, a highly potent and selective vascular endothelial growth factor receptor-2 inhibitor[J]. Cancer Sci, 2018, 109(4): 1207-1219. DOI:10.1111/cas.13536 |
| [15] |
Zhong CC, Chen F, Yang JL, et al. Pharmacokinetics and disposition of anlotinib, an oral tyrosine kinase inhibitor, in experimental animal species[J]. Acta Pharmacol Sin, 2018, 39(6): 1048-1063. DOI:10.1038/aps.2017.199 |
| [16] |
Cheng Y, Wang Q, Li K, et al. OA13.03 Anlotinib as Third-Line or Further-Line Treatment in Relapsed SCLC: A Multicentre, Randomized, Double-Blind Phase 2 Trial[J]. J Thorac Oncol, 2018, 13(10): S351-S352. |
| [17] |
von Pawel J, Gatzemeier U, Pujol JL, et al. Phase ii comparator study of oral versus intravenous topotecan in patients with chemosensitive small-cell lung cancer[J]. J Clin Oncol, 2001, 19(6): 1743-1749. DOI:10.1200/JCO.2001.19.6.1743 |
| [18] |
Ardizzoni A, Hansen H, Dombernowsky P, et al. Topotecan, a new active drug in the second-line treatment of small-cell lung cancer: a phase Ⅱ study in patients with refractory and sensitive disease. The European Organization for Research and Treatment of Cancer Early Clinical Studies Group and New Drug Development Office, and the Lung Cancer Cooperative Group[J]. J Clin Oncol, 1997, 15(5): 2090-2096. DOI:10.1200/JCO.1997.15.5.2090 |
 2020, Vol. 47
2020, Vol. 47


