文章信息
- 功能化PSMA在前列腺癌核素靶向治疗中的研究进展
- Recent Progress of Functionalized PSMA in Radionuclide Targeted Therapy for Prostate Cancer
- 肿瘤防治研究, 2020, 47(12): 975-979
- Cancer Research on Prevention and Treatment, 2020, 47(12): 975-979
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0353
- 收稿日期: 2020-04-10
- 修回日期: 2020-08-21
2. 550025 贵阳,贵州大学医学院
2. School of Medicine, Guizhou University, Guiyang 550025, China
前列腺癌(prostate cancer, PCa)是男性最常见的癌症之一,其发生位置隐匿,早期缺乏特异性,多涉及骨或淋巴结转移[1]。前列腺特异性膜抗原(prostate specific membrane antigen, PSMA)是前列腺癌诊疗的重要靶点。靶向PSMA放射性核素标记的脲基衍生物在前列腺癌中的临床研究进展迅速。其中177Lu-PSMA-617是PSMA放射性配体治疗(PSMA radioligand therapy, PRLT)中最常用的配体,在转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer, mCRPC)病变中有特异性的浓聚,同时,在肾脏、泪腺、唾液腺和近端小肠中也有不同程度的高摄取[2-3]。作为小分子化合物,PSMA-617在血液中代谢半衰期较短,靶器官摄取受限,有效剂量较低导致需要使用高剂量或更频繁的治疗,增加了不良反应的可能性。
为提高核素使用效率,延长PSMA靶向分子的体内代谢时间,对PSMA分子探针进行功能化修饰引起了大量的关注。一种延缓药物清除速度的化学修饰是添加聚乙二醇(polyethylene glycol, PEG)[4],可以获得更高的肿瘤摄取;随着可逆性白蛋白结合剂伊文思蓝(Evans blue, EB)和4-(p-碘苯基)丁酸衍生物被用于修饰药代动力学,以提高治疗效果,功能化PSMA探针在前列腺癌放射性靶向治疗的研究也取得了系列进展[5]。功能化PSMA探针经治疗性放射性核素标记后不仅改善了PSMA小分子抑制剂在肿瘤体内的代谢行为,而且有望通过减少患者的治疗次数和降低注射剂量提高肿瘤抑制效率,降低肾脏、肝脏或骨髓毒性,以安全高效的提高前列腺癌,尤其是mCRPC患者的治疗疗效。本文针对近年来几种修饰分子(化学结构如图 1所示)功能化PSMA分子探针在前列腺癌核素靶向治疗中显著进展,特别注重其中的临床转化结果,进行综述,以期会有更多功能化PSMA分子探针步入临床研究,以精准、高效地为前列腺癌及其他肿瘤患者提供治疗。
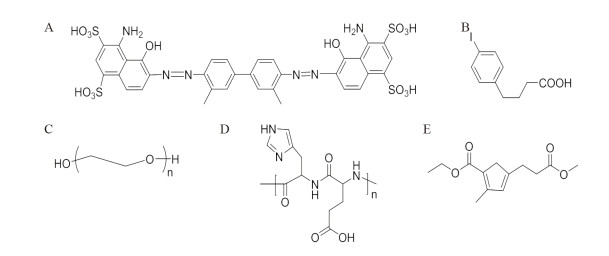
|
| A: Chemical structure of Evans blue (EB); B: Chemical structure of 4-(p-iodophenyl) butyric acid; C: Chemical structure of Polyethylene glycol (PEG); D: Chemical structure of-(HE)n-(n=1-3); E: Chemical structure of Cyclopentadiene (Cp) ligands 图 1 用于功能化修饰PSMA分子探针的分子的化学结构 Figure 1 Chemical structures of modifying molecules to functionalize the PSMA molecular probes |
结合位点1是白蛋白在血液循环中携带和传递小分子的重要口袋。与该位点结合的分子通常在中间含有亲脂芳香结构,并被负电荷球形包围[6]。EB是一种具有该芳香结构的偶氮染料,它与白蛋白的结合位点1具有很高的亲和力(Kd=2.5 μM),见图 1A[6]。是许多生理和临床研究的重要工具,并作为一种测定患者血浆容量的方法在临床实践中使用,也被用于观察血脑屏障(blood-brain barrier, BBB)的完整性[7]。截断EB可以实现功能化,如68Ga-NEB用于正电子发射断层显像(positron emission tomography, PET),药代动力学和成像质量显著提高,具有鉴别肝血管瘤与其他肝良性或恶性局灶性病变的潜力[8];64Cu/90Y放射标记的NMEB-RGD和DMEB-RGD PET成像显示血液循环半衰期明显延长和肿瘤摄取增加[9]。这些研究表明,优化的EB衍生物能显著改善药物在体内的药代动力学特性,为分子探针靶向治疗癌症提供了良好的应用前景。
1.2 EB-PSMA的临床前研究MCG((((R)-1-carboxy-2-mcercaptoethyl)carbamoyl)-L-glutamic acid)是一种与PSMA非常相似的酶,基于这种相似性,Wang等[10]将tEB(truncated Evans Blue)与螯合剂DOTA(1, 4, 7, 10-tetraazacyclododecane-N, N, N, N-tetraacetic acid)结合到MCG上,用86Y进行放射性标记得到86Y-DOTA-EB-MCG,其PET显像具有明显的肿瘤摄取。注入7.4 MBq的90Y-DOTA-EB-MCG能显著降低PSMA阳性异种移植瘤的生长,但也存在较高的肾脏摄取。
随后,该研究组将PSMA-617共价连接到该种EB衍生物上制得EB-PSMA-617。EB-PSMA-617在肿瘤细胞中具有更好的内化作用和滞留效果。单次注射1.85 MBq的90Y-或3.7 MBq的177Lu-EB-PSMA-617就足以根除小鼠中PMSA阳性肿瘤。重要的是,EB修饰将血液半衰期延长至数小时,病理和血液分析均未观察到肾脏、肝脏或骨髓毒性,显示出其安全高效的治疗前列腺癌潜力[11]。
1.3 EB-PSMA的临床转化EB功能化PSMA分子探针的研究还在不断探索和优化中,其在临床中的研究也在推进。Zang等[12]就对mCRPC患者使用单次低剂量177Lu-EB-PSMA-617的安全性、剂量测定和治疗反应进行了临床研究。选取SUVmax基线值在10.0~15.0之间的骨转移瘤进行对比,177Lu-EB-PSMA-617在mCRPC患者中的放射积累约为177Lu-PSMA-617的3.02倍,单次低剂量给药对mCRPC患者具有一定的治疗效果。低剂量给药时,177Lu-EB-PSMA-617在红骨髓和肾脏中吸收升高但耐受较好。虽然该研究存在样本量少和观察时间短的不足,但它为进一步研究mCRPC患者治疗剂量调整奠定了基础,也为弥漫性骨髓受累患者的研究提供了实质性的建议。
EB及其衍生物技术用于优化PSMA分子探针在前列腺癌中的应用取得了阶段性的进步,更多易于合成、正常器官耐受良好的靶向PSMA分子探针有待开发。一种理想的二价伊文思蓝衍生物,即N(tEB)2,可以显著延长载体和水溶性药物的循环半衰期,同时保持EB染料的高亲和力以及保护药物在循环过程中不被酶降解。这可能为白蛋白结合分子(Albumin binding moieties, ABMs)与代谢不稳定化合物的结合打开了大门。而且N(tEB)2也表现出在肿瘤组织中积累的倾向,为肿瘤靶向药物/放射性核素治疗提供了潜在的应用[13]。相信N(tEB)2和更多其他靶向PSMA配体用于前列腺癌及其他癌症生物系统的研究也会陆续报道。
2 基于4-(p-碘苯基)丁酸功能化PSMA用于前列腺癌的诊疗研究 2.1 4-(p-碘苯基)丁酸与白蛋白作用机制在白蛋白中,与位点2结合的大多数是亲脂羧酸衍生物。4-(p-碘苯基)丁酸是由Neri团队[14]从DNA编码的化学文库中首次发现并鉴定的,它们与白蛋白结合位点2具有稳定的非共价相互作用,其基本结构为4-苯基丁酸基,苯环上有不同的疏水取代基,见图 1B。该研究采用其中一种衍生物作为白蛋白结合剂证明可将药物制剂的体内循环半衰期提高100倍以上。所以其在白蛋白结合剂,特别是血液循环半衰期长的前药的产生,治疗性蛋白和多肽的药代动力学性质的改善,以及血池造影剂中的应用具有巨大的潜力。
2.2 4-(p-碘苯基)丁酸-PSMA的临床前研究Kelly等[15]报道了第一类以PSMA为靶点的4-(p-碘苯基)丁酸白蛋白结合基序共轭谷氨酸脲基衍生物131I-RPS-027。在前列腺癌的临床前研究中,131I-RPS-027显示对PSMA和白蛋白的双重靶向性,具有肿瘤摄取高、肾脏吸收低等良好的生物分布结果。
由于RPS-027无法独立修饰PSMA和白蛋白结合以及I-131应用于治疗的局限性,Kelly等[16]又开发出一种177Lu标记的含谷氨酸脲基、4-碘苯基和聚乙二醇(PEGn)(n=0、3、4、6、8或12)连接螯合剂DOTA的三功能配合物。与177Lu-PSMA-617相比,这种配合物具有更高的肿瘤摄取,其中177Lu-RPS-063(PEG3)摄取值最高(注射后4 h达30.0±6.9% ID/g),但也预示着向肿瘤提供的剂量将更大(高达4倍)。
另外,4-(p-碘苯基)-丁酸修饰的基于氨基磷酸脂PSMA抑制剂的CTT1403中白蛋白结合部分为PSMA抑制剂支架提供了明显的优势,包括增加循环半衰期和前列腺肿瘤摄取。在PSMA阳性人肿瘤异种移植物模型中具有优越的治疗效果,表现为肿瘤生长前3周内体积减少90%~95%,中位生存期超过120天[17]。
然而,CTT1403所使用的基于氨基磷酸脂的PSMA结合物稳定性有限,177Lu需要采用多步骤标记方法,为临床应用带来一定的难度。177Lu-PSMA-ALB-02作为一种新的无需进一步纯化即可直接使用的PSMA配合物,与177Lu-CTT1403相比具有更明显的免疫特性,即在相同时间内具有更低的血液活性和更快的血液清除速率;与177Lu-PSMA-617相比,血液循环延长使肿瘤摄取显著增加。根据药-时曲线下面积(area under curve,AUC)计算,肿瘤平均吸收剂量约增加一倍[18],可降低给药频率,有助于提高患者生活质量。而且制备活性较低的放射性配体可能有利于防止化合物的辐射降解,从而提高这类新型放射性配体的保质期。
3 PEG及其他修饰方法 3.1 PEG修饰原理聚乙二醇(PEG)是经美国FDA(Food and Drug Administration)批准的极少数能作为体内注射药用的合成聚合物之一,见图 1C。PEG具有高度的亲水性,当偶联到药物分子或药物表面时,可以将其优良性质赋予修饰后的药物分子,改变它们在水溶液中的生物分配行为和溶解性,在修饰的药物周围产生空间屏障,减少药物的酶解,避免在肾脏的代谢中很快消除,并使药物能被免疫系统的细胞识别。
3.2 PEG修饰增加血液清除前已述及,经PEG修饰的三功能配合物具有更高的肿瘤摄取。当改变RPS-063中的白蛋白结合基团并插入PEG8时,延长的PEG连接剂巧妙地增加了血液和肾脏清除,并且不会影响肿瘤的吸收或滞留[19]。
基于PEG修饰、68Ga标记的用于前列腺癌靶向成像的小分子药物NO3A-DM1-Lys-Urea-Glu的小动物PET显像显示,注射后1小时,PSMA阳性PC3-PIP肿瘤的摄取值(4.30±0.20% ID/g)明显高于PSMA阴性PC3-Flu肿瘤(1.12±0.42% ID/g)的摄取值[20]。
另外,也有报道PEG修饰脂质体功能化PSMA的应用。一种以阿霉素为载体,用99mTc放射性核素标记的由PSMA配体(PSMAL)、聚乙二醇(PEG2000)和棕榈酸酯组成的脂聚合物(P3)显示在PSMA阳性人前列腺癌细胞(LNCaP)中的摄取显著增加,IC50值降低了约5倍,而对PSMA阴性PC3细胞的毒性较小。这说明具有PSMA结合基序(如PSMAL)的脂质体的表面功能化,可以为PSMA阳性前列腺癌的诊疗提供可行的方法[21]。
3.3 其他修饰方法近年来,双特异性肽的应用,即低分子量异质二聚体,已成为一种很有前景的增强肿瘤靶向的新方法。Liolios等[22]制备了同时靶向在前列腺癌细胞中表达的PSMA和胃泌素释放肽受体(gastrin releasing peptide receptor,GRPr)的双特异性放射性配体68Ga-HEn(n=0-3),在PSMA阳性LNCaP肿瘤和GRPr阳性PC-3肿瘤中表现出协同作用,极大提高了前列腺癌检测的敏感度;由带正电荷的组氨酸(H)和带负电荷的谷氨酸(E)组成的-(HE)n-(n=1-3)链接物,见图 1D,显著降低了肾和脾脏的摄取。总之,这些新型低分子量异质二聚体具有更好的药代动力学,可能作为双靶向性示踪剂,通过PET/CT和PET/MRI对前列腺癌各分期进行无创成像,在临床中得到应用。
Frei等[23]使用多功能环戊二烯(cyclopentadiene, Cp)配体作为金属配位体和两个Lys-urea-Glu(LuG)PSMA配体的链接剂,制成了一类新的结合亲和力可与临床评价的化合物相媲美的双功能Cp-Re(I)/99mTc(I)复合物,见图 1E,有望将其扩展到结合靶向性和治疗性两方面的具有Re/99mTc的诊疗一体化系统。
4 总结及展望白蛋白结合剂伊文思蓝、4-(p-碘苯基)丁酸衍生物以及聚合物PEG等修饰PSMA配体的放射性标记及分子探针的开展,使PSMA抑制剂在前列腺癌中的药代动力学得到巨大的改善(如延长血液循环半衰期、增加前列腺肿瘤摄取、降低肾脏摄取等),为前列腺癌的核素靶向治疗带来更多、更精准的信息,有效降低治疗核素使用剂量,减少器官毒性,有望使前列腺癌的临床治疗效果得到提升。初步的临床经验表明,177Lu-EB-PSMA-617治疗通常耐受良好,肿瘤摄取高,有必要进一步开展大范围的临床研究。
总之,科学的不断进步推动着医学诊疗手段的不断革新,靶向PSMA分子探针的开发也会继续朝着高敏感度、高特异性及低成本的目标迈进。放射性核素标记的功能化PSMA探针也将为非前列腺肿瘤患者带来新的治疗希望。
作者贡献
任亚楠:文献检索及论文撰写、修改
刘特立、李大鹏、李慧、丁缙:协助文献检索、整理及论文修改
朱华、杨志:论文的审阅及提出指导建议
| [1] |
Backhaus P, Noto B, Avramovic N, et al. Targeting PSMA by radioligands in non-prostate disease-current status and future perspectives[J]. Eur J Nucl Med Mol Imaging, 2018, 45(5): 860-877. |
| [2] |
Rahbar K, Ahmadzadehfar H, Kratochwil C, et al. German Multicenter Study Investigating 177Lu-PSMA-617 Radioligand Therapy in Advanced Prostate Cancer Patients[J]. J Nucl Med, 2017, 58(1): 85-90. |
| [3] |
Rahbar K, Bode A, Weckesser M, et al. Radioligand Therapy With 177Lu-PSMA-617 as A Novel Therapeutic Option in Patients With Metastatic Castration Resistant Prostate Cancer[J]. Clin Nucl Med, 2016, 41(7): 522-528. |
| [4] |
Su YC, Burnouf PA, Chuang KH, et al. Conditional internalization of PEGylated nanomedicines by PEG engagers for triple negative breast cancer therapy[J]. Nat Commun, 2017, 8: 15507. |
| [5] |
Lau J, Jacobson O, Niu G, et al. Bench to Bedside: Albumin Binders for Improved Cancer Radioligand Therapies[J]. Bioconjug Chem, 2019, 30(3): 487-502. |
| [6] |
Liu Z, Chen X. Simple bioconjugate chemistry serves great clinical advances: albumin as a versatile platform for diagnosis and precision therapy[J]. Chem Soc Rev, 2016, 45(5): 1432-1456. |
| [7] |
Xu Y, He Q, Wang M, et al. Quantifying blood-brain-barrier leakage using a combination of evans blue and high molecular weight FITC-Dextran[J]. J Neurosci Methods, 2019, 325: 108349. |
| [8] |
Zhang J, Lang L, Zhu Z, et al. Clinical Translation of an Albumin-Binding PET Radiotracer 68Ga-NEB[J]. J Nucl Med, 2015, 56(10): 1609-1614. |
| [9] |
Chen H, Jacobson O, Niu G, et al. Novel "Add-On" Molecule Based on Evans Blue Confers Superior Pharmacokinetics and Transforms Drugs to TheranosticAgents[J]. J Nucl Med, 2017, 58(4): 590-597. |
| [10] |
Wang Z, Jacobson O, Tian R, et al. Radioligand Therapy of Prostate Cancer with a Long-Lasting Prostate-Specific Membrane Antigen Targeting Agent 90Y-DOTA-EB-MCG[J]. Bioconjug Chem, 2018, 29(7): 2309-2315. |
| [11] |
Wang Z, Tian R, Niu G, et al. Single Low-Dose Injection of Evans Blue Modified PSMA-617 Radioligand Therapy Eliminates Prostate-Specific Membrane Antigen Positive Tumors[J]. Bioconjug Chem, 2018, 29(9): 3213-3221. |
| [12] |
Zang J, Fan X, Wang H, et al. First-in-human study of 177Lu-EB-PSMA-617 in patients with metastatic castration-resistant prostate cancer[J]. Eur J Nucl Med Mol Imaging, 2019, 46(1): 148-158. |
| [13] |
Tian R, Zhu S, Zeng Q, et al. An Albumin Sandwich Enhances in Vivo Circulation and Stability of Metabolically Labile Peptides[J]. Bioconjug Chem, 2019, 30(6): 1711-1723. |
| [14] |
Dumelin CE, Trussel S, Buller F, et al. A portable albumin binder from a DNA-encoded chemical library[J]. Angew Chem Int Ed Engl, 2008, 47(17): 3196-3201. |
| [15] |
Kelly JM, Amor-Coarasa A, Nikolopoulou A, et al. Dual-Target Binding Ligands with Modulated Pharmacokinetics for Endoradiotherapy of Prostate Cancer[J]. J Nucl Med, 2017, 58(9): 1442-1449. |
| [16] |
Kelly J, Amor-Coarasa A, Ponnala S, et al. Trifunctional PSMA-targeting constructs for prostate cancer with unprecedented localization to LNCaP tumors[J]. Eur J Nucl Med Mol Imaging, 2018, 45(11): 1841-1851. |
| [17] |
Choy CJ, Ling X, Geruntho JJ, et al. 177Lu-Labeled Phosphoramidate-Based PSMA Inhibitors: The Effect of an Albumin Binder on Biodistribution and Therapeutic Efficacy in Prostate Tumor-Bearing Mice[J]. Theranostics, 2017, 7(7): 1928-1939. |
| [18] |
Benesova M, Umbricht CA, Schibli R, et al. Albumin-Binding PSMA Ligands: Optimization of the Tissue Distribution Profile[J]. Mol Pharm, 2018, 15(3): 934-946. |
| [19] |
Kelly JM, Amor-Coarasa A, Ponnala S, et al. Albumin-Binding PSMA Ligands: Implications for Expanding the Therapeutic Window[J]. J Nucl Med, 2019, 60(5): 656-663. |
| [20] |
Kumar A, Mastren T, Wang B, et al. Design of a Small-Molecule Drug Conjugate for Prostate Cancer Targeted Theranostics[J]. Bioconjug Chem, 2016, 27(7): 1681-1689. |
| [21] |
Yari H, Nkepang G, Awasthi V. Surface Modification of Liposomes by a Lipopolymer Targeting Prostate Specific Membrane Antigen for Theranostic Delivery in Prostate Cancer[J]. Materials (Basel), 2019, 12(5): 756. |
| [22] |
Liolios C, Schafer M, Haberkorn U, et al. Novel Bispecific PSMA/GRPr Targeting Radioligands with Optimized Pharmacokinetics for Improved PET Imaging of Prostate Cancer[J]. Bioconjug Chem, 2016, 27(3): 737-751. |
| [23] |
Frei A, Fischer E, Childs BC, et al. Two is better than one: difunctional high-affinity PSMA probes based on a[CpM(CO)3] (M=Re/99mTc) scaffold[J]. Dalton Trans, 2019, 48(39): 14600-14605. |
 2020, Vol. 47
2020, Vol. 47


