文章信息
- 乳酸脱氢酶在肿瘤代谢中的作用及以其为靶标的抗肿瘤药物研发
- Role of Lactate Dehydrogenase in Tumor Metabolism and Progress of LDH-targeted Drugs
- 肿瘤防治研究, 2020, 47(12): 980-985
- Cancer Research on Prevention and Treatment, 2020, 47(12): 980-985
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0279
- 收稿日期: 2020-03-01
- 修回日期: 2020-08-31
2. 421001衡阳,湖南省分子靶标新药研究协同创新中心,南华大学
2. Hu'nan Provincial Cooperative Innovation Centre for Molecular Target New Drug Study, University of South China, Hengyang 421001, China
细胞经葡萄糖转运蛋白摄取葡萄糖,再经糖酵解生成丙酮酸后,存在两种可能的代谢途径:一种是当氧供应充足时,丙酮酸进入线粒体并发生有氧氧化,最终转化为CO2和H2O,并产生大量三磷酸腺苷(adenosine triphosphate, ATP);另一种则是在氧供应不足或不能被充分利用时,丙酮酸不进入线粒体,而是被细胞质中乳酸脱氢酶A(lactic dehydrogenase A, LDHA)还原成乳酸,同时产生少量的ATP。上世纪20年代,德国著名生物化学家Warburg发现[1],肿瘤细胞即使在有氧情况下,也主要通过后面这种方式进行糖的代谢以提供能量,这种有氧糖酵解的代谢方式随后被命名为“瓦伯格效应”,呈现出高葡萄糖消耗、低ATP合成和高乳酸生成的特点。很长一段时间,这种途径生成的乳酸都被当做一种代谢废物而被人们忽视,但近来研究发现,上述机制生成的乳酸又可被邻近葡萄糖供给相对缺乏的肿瘤细胞摄取,并在乳酸脱氢酶B(LDHB)协助下,作为一种碳源重新用于ATP合成,以提供肿瘤细胞快速增殖所需要的能量。通过药物阻断乳酸的生成和利用,有望成为肿瘤靶向治疗的又一有效手段。本文重点讨论了LDH与肿瘤细胞能量代谢之间的关系,以及以LDH为靶点抗肿瘤药物研究的进展,以期为肿瘤的发病机制以及抗肿瘤药物研发提供新的思路。
1 肿瘤细胞中乳酸的跨膜转运当肿瘤细胞选择有氧糖酵解作为主要代谢方式时,细胞内将生成大量乳酸,而过高水平的乳酸若不经处理则将对细胞本身带来直接的细胞毒作用,因此,肿瘤细胞必须通过一定的方式将过多的乳酸转运出细胞外。已有研究证实单羧酸转运蛋白(monocarboxylate transporters, MCTs)是将细胞内乳酸转运出去的主要转运体[2]。
MCTs是哺乳动物细胞膜上广泛分布的一类跨膜蛋白,包含14位成员,均由SLC16A基因家族编码,在多种种属间高度保守,但只有其中四个(MCT1、MCT2、MCT3和MCT4)被证实参与H+偶联的一元羧酸跨膜转运(包括乳酸、丙酮酸和酮体等),其中MCT1几乎存在于所有组织中,尤其是心脏和成纤维细胞。MCT2主要见于肝、肾和神经细胞。MCT3最初在鸡和大鼠视网膜色素上皮细胞(retinal pigment epithelial cells, RPE)中表达,其亚细胞定位于RPE基底膜。MCT4常见于高度依赖糖酵解的细胞,如白肌纤维、白细胞和肿瘤细胞[2-3]。
不同组织和不同情况下,不同MCTs在乳酸外排中的作用也是不同的。对处于相对缺氧环境下的肿瘤细胞而言,MCT4被认为是乳酸外排的最重要亚型,已有研究证实MCT4在三阴性乳腺癌、透明细胞肾癌、胰腺癌、非小细胞肺癌等多种肿瘤中表达上调,而阻断MCT4将导致细胞内酸性水平增高,造成“酸胁迫”并最终诱导肿瘤细胞凋亡[4-6]。
生理情况下,血液或组织中的乳酸盐含量大约是1.5~3.0 mmol[7],但在肿瘤中,由于MCT4介导的乳酸外排,血液或组织中的乳酸盐的含量可以升高到10~30 mmol[8-9]。这种酸性肿瘤微环境也是肿瘤特征性病理变化之一,同时肿瘤细胞间质中的乳酸也可以作为一种重要的碳源,被邻近的相对富氧区域的肿瘤细胞摄取,参与肿瘤能量代谢的重编程,而这种邻近区域肿瘤细胞对乳酸的摄取主要由MCT1介导。有研究表明,在有氧糖酵解速率较高的肿瘤细胞中,使用MCT1抑制剂或基因沉默的手段抑制MCT1活性,将抑制肿瘤细胞对乳酸和酮体的摄取,大大减少肿瘤细胞线粒体的有氧磷酸化,抑制肿瘤细胞的生长[10-11]。
2 乳酸脱氢酶在肿瘤中的作用及应用乳酸脱氢酶(lactic dehydrogenase, LDH)为含锌离子的金属蛋白,相对分子质量为135~140 kD,是一种糖酵解酶,也是肿瘤微环境中重要的代谢酶之一。LDH是由两种不同的亚基,即LDHA和LDHB组成的四聚体。它们可以组装成五种不同的四聚体(同工酶):LDH1由四个LDHB亚基组成;LDH2含有三个LDHB和一个LDHA亚基;LDH3含有两个LDHB和两个LDHA亚基;LDH4含有一个LDHB和三个LDHA亚基;LDH5含有四个LDHA亚基。自然界中由于对底物的选择性不同,存在L(-)-和D(+)-两种不同亚型的LDH。在无脊椎动物、原生生物和细菌中,主要是D(+)-LDH,这是一种2-羟基酸脱氢酶,属于FAD结合的氧化还原酶家族(FAD-binding oxidoreductase family)成员;而在脊椎动物组织(包括人类)中,主要是L(-)-LDH,属于L-特异性的NAD依赖性脱氢酶,本文中所讨论的LDH主要是后者。
LDH在体内广泛分布,几乎存在于所有组织细胞的胞质内,特别是在肝脏、肾脏、心肌中的含量较高。由于其相对分子质量较大,主要分布于细胞胞质内,只有当病理情况下,心肌细胞或肝细胞等受到破坏时,胞质中的LDH外溢,才会导致血浆中LDH水平的异常增高,因此血浆中LDH水平临床上常被用作心功能、肝功能等的重要检测指标。
LDH介导丙酮酸和乳酸之间的双向转化,还在调节肿瘤细胞之间的能量代谢的过程中起着重要作用。很多肿瘤患者血液或癌性分泌物中都伴随有不同程度的LDH的水平的增高,这种LDH水平的增高甚至被用于相关癌症的诊断及其预后的分析[12-13]。
2.1 LDHA与乳酸代谢及其在肿瘤中的作用肿瘤细胞的能量代谢具有很高的可塑性,它们可以根据其生存的环境来选择具体的能量代谢方式。通常情况下,肿瘤细胞的增殖能力远较正常细胞快,这使它们对能量的需求大幅增加。位于缺氧区域的肿瘤细胞通过促进细胞膜表面葡萄糖转运蛋白(glucose transporters, GLUTs))表达等方式驱动葡萄糖的摄取,但对这些肿瘤细胞而言,葡萄糖被氧化为丙酮酸后,并没有进入线粒体进行氧化磷酸化(oxidative phosphorylation, OXPHOS),而是在LDHA的作用下丙酮酸分解为乳酸并产生NAD+和少量的ATP(1分子的葡萄糖最终生成2分子乳酸和2 ATP),表现出“高葡萄糖摄取和低ATP生成”的能量代谢方式,也就是前面所述的著名的“瓦伯格效应”。由于这种方式只能产生少量ATP(正常情况下,1分子葡萄糖摄取后经OXPHOS一般可以产生最多达38 ATP),因此被科学家认为是一种“浪费型”的能量代谢模式,瓦伯格很早就发现对肿瘤细胞而言,在有氧条件下依旧采用这种“浪费型代谢模式”进行糖酵解,而为什么肿瘤细胞更愿意选择这种代谢模式,这是一直困扰科学界的问题[14]。
瓦伯格早期观点认为由于癌细胞线粒体功能缺失,呼吸链功能低下,导致丙酮酸无法进入线粒体去进行有效的氧化磷酸化。但现有研究证实,确实存在某些情况下肿瘤细胞线粒体功能发生变化的现象,但很多时候,表现出“瓦伯格效应”的肿瘤细胞的线粒体功能并没有受到明显的损伤[15],这表明还存在着其他方面的原因。尽管瓦伯格效应中ATP产生的效率低,但它供能的速度却远远快于正常葡萄糖的OXPHOS,有助于肿瘤细胞快速增殖对能量的要求[16];也有人认为,这种途径的能量代谢将导致肿瘤细胞内的乳酸生成增加,后者外排进入到肿瘤细胞间质后使肿瘤微环境呈酸性,有助于促进肿瘤细胞增殖、侵袭、迁移、耐药和免疫逃逸等[17];还有一种观点认为,这种途径生成的乳酸,可被邻近能量供给障碍的肿瘤细胞摄取,重新转化成丙酮酸,再用于OXPHOS,这种转化有助于肿瘤细胞为适应不同的环境对能量物质的再分配[18];另有研究显示[19],不仅ATP,肿瘤细胞的快速增殖还需要更多的蛋白质、核酸等物质,而肿瘤细胞可以利用这种糖酵解提供的中间产物(如乳酸可以作为一种碳源、NADH作为脂肪酸合成的必需物质),推动糖、氨基酸、脂肪等物质的从头合成,以实现对核酸、脂质以及蛋白质的“代谢重编程”(metabolic reprogramming)。
瓦伯格效应中糖酵解产生的丙酮酸在胞质中被转化成乳酸,此过程必须依赖LDHA,已有研究证实LDHA在多种肿瘤中高表达并在肿瘤的发生发展中起着十分重要的作用:Cui等[20]报道,转录因子FOXM1(forkhead box protein M1)可通过上调LDHA表达并促进胰腺癌的发展;Jiang等[21]证实FOXM1-LDHA信号通路引起的LDHA的表达上调在胃癌发生发展中也起着十分重要的作用;Su等[22]证实一种组蛋白脱甲基酶JMJD2A(Jumonji C domain 2A)可上调LDHA表达并促进鼻咽癌细胞增殖、侵袭和转移;而Jiang等[23]则发现LDHA表达增加可以促进膀胱癌细胞上皮-间质转化,加速膀胱癌的进展。
2.2 LDHB与乳酸代谢及其在肿瘤中的作用与LDHA作用不同的是,LDHB主要催化乳酸转化为丙酮酸和NADH。近年研究[24]发现,不是所有肿瘤细胞的OXPHOS水平都很低,有些肿瘤细胞甚至显示出较高的OXPHOS的水平。据此,有人提出了“乳酸穿梭机制”(lactate shuttle theory)学说,其主要观点是对远离血管或处于相对缺氧区域的肿瘤细胞(hypoxic cancer cell)而言,肿瘤细胞将上调GLUTs,大量摄取葡萄糖,后者经糖酵解方式生成乳酸(也包括酮体和脂肪酸),这些物质经相应的机制被排入肿瘤细胞间质后,又可被邻近(或处于血管附近或氧供给相对丰富区域)的肿瘤细胞(oxygenated cancer cell)摄取,作为主要的能量供给物质,在LDHB作用下重新转变成丙酮酸,并进一步进入线粒体发生OXPHOS以提供ATP,见图 1。这种能量代谢方式有助于肿瘤细胞对能量物质进行更有效的分配,因为它保证了边缘区域(或相对缺氧区域)的肿瘤细胞可以摄取更多的葡萄糖,以适应快速增殖对能量的需要,同时它们产生的乳酸又可以保证氧供给相对丰富区域肿瘤细胞的能量供给。
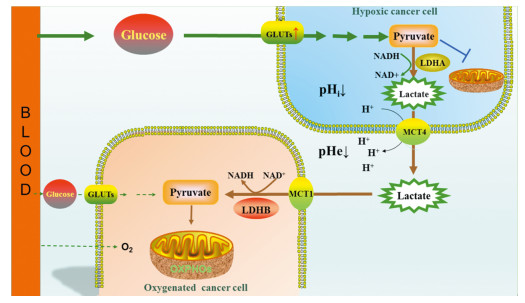
|
| 图 1 “乳酸穿梭机制”学说模式图 Figure 1 Model of lactate shuttle theory |
2011年,Martinez-Outschoorn等[25]将肿瘤细胞和成纤维细胞共培养时发现,肿瘤细胞的线粒体活性显著增加,而葡萄糖摄取和GLUT1表达相应减少,同时肿瘤细胞的ROS(reactive oxygen species, ROS)如H2O2分泌显著增加,后者扩散到邻近的成纤维细胞后,造成后者细胞内氧化应激水平增高,继而导致成纤维细胞的线粒体活性显著降低,但葡萄糖摄取增加,有氧糖酵解增强。该实验结果不仅证实了肿瘤微环境在肿瘤发生发展中的作用,更是首次提出了ROS在肿瘤细胞能量代谢中的作用。随后,在此基础上逐渐发展起来“反向瓦伯格效应”(reverse Warburg effect)理论,即肿瘤微环境中的间质细胞有氧糖酵解水平增强,产生的乳酸和酮体等被肿瘤细胞摄取并推动肿瘤细胞线粒体的OXPHOS。
一般而言,肿瘤细胞中LDHA的表达水平显著增加,但LDHB在不同肿瘤细胞中的表达却由于不同肿瘤(和(或)肿瘤细胞)种类的不同而不一样。有研究证实LDHB表达上调的有宫颈癌(如SiHa细胞)[26]、肺癌细胞株(如非小细胞肺癌NCI-H226,KRAS突变的肺腺癌NCI-H2122, NCI-H1573等)[27]、骨肉瘤(如MG63,U2OS和SAOS细胞)[28]、口腔鳞状细胞癌(如HN12、Cal27和KB细胞)[29]、多瘤病毒阴性默克细胞株(polyomavirus negative Merkel cell)[30]和一些相应的临床病例上。LDHB的水平下调甚或不表达的有肝癌细胞SNU-423、SNU-449和MHCC97-H[31],结肠癌细胞RKO和HCT116[32],胃癌细胞KATOⅢ[33]和高转移性的前列腺癌细胞LNCaP-LN3[34]。
不仅如此,同一种肿瘤不同来源的细胞株上LDHB的表达也有可能不一样,以胰腺癌细胞为例,PANC-1、MDA28、BxPC-3、Hs766T等胰腺癌细胞上LDHB表达显著增加,但CaPan-1、AsPC-1、MiaPaca-2及PATU8902等胰腺癌细胞株上却不表达LDHB[35]。有报道显示LDHB在basal-like型乳腺癌细胞株如MDA-MB-231,MDA-MB-436细胞株上高表达,但在乳腺导管癌T-47D细胞株上不表达[36];而在MCF-7细胞株上,文献对LDHB表达的报道并不一致。Brown等[37]研究结果显示LDHB的表达缺失,但Hussien等[38]的结果却证实MCF-7细胞株上以LDHB的表达为主。LDHB在不同肿瘤细胞上存在不同表达(甚至在部分肿瘤细胞株不表达)及这些细胞具体的能量代谢方式又有什么不同,目前了解并不多,一种可能原因是不同环境/培养条件下,不同肿瘤细胞对糖酵解依赖性不一样,而糖酵解依赖性较高的肿瘤细胞上LDHB的表达也相应较高。
LDHB在不同肿瘤细胞上表达的多样性,决定了其作用在不同的肿瘤上也是不一样的。Liao等[39]通过对269例临床原发性局限性膀胱尿路上皮癌患者和侵袭力不同的5种膀胱尿路上皮癌细胞株研究后发现,LDHB表达水平与肿瘤的恶性程度、患者的存活率,以及相应肿瘤细胞的侵袭力成反比。Shi等[40]研究却显示LDHB的活性越高,结肠直肠癌增殖越快。
3 以LDH为靶点的抗肿瘤药物的研发由于LDH在肿瘤细胞能量代谢中的特殊地位,以LDH为靶点抗肿瘤药物的研发也引起了越来越多科学家的兴趣。由于LDHB在不同肿瘤细胞上表现出的多样性,目前LDHB的选择性抑制剂的开发较少。相反,LDHA高表达在肿瘤中较为常见,同时抑制LDHA将减少肿瘤细胞内丙酮酸向乳酸的转化,进而切断肿瘤细胞的ATP供给,而正常细胞可直接利用丙酮酸,在线粒体中合成ATP,因此受影响可能较小。此外,有临床报道显示,长期LDHA活性异常(如LDHA遗传缺失)仅引起非致命性脓疱样银屑病[41],意味着将LDHA作为肿瘤防治的新靶点,不仅具有很大的可行性,且可能具有较小的不良反应。
草氨酸盐(oxamate)是一种经典的LDHA抑制剂,其结构见图 2A。它存在于正常人体组织中,可与LDHA的底物丙酮酸竞争进而抑制LDHA活性,研究结果证实草氨酸盐可抑制乳腺癌、肝癌、非小细胞肺癌等多种肿瘤细胞的增殖、侵袭和迁移,还可以有效提高其他抗肿瘤药和放射治疗的敏感度[42],但草氨酸盐对LDHA的抑制作用是非特异性的,且作用较弱,体外抗肿瘤作用需毫摩尔以上浓度,临床应用价值不大,目前主要用做LDHA的工具药。
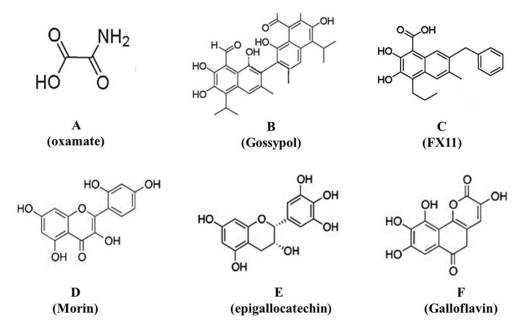
|
| 图 2 几种常用LDHA抑制剂的化学结构 Figure 2 Chemical structures of several LDHA inhibitors |
棉酚(gossypol)是一种从棉籽中提取的天然多酚二醛,其结构见图 2B。由于睾丸的生精上皮细胞对它极其敏感,作为一种男用避孕药为大众熟知。棉酚同时也是一种经典的LDHA抑制剂,可抑制多种肿瘤细胞增殖,并促进其凋亡,产生显著的抗肿瘤活性,它对LDHA的抑制作用也是非特异性的,同时棉酚的不良反应较多,限制了它在临床上的应用。早年一项Ⅰ/Ⅱ期临床试验报道[42],棉酚口服的最大耐受量是40 mg/d,常见的不良反应包括疲劳、恶心、呕吐、腹泻、味觉异常等,剂量增大时还可以导致心律失常、低血钾、肾衰、肌无力甚至是肌麻痹等较为严重的不良反应。
FX11是在棉酚的结构上衍生出来的另一种公认的LDHA强抑制剂,结构见图 2C。它对LDHA作用的IC50约是50 nmol,可以显著抑制肿瘤细胞乳酸和ATP的合成,在体内外均已被证实能抑制肿瘤的生长,但其结构中的儿茶酚部分限制了它的临床应用。
此外,一些具有多酚结构的黄酮类化合物,如桑黄素(morin),结构见图 2D;表没食子儿茶素(epigallocatechin),结构见图 2E;也显示了一定的LDHA抑制活性。特别是陪黄素(galloflavin),结构见图 2F,不仅可以非选择性抑制LDHA,还被证实有较好的抗肿瘤活性,且对正常细胞的作用较弱、毒性作用相对较少[43]。
4 结语鉴于LDH在肿瘤能量代谢中的重要作用,特别是肿瘤细胞和正常细胞不同的能量代谢方式,使其成为肿瘤防治的又一个新的可能靶点。近十多年来,一大批以LDHA为靶点的抑制剂被研发出来,人们希望通过抑制LDHA,以切断肿瘤细胞的ATP供给,实现抗肿瘤的作用。尽管上述LDHA抑制剂很多已经在细胞水平取得较好的抗肿瘤作用,但到目前为止,尚无有效用于临床的LDHA抑制剂。可能的原因是与已研发药物的生物利用度较低有关。Zhang等[44]认为由于LDHA结构中含有较多阳离子的氨基酸残基,这就要求酶的抑制剂最好具有一个或多个带负电荷的结构,如-COO-,但具有这种结构的抑制剂通常对细胞屏障的渗透性很差。
此外,Ždralević等[45]认为只有LDHA/B双基因敲除,才能彻底抑制“瓦伯格效应”,但即便如此,如果在有氧条件下,一些肿瘤细胞也可以转向OXPHOS方式,以躲过药物的作用而实现快速增殖。因此,将LDH抑制剂和糖酵解途径中的一些其他关键酶抑制剂,如葡萄糖转运体的抑制剂、己糖激酶抑制剂合用,有可能取得更好的抗肿瘤效果。由此可见,LDH抑制剂的研发有必要进一步深入研究,离真正走向临床可能还有相当长的一段路。
作者贡献
丘金梅:论文构思、撰写与修改
龚娟、谢青池:参与论文撰写及文献收集与整理
谢志忠:论文构思、写作指导及审阅
| [1] |
Warburg O. On the origin of cancer cells[J]. Science, 1956, 123(3191): 309-314. |
| [2] |
Felmlee MA, Jones RS, Rodriguez-Cruz V, et al. Monocarboxylate Transporters (SLC16): Function, Regulation, and Role in Health and Disease[J]. Pharmacol Rev, 2020, 72(2): 466-485. |
| [3] |
Pucino V, Cucchi D, Mauro C. Lactate transporters as therapeutic targets in cancer and inflammatory diseases[J]. Expert Opin Ther Targets, 2018, 22(9): 735-743. |
| [4] |
Contreras-Baeza Y, Sandoval PY, Alarcón R. Monocarboxylate transporter 4 (MCT4) is a high affinity transporter capable of exporting lactate in high-lactate microenvironments[J]. J Biol Chem, 2019, 294(52): 20135-20147. |
| [5] |
Guan X, Bryniarski MA, Morris ME. In Vitro and In Vivo Efficacy of the Monocarboxylate Transporter 1 Inhibitor AR-C155858 in the Murine 4T1 Breast Cancer Tumor Model[J]. AAPS J, 2018, 21(1): 3. |
| [6] |
Benjamin D, Robay D, Hindupur SK, et al. Dual Inhibition of the Lactate Transporters MCT1 and MCT4 Is Synthetic Lethal with Metformin due to NAD+ Depletion in Cancer Cells[J]. Cell Rep, 2018, 25(11): 3047-3058. e4. |
| [7] |
Srinivas SR, Gopal E, Zhuang L, et al. Cloning and functional identification of slc5a12 as a sodium-coupled low-affinity transporter for monocarboxylates (SMCT2)[J]. Biochem J, 2005, 392(Pt 3): 655-664. |
| [8] |
Hirschhaeuser F, Sattler UG, Mueller-Klieser W. Lactate: a metabolic key player in cancer[J]. Cancer Res, 2011, 71(22): 6921-6925. |
| [9] |
Haas R, Smith J, Rocher-Ros V, et al. Lactate regulates metabolic and pro-inflammatory circuits in control of T cell migration and effector functions[J]. PLoS Biol, 2015, 13(7): e1002202. |
| [10] |
Guan X, Morris ME. Pharmacokinetics of the Monocarboxylate Transporter 1 Inhibitor AZD3965 in Mice: Potential Enterohepatic Circulation and Target-Mediated Disposition[J]. Pharm Res, 2019, 37(1): 5. |
| [11] |
Hou L, Zhao Y, Song GQ, et al. Interfering cellular lactate homeostasis overcomes Taxol resistance of breast cancer cells through the microRNA-124-mediated lactate transporter (MCT1) inhibition[J]. Cancer Cell Int, 2019, 19: 193. |
| [12] |
Chen C, Zhu YH, Huang JA. Clinical evaluation of potential usefulness of serum lactate dehydrogenase level in follow-up of small cell lung cancer[J]. J Cancer Res Ther, 2018, 14(Supplement): S336-S340. |
| [13] |
Zhang X, Guo M, Fan J, et al. Prognostic significance of serum LDH in small cell lung cancer: A systematic review with meta-analysis[J]. Cancer Biomark, 2016, 16(3): 415-423. |
| [14] |
Xu XD, Shao SX, Jiang HP, et al. Warburg effect or reverse Warburg effect? A review of cancer metabolism[J]. Oncol Res Treat, 2015, 38(3): 117-122. |
| [15] |
Zong WX, Rabinowitz JD, White E. Mitochondria and Cancer[J]. Mol Cell, 2016, 61(5): 667-676. |
| [16] |
Epstein T, Gatenby RA, Brown JS. The Warburg effect as an adaptation of cancer cells to rapid fluctuations in energy demand[J]. PLoS One, 2017, 12(9): e0185085. |
| [17] |
de la Cruz-López KG, Castro-Muñoz LJ, Reyes-Hernández DO, et al. Lactate in the Regulation of Tumor Microenvironment and Therapeutic Approaches[J]. Front Oncol, 2019, 9: 1143. |
| [18] |
Brooks GA. The Science and Translation of Lactate Shuttle Theory[J]. Cell Metab, 2018, 27(4): 757-785. |
| [19] |
Liberti MV, Locasale JW. The Warburg Effect: How Does it Benefit Cancer Cells?[J]. Trends Biochem Sci, 2016, 41(3): 211-218. |
| [20] |
Cui J, Shi M, Xie D, et al. FOXM1 promotes the warburg effect and pancreatic cancer progression via transactivation of LDHA expression[J]. Clin Cancer Res, 2014, 20(10): 2595-2606. |
| [21] |
Jiang W, Zhou F, Li N, et al. FOXM1-LDHA signaling promoted gastric cancer glycolytic phenotype and progression[J]. Int J Clin Exp Pathol, 2015, 6: 6756-6763. |
| [22] |
Su Y, Yu QH, Wang XY, et al. JMJD2A promotes the Warburg effect and nasopharyngeal carcinoma progression by transactivating LDHA expression[J]. BMC Cancer, 2017, 17(1): 477. |
| [23] |
Jiang F, Ma S, Xue Y, et al. LDH-A promotes malignant progression via activation of epithelial-to-mesenchymal transition and conferring stemness in muscle-invasive bladder cancer[J]. Biochem Biophys Res Commun, 2016, 469(4): 985-992. |
| [24] |
Jiang P, Du W, Wu M. Regulation of the pentose phosphate pathway in cancer[J]. Protein Cell, 2014, 5(8): 592-602. |
| [25] |
Martinez-Outschoorn UE, Lin Z, Trimmer C, et al. Cancer cells metabolically' fertilize' the tumor microenvironment with hydrogen peroxide, driving the Warburg effect: Implications for PET imaging of human tumors[J]. Cell Cycle, 2011, 10(15): 2504-2520. |
| [26] |
Wang SJ, Xie J, Li JJ, et al. Cisplatin suppresses the growth and proliferation of breast and cervical cancer cell lines by inhibiting integrin β5-mediated glycolysis[J]. Am J Cancer Res, 2016, 6(5): 1108-1117. |
| [27] |
McCleland ML, Adler AS, Deming L, et al. Lactate dehydrogenase B is required for the growth of KRAS-dependent lung adenocarcinomas[J]. Clin Cancer Res, 2013, 19(4): 773-784. |
| [28] |
Li C, Chen Y, Bai PP, et al. LDHB may be a significant predictor of poor prognosis in osteosarcoma[J]. Am J Transl Res, 2016, 8(11): 4831-4843. |
| [29] |
Sun W, Zhang X, Ding X, et al. Lactate dehydrogenase B is associated with the response to neoadjuvant chemotherapy in oral squamous cell carcinoma[J]. PLoS One, 2015, 10(5): e0125976. |
| [30] |
Kumar S, Xie H, Scicluna P, et al. MiR-375 Regulation of LDHB Plays Distinct Roles in Polyomavirus-Positive and -Negative Merkel Cell Carcinoma[J]. Cancers (Basel), 2018, 10(11): 443. |
| [31] |
Kim JH, Kim EL, Lee YK, et al. Decreased lactate dehydrogenase B expression enhances claudin 1-mediated hepatoma cell invasiveness via mitochondrial defects[J]. Exp Cell Res, 2011, 317(8): 1108-1118. |
| [32] |
Wu GY, Yuan SC, Chen ZP, et al. The KLF14 Transcription Factor Regulates Glycolysis by Downregulating LDHB in Colorectal Cancer[J]. Int J Biol Sci, 2019, 15(3): 628-635. |
| [33] |
Maekawa M, Taniguchi T, Ishikawa J, et al. Promoter hypermethylation in cancer silences LDHB, eliminating lactate dehydrogenase isoenzymes 1-4[J]. Clin Chem, 2003, 49(9): 1518-1520. |
| [34] |
Leiblich A, Cross SS, Catto JW, et al. Lactate dehydrogenase-B is silenced by promoter hypermethylation in human prostate cancer[J]. Oncogene, 2006, 25(20): 2953-2960. |
| [35] |
Cui JJ, Quan M, Jiang WH, et al. Suppressed expression of LDHB promotes pancreatic cancer progression via inducing glycolytic phenotype[J]. Med Oncol, 2015, 32(5): 143. |
| [36] |
McCleland ML, Adler AS, Shang Y, et al. An integrated genomic screen identifies LDHB as an essential gene for triple-negative breast cancer[J]. Cancer Res, 2012, 72(22): 5812-5823. |
| [37] |
Brown NJ, Higham SE, Perunovic B, et al. Lactate dehydrogenase-B is silenced by promoter methylation in a highfrequency of human breast cancers[J]. PLoS One, 2013, 8(2): e57697. |
| [38] |
Hussien R, Brooks GA. Mitochondrial and plasma membrane lactate transporter and lactate dehydrogenase isoform expression in breast cancer cell lines[J]. Physiol Genomics, 2011, 43(5): 255-264. |
| [39] |
Liao AC, Li CF, Shen KH, et al. Loss of lactate dehydrogenase B subunit expression is correlated with tumour progression and independently predicts inferior disease-specific survival in urinary bladder urothelial carcinoma[J]. Pathology, 2011, 43(7): 707-712. |
| [40] |
Shi L, Yan H, An S, et al. SIRT5-mediated deacetylation of LDHB promotes autophagy and tumorigenesis in colorectal cancer[J]. Mol Oncol, 2019, 13(2): 358-375. |
| [41] |
Takeo N, Fujiwara S, Sakai T, et al. Hereditary Lactate Dehydrogenase M-subunit Deficiency With Late-Developing Pustular Psoriasis-Like Lesions[J]. J Dermatol, 2016, 43(12): 1429-1432. |
| [42] |
Koukourakis M, Tsolou A, Pouliliou S, et al. Blocking LDHA Glycolytic Pathway Sensitizes Glioblastoma Cells to Radiation and Temozolomide[J]. Biochem Biophys Res Commun, 2017, 491(4): 932-938. |
| [43] |
Van Poznak C, Seidman AD, Reidenberg MM, et al. Oral gossypol in the treatment of patients with refractory metastatic breast cancer: a phase Ⅰ/Ⅱ clinical trial[J]. Breast Cancer Res Treat, 2001, 66(3): 239-248. |
| [44] |
Zhang SL, He Y, Tam KY. Targeting cancer metabolism to develop human lactate dehydrogenase (hLDH) 5 inhibitors[J]. Drug Discov Today, 2018, 23(7): 1407-1415. |
| [45] |
Ždralević M, Brand A, Di Ianni L, et al. Double genetic disruption of lactate dehydrogenases A and B is required to ablate the "Warburg effect" restricting tumor growth to oxidative metabolism[J]. J Biol Chem, 2018, 293(41): 15947-15961. |
 2020, Vol. 47
2020, Vol. 47


