文章信息
- 系统免疫炎性反应指数对乳腺癌新辅助化疗病理完全缓解的预测作用及其与p53的关系
- Predictive Effect of Systemic Immune-inflammation Index on Pathological Complete Response of Breast Cancer to Neoadjuvant Chemotherapy and Its Relation with p53
- 肿瘤防治研究, 2020, 47(10): 756-760
- Cancer Research on Prevention and Treatment, 2020, 47(10): 756-760
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0273
- 收稿日期: 2020-03-30
- 修回日期: 2020-06-24
乳腺癌是女性患者发病率最高的癌症之一,2018年全球约有1 810万新发癌症病例,其中乳腺癌约占11.6%(210万)[1]。新辅助化疗已被广泛接受并应用于乳腺癌的治疗,使一些晚期患者获得手术的机会,或使不能保乳的患者达到保乳条件[2-3]。
系统免疫炎性反应指数(systemic immune-inflammation index, SII)由中性粒细胞、血小板及淋巴细胞绝对值组成。作为一个综合性参数,它可以更好地反应宿主的免疫和炎性反应状态[4]。尽管SII已被用于研究不同的癌症,如肝癌、胰腺癌、胃癌等[4-6],但它并未广泛应用于乳腺癌。p53是一种抑癌基因,它能激活DNA修复蛋白、调节细胞周期、启动细胞凋亡等,但其与乳腺癌新辅助化疗疗效的关系并无定论。本研究旨在探讨SII对乳腺癌新辅助化疗(neoadjuvant chemotherapy, NAC)病理完全缓解(pathological complete response, pCR)的预测作用及与p53的关系,以期为乳腺癌的诊治提供参考。
1 资料与方法 1.1 一般资料回顾性收集2015年1月—2017年1月在哈尔滨医科大学附属肿瘤医院接受新辅助化疗及手术的女性乳腺癌患者387例。病例纳入标准:(1)符合中国临床肿瘤学会(CSCO)乳腺癌诊疗指南:新辅助化疗适应证的患者; (2)术前行新辅助化疗且化疗前未行放疗及内分泌治疗; (3)化疗前经粗针穿刺病理检查确诊为乳腺癌; (4)血液标本均为治疗开始前一周内采集。排除标准:(1)临床病理资料不全者; (2)多发肿瘤患者; (3)治疗前合并有影响血液化验结果的因素,如患有血液系统疾病、急慢性感染等疾病,服用特殊药物等。所有患者每次治疗前均已签署我院《病史数据/生物标本二次利用知情同意书》,本研究中涉及人类参与者的所有程序符合本地研究委员会的标准,并符合1964年的《赫尔辛基宣言》及其后来的类似道德标准修正案。
1.2 分组方法(1) TNM分期参考第8版AJCC/UICC分期标准。(2)激素受体(hormone receptor, HR)阳性组:雌激素受体(estrogen receptor, ER)及孕激素受体(progesterone receptor, PR)其中一项为阳性或均为阳性; HR阴性组:ER及PR均为阴性。(3)p53阴性组:免疫组织化学法检测 < 10%癌细胞核着色; p53阳性组:免疫组织化学法检测≥10%癌细胞核着色。(4)使用中位数49岁对患者年龄分组。(5)SII=中性粒细胞绝对值(109/L)×血小板计数(109/L)/淋巴细胞绝对值(109/L)。取中位数516作为临界值将SII分为高低两组。
1.3 统计学方法使用SPSS21.0统计软件分析数据。计数资料采用例数(%)描述,Logistic回归模型进行单因素和多因素分析,组间分析使用Pearson's χ2检验。P < 0.05为差异有统计学意义。
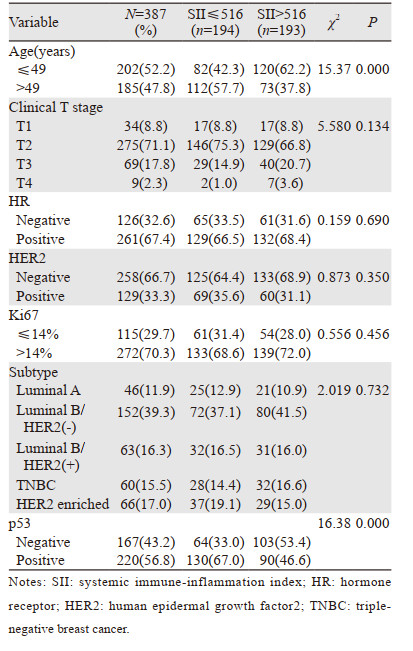
2 结果 2.1 不同SII组患者临床病理特征共纳入患者387例,年龄25~72岁,中位年龄49岁。不同SII组临床病理特征基本相似,其中SII值高低与p53状态相关(P=0.000),见表 1。
|
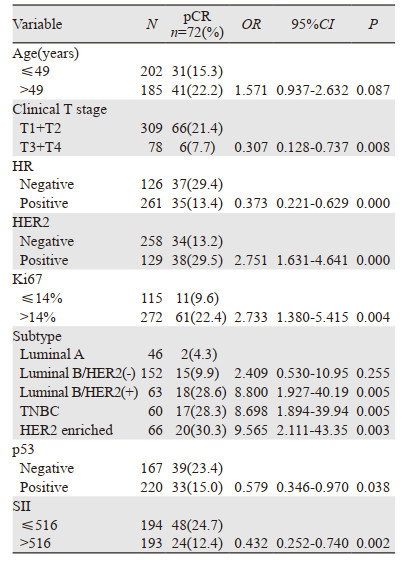
本研究共72例(18.6%)患者接受新辅助化疗后获得了pCR,其中低SII组48例,高SII组24例; p53阴性组39例,阳性组33例。单因素分析显示:(1)T1+T2组较T3+T4组更易获得pCR(P=0.008);HR阴性者较阳性者更易获得pCR(P=0.000);HER2阳性者较阴性者更易获得pCR(P=0.000);Ki67 > 14%者较Ki67≤14%者更易获得pCR(P=0.004);与Luminal A型相比,Luminal B/HER2(+),TNBC及HER2 enriched组更易获得pCR(P=0.005, P=0.005, P=0.003);p53阴性者较阳性者更易获得pCR(P=0.038);低SII组较高SII组更易获得pCR(P=0.002);(2)与年龄≤49岁患者相比,年龄大于49岁患者pCR更高; 与Luminal A型患者相比,Luminal B/HER2(-)型患者pCR更高; 但差异均无统计学意义(均P > 0.05),见表 2。
|
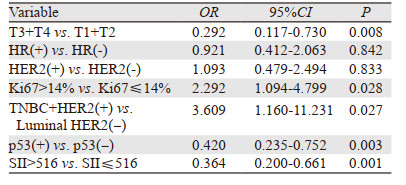
将单因素分析中具有统计学意义的临床病理特征纳入多因素分析,发现与TI+T2组相比,T3+T4组pCR率较低; 与Ki67≤14%组相比,Ki67 > 14%组pCR率更高; 与Luminal HER2(-)组相比,TNBC+HER2(+)组pCR率更高; 与p53阴性组相比,阳性组pCR率更低; 与低SII组相比,高SII组pCR率更低,差异仍均有统计学意义(均P < 0.05),见表 3。因此表明SII、p53、临床T分期、Ki67值及分子分型是乳腺癌患者pCR的独立预测因素。
|
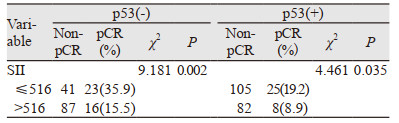
经单因素和多因素分析,SII及p53均是乳腺癌患者病理完全缓解的独立预测因素。为进一步分析SII与p53的关系,我们进行了亚组分析。p53阴性组,低SII组与高SII组间pCR差异有统计学意义(P=0.002);p53阳性组,低SII组与高SII组间pCR差异有统计学意义(P=0.035),即低SII且p53阴性组患者更易获得pCR,见表 4。
新辅助化疗后的病理完全缓解被认为是乳腺癌总生存及无病生存的良好替代指标,尤其是在三阴性及HER2阳性患者中[7-8],但对于激素受体阳性或HER2阴性的Luminal型患者并不完全适用,因为这些亚型接受新辅助化疗后pCR率较低,且即使未获得pCR,这类患者也能获得较好的预后[9-11]。本研究中共72例(18.6%)患者获得了pCR,这与Teshome等[12]的研究一致。单因素及多因素分析表明,临床T分期、Ki67值及分子分型是乳腺癌患者pCR的独立预测因素,T1+T2期、Ki67 > 14%及TNBC+HER-2(+)组患者较易获得pCR,这进一步证明了既往类似研究的结果[13-14]。另有研究显示适当延长乳腺癌新辅助化疗周期可使pCR率升高[15]。
癌症相关炎性反应指标已被认为是大多数癌症疾病进展和生存的关键因素[16]。作为一个综合指标,SII在癌症中的预后价值可以通过中性粒细胞、血小板和淋巴细胞的功能来解释。中性粒细胞是一种免疫炎性反应参数,它产生的中性粒细胞胞外陷阱可以通过调节HMGB1/RAGE/IL-8轴来介导肿瘤的增殖和转移[17];血小板能促进肿瘤血管生成和转移,并使肿瘤细胞免受抗肿瘤免疫反应的影响[18];与中性粒细胞和血小板不同的是,肿瘤浸润淋巴细胞与癌症患者更好的生存率相关,因为它们的免疫反应可以防止肿瘤生长和转移[19-20]。Chen等[21]研究显示SII值低的乳腺癌患者比SII值高的乳腺癌患者预后更好,复发率更低。Liu[22]和Sun[23]等分别分析了三阴性和HER2阳性乳腺癌患者与SII的关系,亦发现较低的SII与更好的预后相关。本研究发现SII是新辅助化疗后病理完全缓解的独立预测因素,低SII组的pCR率更高,这进一步证明了上述研究的观点。
p53是乳腺癌中常见的突变基因。体外研究表明,p53对肿瘤细胞凋亡的有效激活是必需的,提示p53的丢失可能增强细胞对化疗药物的抵抗[24]。亦有研究报告称,p53突变的患者总生存及无进展生存较差[25],本研究单因素分析发现p53与pCR相关,校正了混杂因素的多因素分析显示p53是乳腺癌病理完全缓解的独立预测因素,p53阴性组有更高的pCR率,这可能与p53突变使肌红蛋白癌基因上调,从而使肿瘤细胞发生转移和产生耐药有关[26]。
Wellenstein等[27]证实了癌细胞中p53缺失、Wnt配体分泌及系统性中性粒细胞增多之间的一种新的机制性联系,并发现p53的缺失能引发Wnt依赖性全身性炎性反应以驱动乳腺癌转移。Stodden等[28]研究表明子宫内膜细胞中CDH1和TP53的缺失引起慢性炎性反应,促进巨噬细胞募集后肿瘤微环境的发展,并促进侵袭性子宫内膜癌的发生。Cooks等[29]发现p53突变能延长NF-κB活化并促进慢性炎性反应和炎性反应相关的结直肠癌,张立志等[30]亦发现SII及p53突变是神经胶质瘤的独立预后因素,未发生p53突变的低SII组神经胶质瘤患者预后较好。本研究发现SII值高低与p53状态相关(P=0.000),因此我们猜测,乳腺癌患者体内p53状态与免疫炎性反应水平之间亦存在上述类似的关系,为此我们分析了SII对乳腺癌病理完全缓解的预测作用及与p53的关系,结果显示,SII及p53均为乳腺癌病理完全缓解的独立预测因素,进行亚组分析结果表明,低SII且p53阴性组pCR率最高,这提示我们该组患者可能有更好的预后。
对于常见的临床病理特征与pCR的关系,如年龄、TNM分期、分子标志物及分子分型等,本研究进行了单因素及多因素分析,结果显示,临床T分期、分子分型及分子标志物中的Ki67指数及p53是pCR的独立预测因素,低SII组患者有较高pCR率,单因素及多因素分析均提示该指标为pCR的独立预测因素。结合上述文献的报告结果,SII作为一种方便、简单、易获取的指标,能够用以指导临床医师选择新辅助化疗方案或决定新辅助化疗的疗程,但这需要更多的实验及数据来支撑该观点。对于与炎性反应相关的p53,本研究结果显示它是预测pCR的独立因素。p53状态不仅与SII高低相关,同时对于p53阴性且SII较低者,pCR率更高。这给我们带来了一种新思路:将传统的分子标志物及新近的炎性反应指数联合,用以预测乳腺癌患者预后。
相较于常见的血液参数,如中性粒细胞与淋巴细胞比值及血小板与淋巴细胞比值,SII作为一种更全面的血液学指标,能够更全面地反映患者体内的免疫炎性反应水平。考虑到我国乳腺癌发病率高、医疗条件分布不均的现状,将可重复、方便、创伤小的炎性反应指数应用于乳腺癌的防治具有重要意义。了解血液学参数,不仅能为临床医师诊治提供可靠的参考,同时为寻找新的主观治疗靶点,亦具有十分重要的意义。
本研究亦存在部分不足,首先,该研究是一项单中心回顾性研究,并未取得入组患者的生存数据; 其次,虽然我们排除了影响SII的一些疾病因素,但如果患者刻意隐瞒或者病历中未记载,这仍可能对实验结果产生一些影响。因此,未来需要进行更大样本量的前瞻性队列研究,并取得生存数据,以获得SII与乳腺癌患者预后更直接的关系。
作者贡献
姜聪:数据收集与分析、论文设计及撰写
黄元夕:论文指导
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Derks MGM, van de Velde CJH. Neoadjuvant chemotherapy in breast cancer: more than just downsizing[J]. Lancet Oncol, 2018, 19(1): 2-3. DOI:10.1016/S1470-2045(17)30914-2 |
| [3] |
中国乳腺癌新辅助治疗专家组. 中国乳腺癌新辅助治疗专家共识(2019年版)[J]. 中国癌症杂志, 2019, 29(5): 390-400. [Chinese expert group of neoadjuvant therapy for breast cancer. Consensus of Chinese experts on neoadjuvant therapy for breast cancer (2019)[J]. Zhongguo Ai Zheng Za Zhi, 2019, 29(5): 390-400.] |
| [4] |
Aziz MH, Sideras K, Aziz NA, et al. The Systemic-immune-inflammation Index Independently Predicts Survival and Recurrence in Resectable Pancreatic Cancer and its Prognostic Value Depends on Bilirubin Levels: A Retrospective Multicenter Cohort Study[J]. Ann Surg, 2019, 270(1): 139-146. DOI:10.1097/SLA.0000000000002660 |
| [5] |
Wang B, Huang Y, Lin T. Prognostic impact of elevated pre-treatment systemic immune-inflammation index (SⅡ) in hepatocellular carcinoma: A meta-analysis[J]. Medicine (Baltimore), 2020, 99(1): e18571. DOI:10.1097/MD.0000000000018571 |
| [6] |
Wang Q, Zhu D. The prognostic value of systemic immune-inflammation index (SⅡ) in patients after radical operation for carcinoma of stomach in gastric cancer[J]. J Gastrointest Oncol, 2019, 10(5): 965-978. DOI:10.21037/jgo.2019.05.03 |
| [7] |
Wang-Lopez Q, Chalabi N, Abrial C, et al. Can pathologic complete response (pCR) be used as a surrogate marker of survival after neoadjuvant therapy for breast cancer?[J]. Crit Rev Oncol Hematol, 2015, 95(1): 88-104. DOI:10.1016/j.critrevonc.2015.02.011 |
| [8] |
Li X, Dai D, Chen B, et al. Oncological outcome of complete response after neoadjuvant chemotherapy for breast conserving surgery: a systematic review and meta-analysis[J]. World J Surg Oncol, 2017, 15(1): 210. DOI:10.1186/s12957-017-1273-6 |
| [9] |
Angelucci D, Tinari N, Grassadonia A, et al. Long-term outcome of neoadjuvant systemic therapy for locally advanced breast cancer in routine clinical practice[J]. J Cancer Res Clin Oncol, 2013, 139(2): 269-280. DOI:10.1007/s00432-012-1325-9 |
| [10] |
Grassadonia A, Di Nicola M, Grossi S, et al. Long-term outcome of neoadjuvant endocrine therapy with aromatase inhibitors in elderly women with hormone receptor-positive breast cancer[J]. Ann Surg Oncol, 2014, 21(5): 1575-1582. DOI:10.1245/s10434-014-3535-7 |
| [11] |
Cortazar P, Zhang L, Untch M, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis[J]. Lancet, 2014, 384(9938): 164-172. DOI:10.1016/S0140-6736(13)62422-8 |
| [12] |
Teshome M, Hunt KK. Neoadjuvant therapy in the treatment of breast cancer[J]. Surg Oncol Clin N Am, 2014, 23(3): 505-523. DOI:10.1016/j.soc.2014.03.006 |
| [13] |
Li XB, Krishnamurti U, Bhattarai S, et al. Biomarkers predicting pathologic complete response to neoadjuvant chemotherapy in breast cancer[J]. Am J Clin Pathol, 2016, 145(6): 871-878. DOI:10.1093/ajcp/aqw045 |
| [14] |
von Minckwitz G, Blohmer JU, Costa SD, et al. Response-guided neoadjuvant chemotherapy for breast cancer[J]. J Clin Oncol, 2013, 31(29): 3623-3630. DOI:10.1200/JCO.2012.45.0940 |
| [15] |
李曼曼, 徐斌, 邵营波, 等. 不同雌激素受体状态下化疗周期对乳腺癌新辅助化疗病理完全缓解率的影响[J]. 肿瘤防治研究, 2017, 44(1): 38-41. [Li MM, Xu B, Shao YB, et al. Effect of neoadjuvant chemotherapy cycles on pathologic complete response rate under different estrogen receptor status of breast cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2017, 44(1): 38-41.] |
| [16] |
Moses C, Garcia-Bloj B, Harvey AR, et al. Hallmarks of cancer: The CRISPR generation[J]. Eur J Cancer, 2018, 93: 10-18. DOI:10.1016/j.ejca.2018.01.002 |
| [17] |
Zha C, Meng X, Li L, et al. Neutrophil extracellular traps mediate the crosstalk between glioma progression and the tumor microenvironment via the HMGB1/RAGE/IL-8 axis[J]. Cancer Biol Med, 2020, 17(1): 154-168. |
| [18] |
Franco AT, Corken A, Ware J. Platelets at the interface of thrombosis, inflammation, and cancer[J]. Blood, 2015, 126(5): 582-588. DOI:10.1182/blood-2014-08-531582 |
| [19] |
Lee H, Lee M, Seo JH, et al. Changes in tumor-infiltrating lymphocytes after neoadjuvant chemotherapy and clinical significance in triple negative breast cancer[J]. Anticancer Res, 2020, 40(4): 1883-1890. DOI:10.21873/anticanres.14142 |
| [20] |
Wang Q, Xiang Q, Yu L, et al. Changes in tumor-infiltrating lymphocytes and vascular normalization in breast cancer patients after neoadjuvant chemotherapy and their correlations with DFS[J]. Front Oncol, 2020, 9: 1545. DOI:10.3389/fonc.2019.01545 |
| [21] |
Chen L, Kong X, Wang Z, et al. Pre-treatment systemic immune-inflammation index is a useful prognostic indicator in patients with breast cancer undergoing neoadjuvant chemotherapy[J]. J Cell Mol Med, 2020, 24(5): 2993-3021. DOI:10.1111/jcmm.14934 |
| [22] |
Liu J, Shi Z, Bai Y, et al. Prognostic significance of systemic immune-inflammation index in triple-negative breast cancer[J]. Cancer Manag Res, 2019, 11: 4471-4480. DOI:10.2147/CMAR.S197623 |
| [23] |
Sun Y, Li W, Li AJ, et al. Increased systemic immune-inflammation index independently predicts poor survival for hormone receptor-negative, HER2-positive breast cancer patients[J]. Cancer Manag Res, 2019, 11: 3153-3162. DOI:10.2147/CMAR.S190335 |
| [24] |
Kim T, Han W, Kim MK, et al. Predictive Significance of p53, Ki-67, and Bcl-2 Expression for Pathologic Complete Response after Neoadjuvant Chemotherapy for Triple-Negative Breast Cancer[J]. J Breast Cancer, 2015, 18(1): 16-21. |
| [25] |
Zeng Y, Wang CL, Xian J, et al. Positive correlation between programmed death ligand-1 and p53 in triple-negative breast cancer[J]. Onco Targets Ther, 2019, 12: 7193-7201. DOI:10.2147/OTT.S209484 |
| [26] |
Alam F, Mezhal F, El Hasasna H, et al. The role of p53-microRNA 200-Moesin axis in invasion and drug resistance of breast cancer cells[J]. Tumour Biol, 2017, 39(9): 1010428317714634. |
| [27] |
Wellenstein MD, Coffelt SB, Duits DEM, et al. Loss of p53 triggers WNT-dependent systemic inflammation to drive breast cancer metastasis[J]. Nature, 2019, 572(7770): 538-542. DOI:10.1038/s41586-019-1450-6 |
| [28] |
Stodden GR, Lindberg ME, King ML, et al. Loss of Cdh1 and Trp53 in the uterus induces chronic inflammation with modification of tumor microenvironment[J]. Oncogene, 2015, 34(19): 2471-2482. |
| [29] |
Cooks T, Pateras IS, Tarcic O, et al. Mutant p53 prolongs NF-κB activation and promotes chronic inflammation and inflammation-associated colorectal cancer[J]. Cancer Cell, 2013, 23(5): 634-646. DOI:10.1016/j.ccr.2013.03.022 |
| [30] |
张立志, 刘平, 吉慧军, 等. 全身免疫炎症指数(SⅡ)对胶质瘤患者临床预后的影响及与p53突变的关系[J]. 现代肿瘤医学, 2018, 26(24): 3937-3943. [Zhang LZ, Liu P, Ji HJ, et al. Systemic immune-inflammation index(SⅡ) in patients with glioma and its relationship with p53 mutation[J]. Xian Dai Zhong Liu Yi Xue, 2018, 26(24): 3937-3943.] |
 2020, Vol. 47
2020, Vol. 47