文章信息
- 去泛素化酶USP22在恶性肿瘤中多样性的作用机制
- Varions Mechanisms of Deubiquitinating Enzyme USP22 in Cancer
- 肿瘤防治研究, 2020, 47(12): 969-974
- Cancer Research on Prevention and Treatment, 2020, 47(12): 969-974
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0270
- 收稿日期: 2020-03-27
- 修回日期: 2020-06-01
人类基因组编码大约100种去泛素酶(deubiquitinating enzymes, DUBs)[1],根据它们之间的组成序列、结构相似性以及作用机制的不同可分为七大家族,其中泛素特异性蛋白酶(ubiquitin specific proteases, USPs)占50%以上。USP22为USPs家族的成员之一,广泛分布于人体细胞及组织中,是人类Spt-Ada-Gcn5乙酰转移酶(hSAGA)转录辅助因子复合物的一个关键亚基[2]。既往USP22多以癌基因的角色出现在学者们的研究视野中,被证实能够通过多种途径调控癌细胞的生长增殖,但最近研究结果提示[3-4],USP22在恶性肿瘤中并非“非黑即白”的绝对致癌作用,在某些特定状态下,USP22也能够发挥抑癌作用。因此,USP22在不同恶性肿瘤的特异性作用机制值得关注和研究。
1 USP22概述2005年研究人员利用微阵列技术建立敲除多梳基因(polycomb group, PcG)BMI-1(B-cell specific moloney leukemia virus insertion site 1)的小鼠前列腺原发癌及肺腺癌转移瘤模型,发现一组具有肿瘤干细胞表型特征的基因,命名为“Polycomb/肿瘤干细胞信号”,与肿瘤的发生、远处转移、术后复发和治疗耐药密切相关[5-6]。
USP22属于“Polycomb/肿瘤干细胞信号”家族的一员[3],位于人类基因组17号染色体长臂,包含13个外显子,其cDNA具有1 578个碱基对,翻译产生包含525个氨基酸的蛋白质(分子量60 kDa),在哺乳动物中普遍表达,主要定位于细胞核。USP22的羧基端包含半胱氨酸盒(Cysteine, Cys Box)和组氨酸盒(Histidine, His Box),具有泛素水解酶活性,可以将靶蛋白和泛素分子解离;氨基端的锌指结构是与其他蛋白质相互作用的结构基础,见图 1。Ubp8、Nonstop和Usp22分别是USP22在酵母菌、果蝇及小鼠中的同源物,它们通过去泛素化组蛋白H2B和H2A及非组蛋白底物调控基因转录,参与调节生物体内的生物学过程[7-8]。
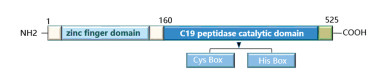
|
| 图 1 USP22结构示意图 Figure 1 Structure diagram of USP22 |
SAGA影响人体内多种转录因子的活性,研究提示人类的去泛素化体系对具有转录活性基因的H2B都具有催化作用,USP22作为hSAGA的关键亚基,主要通过去泛素化H2A和H2B启动靶基因转录、调控细胞周期、参与DNA的损伤修复[9-10],因此USP22可看作一个广泛的转录激活因子[11-12]。c-Myc作为原癌基因参与转录调控多种蛋白表达,基因组学数据显示,在多种恶性肿瘤中c-Myc、USP22的mRNA和蛋白水平均显著升高,且c-Myc及其靶基因转录活性的维持需要USP22的存在,其机制可能是通过USP22的去泛素化作用直接或间接实现[2]。雄激素受体(androgen receptor, AR)是配体诱导型转录因子的核受体超家族成员,USP22可正向调控c-Myc和AR本身及其共调节基因表达[13],同时,USP22也可去泛素化AR使其免受蛋白酶体的识别而降解。类似的转录调控也发生在Kras突变所驱动的血液系统恶性肿瘤中,然而,在Kras突变驱动下的骨髓增生性肿瘤(Kras-MPNs)动物模型中,USP22缺失依然增加了c-Myc及其靶基因的表达,但机制尚不明确[3]。此外,USP22同样能够启动抑癌基因如P53及其靶基因的转录,提示USP22可能发挥抑癌作用[2]。
2.2 USP22在恶性肿瘤中的基因表达和突变情况目前研究普遍提示在多种恶性肿瘤中USP22的蛋白水平高表达,但是来自癌症基因组图谱(the cancer genome atlas, TCGA)的测序数据显示,USP22的mRNA水平在不同恶性肿瘤中呈现不同趋势,与正常组织相比,USP22的mRNA在子宫内膜癌、直肠腺癌、宫颈癌、结肠癌、肺鳞癌、乳腺癌中呈低表达,见图 2A,这与USP22在蛋白水平的表达情况并不完全一致。此外,在不同类型恶性肿瘤中,基因水平上USP22的突变发生率不同,见图 2B,并且在同种恶性肿瘤类型中不同突变类型的发生率也不同,见图 2C~D。因此,USP22也可能是一个单倍拷贝数不足的肿瘤抑制基因,其表达缺失也可能导致癌症的发生。提示USP22在不同层面上对恶性肿瘤调控作用的多样性,这对于进一步研究其在癌症中的功能和作用机制具有指导意义。
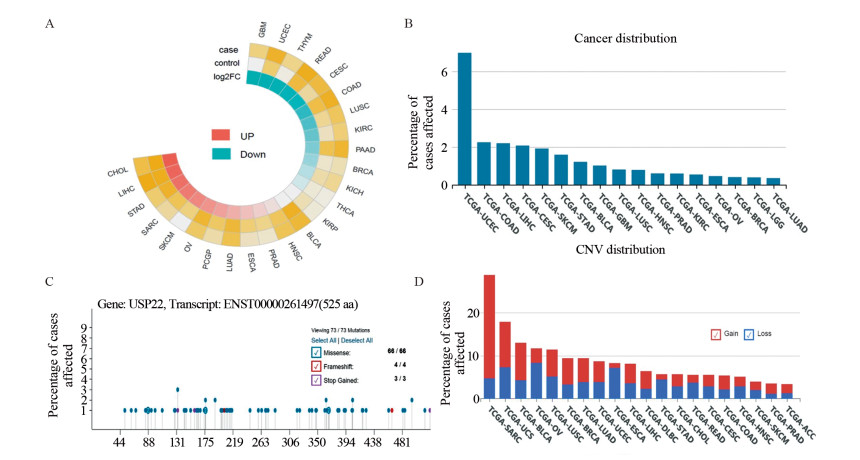
|
| A: the mRNA expression of USP22 in different types of cancer; B: the mutation rate of USP22 in different types of cancer; C: gene copy variation of USP22 in different types of cancer: Gain and Loss mutations; D: the mutational events of USP22 in ENST00000261497 (525 aa) transcripts. 图 2 USP22的基因表达和突变情况(数据来源:TCGA) Figure 2 Gene expression and mutation of USP22 (Data source: TCGA) |
USP22的锌指结构识别并结合泛素化的底物蛋白,具有泛素水解酶活性的区域对底物蛋白进行去泛素化修饰使靶蛋白免受蛋白酶体降解从而持续表达发挥致癌或抑癌作用。
3.1 USP22与Sirt1/p53p53参与恶性肿瘤中细胞周期、细胞衰老以及细胞凋亡等多种信号通路。沉默信息调节因子2同系物1(sirtuin 1, Sirt1)是一种组蛋白去乙酰化酶,能够去乙酰化p53影响其在细胞内的作用。研究表明USP22通过去泛素化移除Sirt1分子上的多泛素链,阻止其被泛素化降解,间接抑制p53靶基因的转录激活[14]。E3泛素连接酶Mdm2(murine double minute 2)能够使p53泛素化降解,有学者利用RNA干扰技术抑制USP22表达,发现Mdm2和cyclin E的表达降低,导致p53和p21的表达上调,使细胞周期停滞并抑制膀胱癌细胞增殖[15]。有文献报道酪氨酸激酶基因FLT3的串联重复突变也与c-Myc活性增加、USP22表达水平、Sirt1含量及p53靶基因抑制相关[16]。
3.2 USP22与肿瘤免疫程序性死亡受体1(programmed cell death protein 1, PD-1)及其配体(PD-L1)的高表达使癌细胞免于机体免疫系统的攻击。有学者利用去泛素化酶抑制剂筛选发现USP22可以去泛素化PD-L1阻止其被蛋白酶体降解,引起癌细胞对免疫治疗耐受,而敲降USP22增强了免疫治疗疗效,并且能够逆转癌细胞的耐药[17]。目前已被证实的抑制PD-L1表达能够增强以细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)为靶点的免疫治疗效果[18-19],那么干扰USP22表达是否也能够成为免疫治疗中的“增强子”需要进一步研究。
此外,最新研究发现胰腺癌中USP22的缺失促进了T细胞和NK细胞的浸润,抑制了癌细胞的转移,且增强了联合免疫治疗的效果,这是通过与SAGA/STAGA转录共激活复合物的去泛素化酶模块结合重塑胰腺癌细胞转录组,从而对肿瘤免疫微环境发挥了作用,提示USP22在调节肿瘤免疫微环境方面的作用[20]。虽然目前尚无USP22特异性抑制剂应用于基础研究或临床治疗,但就目前基于USP22与肿瘤免疫相关的研究结果,未来USP22很有可能在免疫治疗方面发挥至关重要的作用。
3.3 USP22与缺氧诱导因子1α缺氧诱导因子1α(hypoxia inducible factor-1α, HIF1α)是低氧诱导条件下促进肿瘤细胞增殖和侵袭的关键驱动因素。最新一项研究揭示了USP22通过去泛素化和稳定HIF1α促进癌细胞内糖酵解和肝癌细胞的干性维持。作为HIF1α的直接靶基因,USP22和p53在缺氧条件下被HIF1α转录上调,在p53突变时,USP22和HIF1α形成一个正反馈回路互相调节促进糖酵解及维持癌细胞干性调控癌细胞增殖,而在p53野生状态时,这种调节机制并不存在。体内实验靶向抑制USP22显著增强了肝癌细胞对索拉非尼的敏感度,同时大数据表明p53突变合并USP22和(或)HIF1α高表达的患者预后更差[21],提示USP22作为去泛素化酶在肿瘤代谢方面有不可忽视的作用。
人类乳腺癌易感基因2(breast cancer early onset, BRCA2)的协同因子PALB2(partner and localizer of BRCA2)在DNA损伤修复和细胞周期进程中发挥重要作用。USP22的泛素化结构域与PALB2羧基末端WD-40结构域结合激活USP22的去泛素化功能,稳定细胞中PALB2和BRCA2蛋白表达,参与DNA损伤修复,同时,USP22还可能去泛素化修饰PALB2的赖氨酸残基,但具体作用机制尚不明确,亟待进一步研究[10]。除前所述,USP22还可通过去泛素化修饰稳定端粒重复序列结合因子1(telomeric repeat binding factor 1, TRF1)的表达,参与细胞凋亡[22];能够移除环氧化酶-2(cyclooxygenase-2, COX-2)多聚泛素化链诱导COX-2持续表达,参与恶性肿瘤发生[23]。由此可见USP22的去泛素化修饰作用在癌症的发生发展中发挥重要作用。
4 USP22的生物学功能 4.1 维持细胞干性和胚胎发育研究发现USP22通过Wnt/β-catenin信号通路调控肿瘤干细胞标志基因CD133、CD44和Sox2的表达,维持肿瘤细胞干性和诱导化疗耐药进而促进癌症进展[24]。BMI-1通路是正常干细胞和肿瘤干细胞的关键调控机制。USP22高表达激活BMI-1驱动的信号通路,使肿瘤细胞表现出转移倾向和治疗抵抗[2]。
小鼠Usp22与人类USP22高度同源[8]。小鼠Usp22缺失导致胚胎发育迟缓,干细胞向大脑细胞及小肠细胞分化功能受损,大多数胚胎无法存活,而Usp22高表达时在没有刺激分化的条件下也可诱导胚胎干细胞向胚胎小体分化。此外,Usp22能够通过去泛素化转录因子发状分裂相关增强子1(hairy and enhancer of split 1, Hes1)负向调控小鼠大脑发育中的神经元分化[25]。推测人类USP22可能在人类胚胎发育及干细胞分化方面发挥重要作用。
4.2 诱导肿瘤耐药自噬能够促进肿瘤细胞对外界刺激的抵抗,如放疗和化疗等。研究发现USP22表达上调可以激活ERK1/2通路促进自噬相关蛋白LC3(microtubule-associated protein 1 light Chain 3)转化为其活性形式的LC3Ⅱ,增加自噬小体的数量,增强癌细胞增殖能力和耐药性[26]。USP22还能够正向调控Sirt1,增强自噬相关基因ATG5和ATG7的去乙酰化活性,诱导自噬发生,从而诱导肝癌细胞对奥沙利铂等化疗药物耐药[27]。此外,在肺腺癌中已证实USP22通过去泛素化修饰调控表皮生长因子受体(epidermal growth factor receptor, EGFR)的内吞转运作用,稳定细胞内EGFR蛋白水平,促进EGFR依赖的信号通路持续活化,诱发EGFR酪氨酸激酶抑制剂(EGFR-tyrosine kinase inhibitors, EGFR-TKIs)耐药[28]。
4.3 调控细胞周期大量研究证实USP22在调控细胞周期中发挥重要作用。在G1/S期,USP22通过去泛素化修饰细胞周期素1(CCND1)抑制其降解,促进细胞由G1期转变进入S期[29]。此外,USP22移除FBP1(果糖-1, 6-二磷酸酶1)Lys63多聚泛素化链,该链阻碍了FBP1对Cyclin/CDK复合物抑制剂p21的抑制作用[30]。USP22亦可通过调节β-Catenin/Wnt信号,增加叉头蛋白转录因子M1(forkhead box protein M1, FoxM1)的含量,负向调控两种细胞周期蛋白依赖性激酶(cyclin-dependent kinase, CDK)抑制剂p21和p27的表达,从而CCND1、CDK4和CDK6表达升高,后者共同形成G1期转变复合物加速细胞周期进程[31]。
USP22也被证实在G2/M期时发挥作用[32]。蛋白组学分析发现USP22与CCNB1在肿瘤组织中的表达呈显著正相关,且二者表达水平在细胞周期中呈现相同趋势,当细胞分裂进入G2/M期,CDK1的146号天冬氨酸位点识别并作用于USP22的S237/T147位点使其磷酸化激活,增强其去泛素化CCNB1的能力。M期结束时,后期促进复合物/周期体(anaphase-promoting complex/cyclosome, APC/C)利用其衔接蛋白CDC20识别USP22氨基末端特定位点降解USP22,导致CCNB1被蛋白酶体降解,至下一个G2/M期时二者表达又呈现出周期性变化。
综上所述,USP22通过多途径影响细胞周期,目前CDK4/6抑制剂已有效应用于乳腺癌的治疗,靶向USP22与CDK抑制剂联用是否能有效提高肿瘤患者的预后有待进一步研究,但细胞周期进程的复杂性使以细胞周期为切入点的抗肿瘤治疗研究任重而道远。
4.4 其他生物学功能Janus激酶信号转导(JAK)及转录激活蛋白(STAT)信号通路近年在肿瘤中研究颇多,USP22介导的H2B去泛素化修饰过程可以激活JAK/STAT通路中的靶基因调控癌症进展[33]。上皮-间质转化(epithelial-mesenchymal transition, EMT)是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程,本课题组证实USP22直接调节EMT的标志性蛋白E-cadherin和N-cadherin以及TGF-β1的表达[34],另外USP22激活FAK信号通路上调EMT的特异性因子Snail和ZEB1表达间接促进EMT发生[35]。除上所述,研究证实USP22参与多个肿瘤相关信号通路调控,如肿瘤血管生成相关通路、c-Myc/NAMPT/ SIRT1依赖的叉头转录因子O亚家族1(forkhead box transcription factor O1, FOXO1)和Yes相关蛋白(yes-associated protein, YAP)信号通路、依赖SOS1(son of sevenless 1)激活的RAS/ERK和PI3K/AKT信号通路以及GSK3β-USP22-KDM1A轴(糖原合成酶激酶3β-USP22-赖氨酸特异性组蛋白去甲基化酶1(lysine(K)-specific demethylation 1A, KDM1A))等途径促进肿瘤进展[36-39],提示以USP22为靶点或成为有效的抗肿瘤治疗新靶点。
5 USP22作为抑癌因子目前多数研究表明USP22在多种癌症中高表达,然而,一个基于KrasG12D/+突变动物模型证实了USP22的抑癌作用[3],在Kras-MPNs中,USP22缺失并不影响癌细胞的增殖和凋亡,仅导致骨髓细胞分化阻滞,促进肿瘤向急性髓性白血病(AML)转变,加速小鼠死亡。无独有偶,在特异性敲除USP22的结肠癌动物模型中,USP22缺失促进肿瘤增殖和侵袭,并激活mTOR(雷帕霉素靶蛋白)信号通路,增强结肠癌对mTOR抑制剂的敏感度,并且这种抑癌作用在Apc1638N/+突变的肿瘤中更加显著[4]。此外,USP22和抑癌基因钙调神经磷酸酶调节蛋白(regulator of calcineurin 1, RCAN1)可直接相互作用[40]。但目前支持USP22作为抑癌因子的数据甚少,研究也尚在探索阶段,此发现对未来基于USP22表达决定特定治疗亚组具有重要意义。
6 结语USP22在不同肿瘤微环境中能够发挥促癌或抑癌的双重作用。目前USP22的致癌作用得到了广泛研究与证实,但是其抑癌作用研究证据尚且不足。USP22是否能够独立发挥抑癌作用还必须依赖于特定肿瘤微环境的改变尚未可知,因此评估USP22在肿瘤中的状态是进一步研究其作用机制的关键。相信随着研究的更加深入,USP22的去泛素化功能在肿瘤中的角色也将更加明确。目前已有多种去泛素化酶特异性抑制剂在研究阶段,相信在不久的未来USP22对改进当前肿瘤的治疗方案将产生更加深远的影响。
作者贡献
孙悦:文献调研、论文设计及撰写
韩冰、甄芳:文献调研
胡晶:课题项目负责人及论文指导与审核
| [1] |
Clague MJ, Urbé S, Komander D. Breaking the chains: deubiquitylating enzyme specificity begets function[J]. Nat Rev Mol Cell Biol, 2019, 20(6): 338-352. |
| [2] |
Zhang XY, Varthi M, Sykes SM, et al. The putative cancer stem cell marker USP22 is a subunit of the human SAGA complex required for activator-driven transcription and cell cycle progression[J]. Mol Cell, 2008, 29(1): 102-111. |
| [3] |
Melo-Cardenas J, Xu Y, Wei J, et al. USP22 deficiency leads to myeloid leukemia upon oncogenic Kras activation through a PU.1-dependent mechanism[J]. Blood, 2018, 132(4): 423-434. |
| [4] |
Kosinsky RL, Zerche M, Saul D, et al. USP22 exerts tumor-suppressive functions in colorectal cancer by decreasing mTOR activity[J]. Cell Death Differ, 2020, 27(4): 1328-1340. |
| [5] |
Glinsky GV, Berezovska O, Glinskii AB. Microarray analysis identifies a death-from-cancer signature predicting therapy failure in patients with multiple types of cancer[J]. J Clin Invest, 2005, 115(6): 1503-1521. |
| [6] |
Glinsky GV. Genomic models of metastatic cancer: functional analysis of death-from-cancer signature genes reveals aneuploid, anoikis-resistant, metastasis-enabling phenotype with altered cell cycle control and activated Polycomb Group (PcG) protein chromatin silencing pathway[J]. Cell Cycle, 2006, 5(11): 1208-1216. |
| [7] |
Samara NL, Datta AB, Berndsen CE, et al. Structural insights into the assembly and function of the SAGA deubiquitinating module[J]. Science, 2010, 328(5981): 1025-1029. |
| [8] |
Koutelou E, Wang L, Schibler AC, et al. USP22 controls multiple signaling pathways that are essential for vasculature formation in the mouse placenta[J]. Development, 2019, 146(4): pii: dev174037. |
| [9] |
McCann JJ, Vasilevskaya IA, Poudel Neupane N, et al. USP22 functions as an oncogenic driver in prostate cancer by regulating cell proliferation and DNA repair[J]. Cancer Res, 2020, 80(3): 430-443. |
| [10] |
Nardi IK, Stark JM, Larsen A, et al. USP22 interacts with PALB2 and promotes chemotherapy resistance via homologous recombination of DNA double strand breaks[J]. Mol Cancer Res, 2020, 18(3): 424-435. |
| [11] |
Bonnet J, Wang CY, Baptista T, et al. The SAGA coactivator complex acts on the whole transcribed genome and is required for RNA polymerase Ⅱ transcription[J]. Genes Dev, 2014, 28(18): 1999-2012. |
| [12] |
Lang G, Bonnet J, Umlauf D, et al. The tightly controlled deubiquitination activity of the human SAGA complex differentially modifies distinct gene regulatory elements[J]. Mol Cell Biol, 2011, 31(18): 3734-3744. |
| [13] |
Schrecengost RS, Dean JL, Goodwin JF, et al. USP22 regulates oncogenic signaling pathways to drive lethal cancer progression[J]. Cancer Res, 2014, 74(1): 272-286. |
| [14] |
Lin Z, Yang H, Kong Q, et al. USP22 antagonizes p53 transcriptional activation by deubiquitinating Sirt1 to suppress cell apoptosis and is required for mouse embryonic development[J]. Mol Cell, 2012, 46(4): 484-494. |
| [15] |
Lv L, Xiao XY, Gu ZH, et al. Silencing USP22 by asymmetric structure of interfering RNA inhibits proliferation and induces cell cycle arrest in bladder cancer cells[J]. Mol Cell Biochem, 2011, 346(1-2): 11-21. |
| [16] |
Li L, Osdal T, Ho Y, et al. SIRT1 activation by a c-MYC oncogenic network promotes the maintenance and drug resistance of human FLT3-ITD acute myeloid leukemia stem cells[J]. Cell Stem Cell, 2014, 15(4): 431-446. |
| [17] |
Huang X, Zhang Q, Lou Y, et al. USP22 deubiquitinates CD274 to suppress anti-cancer immunity[J]. Cancer Immunol Res, 2019, 7(10): 1580-1590. |
| [18] |
Lim SO, Li CW, Xia W, et al. Deubiquitination and Stabilization of PD-L1 by CSN5[J]. Cancer Cell, 2016, 30(6): 925-939. |
| [19] |
Lu X, Horner JW, Paul E, et al. Effective combinatorial immunotherapy for castration-resistant prostate cancer[J]. Nature, 2017, 543(7647): 728-732. |
| [20] |
Li J, Yuan S, Norgard RJ, et al. Tumor cell-intrinsic USP22 suppresses antitumor immunity in pancreatic cancer[J]. Cancer Immunol Res, 2020, 8(3): 282-291. |
| [21] |
Ling S, Shan Q, Zhan Q, et al. USP22 promotes hypoxia-induced hepatocellular carcinoma stemness by a HIF1alpha/USP22 positive feedback loop upon TP53 inactivation[J]. Gut, 2019, pii: gutjnl-2019-319616. |
| [22] |
Atanassov BS, Evrard YA, Multani AS, et al. Gcn5 and SAGA regulate shelterin protein turnover and telomere maintenance[J]. Mol Cell, 2009, 35(3): 352-364. |
| [23] |
Xiong H, Li B, He J, et al. lncRNA HULC promotes the growth of hepatocellular carcinoma cells via stabilizing COX-2 protein[J]. Biochem Biophys Res Commun, 2017, 490(3): 693-699. |
| [24] |
Jiang S, Song C, Gu X, et al. Ubiquitin-Specific Peptidase 22 Contributes to Colorectal Cancer Stemness and Chemoresistance via Wnt/beta-Catenin Pathway[J]. Cell Physiol Biochem, 2018, 46(4): 1412-1422. |
| [25] |
Kobayashi T, Iwamoto Y, Takashima K, et al. Deubiquitinating enzymes regulate Hes1 stability and neuronal differentiation[J]. FEBS J, 2015, 282(13): 2411-2423. |
| [26] |
Liang JX, Ning Z, Gao W, et al. Ubiquitin specific protease 22 induced autophagy is correlated with poor prognosis of pancreatic cancer[J]. Oncol Rep, 2014, 32(6): 2726-2734. |
| [27] |
Xiong H, Ni Z, He J, et al. LncRNA HULC triggers autophagy via stabilizing Sirt1 and attenuates the chemosensitivity of HCC cells[J]. Oncogene, 2017, 36(25): 3528-3540. |
| [28] |
Zhang H, Han B, Lu H, et al. USP22 promotes resistance to EGFR-TKIs by preventing ubiquitination-mediated EGFR degradation in EGFR-mutant lung adenocarcinoma[J]. Cancer Lett, 2018, 433: 186-198. |
| [29] |
Gennaro VJ, Stanek TJ, Peck AR, et al. Control of CCND1 ubiquitylation by the catalytic SAGA subunit USP22 is essential for cell cycle progression through G1 in cancer cells[J]. Proc Natl Acad Sci U S A, 2018, 115(40): E9298-E9307. |
| [30] |
Atanassov BS, Dent SYR. USP22 regulates cell proliferation by deubiquitinating the transcriptional regulator FBP1[J]. EMBO Rep, 2011, 12(9): 924-930. |
| [31] |
Ning Z, Wang A, Liang J, et al. USP22 promotes the G1/S phase transition by upregulating FoxM1 expression via β-catenin nuclear localization and is associated with poor prognosis in stage Ⅱ pancreatic ductal adenocarcinoma[J]. Int J Oncol, 2014, 45(4): 1594-1608. |
| [32] |
Lin Z, Tan C, Qiu Q, et al. Ubiquitin-specific protease 22 is a deubiquitinase of CCNB1[J]. Cell Discov, 2015, 1: 15028. |
| [33] |
Chipumuro E, Henriksen MA. The ubiquitin hydrolase USP22 contributes to 3'-end processing of JAK-STAT-inducible genes[J]. FASEB J, 2012, 26(2): 842-854. |
| [34] |
Hu J, Yang D, Zhang H, et al. USP22 promotes tumor progression and induces epithelial-mesenchymal transition in lung adenocarcinoma[J]. Lung Cancer, 2015, 88(3): 239-245. |
| [35] |
Ning Z, Wang A, Liang J, et al. USP22 promotes epithelial-mesenchymal transition via the FAK pathway in pancreatic cancer cells[J]. Oncol Rep, 2014, 32(4): 1451-1458. |
| [36] |
Zhang K, Yang L, Wang J, et al. Ubiquitin-specific protease 22 is critical to in vivo angiogenesis, growth and metastasis of non-small cell lung cancer[J]. Cell Commun Signal, 2019, 17(1): 167. |
| [37] |
Liu H, Liu N, Zhao Y, et al. Oncogenic USP22 supports gastric cancer growth and metastasis by activating c-Myc/NAMPT/SIRT1-dependent FOXO1 and YAP signaling[J]. Aging(Albany NY), 2019, 11(21): 9643-9660. |
| [38] |
Lim C, Xu JC, Chen TY, et al. Ubiquitin-specific peptide 22 acts as an oncogene in gastric cancer in a son of sevenless 1-dependent manner[J]. Cancer Cell Int, 2020, 20: 45. |
| [39] |
Zhou A, Lin K, Zhang S, et al. Nuclear GSK3β promotes tumorigenesis by phosphorylating KDM1A and inducing its deubiquitylation by USP22[J]. Nat Cell Biol, 2016, 18(9): 954-966. |
| [40] |
Hong A, Lee JE, Chung KC. Ubiquitin-specific protease 22 (USP22) positively regulates RCAN1 protein levels through RCAN1 de-ubiquitination[J]. J Cell Physiol, 2015, 230(7): 1651-1660. |
 2020, Vol. 47
2020, Vol. 47


