文章信息
- 胃癌组织中PDCD4基因的表达和甲基化水平及其临床意义
- Expression and Methylation of PDCD4 in Gastric Carcinoma and Its Clinical Significance
- 肿瘤防治研究, 2020, 47(12): 942-946
- Cancer Research on Prevention and Treatment, 2020, 47(12): 942-946
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0178
- 收稿日期: 2020-03-06
- 修回日期: 2020-06-15
2. 230022 合肥,安徽医科大学第一附属医院胃肠外科
2. Department of Gastrointestinal Surgery, The First Affiliated Hospital of Anhui Medical University, Hefei 230022, China
胃癌是全球常见的肿瘤之一,其死亡率居第三位[1]。我国胃癌发病率超过20/10万,是全球发病率最高的地区[2]。目前手术治疗依旧是胃癌最主要的治疗手段,根治术配伍化疗可使早期胃癌患者5年生存率达到95%以上[3]。但由于胃癌早期症状隐匿且缺乏敏感度高、特异性强的早期筛查措施,约50%的患者被确诊时已处于中晚期,错失最佳的手术治疗时机。抑癌基因失活在胃癌发生发展中起到了重要作用,探索其机制将对胃癌诊断和治疗策略的开发具有重要意义。程序性细胞死亡因子4(programmed cell death 4, PDCD4)是近年来新发现的一种抑癌基因,可通过调节细胞凋亡水平发挥抑癌作用[4]。目前已在胃癌、乳腺癌、肝癌等多种肿瘤中发现PDCD4表达缺失[5-7],但对其相关机制了解甚少。启动子区高甲基化是抑癌基因表达缺失的常见原因,本研究中我们观察了胃癌组织中PDCD4表达水平的变化及其与胃癌患者临床病理特征之间的相关性,并分析了启动子高甲基化对PDCD4表达的影响。
1 资料与方法 1.1 临床资料选取2018年1月—2019年9月安徽医科大学第一附属医院,经根治术切除的胃癌组织及其配对的癌旁组织各70例,其中男36例、女34例,年龄38~75岁,中位年龄为56岁。70例胃癌标本中,高、中分化42例、低分化28例,伴有淋巴结转移46例,根据TNM分期标准,Ⅰ~Ⅱ期20例、Ⅲ~Ⅳ期50例。同时取30例正常胃黏膜组织作为对照。癌旁组织均取自距离肿瘤边缘3~6 cm处。所有患者及健康体检者均得到本人或家属的知情同意,并报我院伦理委员会批准。
1.2 主要试剂兔抗大鼠PDCD4多克隆抗体购自美国Proteintech公司;免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司;DAB试剂盒购自北京博奥森生物技术有限公司;光学显微镜购自日本Olympus;蛋白提取RIPA裂解液、GAPDH抗体购自美国Cell Signaling公司;Western blot电泳仪购自美国伯乐公司;改良型BCA法蛋白浓度测定试剂盒购自美国Pierce公司;Western blot转膜液、PVDF膜、SDS-PAGE凝胶配置试剂盒均购自上海碧云天生物技术公司;DNA提取试剂盒购自北京天根生化科技有限公司;cDNA反转录试剂盒、RT-PCR试剂盒均购自日本TaKaRa公司;DNA甲基化修饰试剂盒购自德国Qiagen公司;引物由上海生工生物工程有限公司合成。
1.3 HE染色将胃癌及癌旁组织放入预先配好的固定液中进行固定。去除固定液,将固定好的组织用梯度酒精脱水,二甲苯透明,石蜡包埋后切成4 μm薄片,而后进行HE染色,并在显微镜下分析记录胃癌组织的分化程度、浸润深度、肿瘤直径、淋巴结转移等病理指标。
1.4 免疫组织化学染色取石蜡标本脱蜡水化,3% H2O2溶液灭活内源性过氧化物酶,微波修复抗原,5%山羊血室温封闭后,滴加一抗,4℃孵育过夜,而后滴加二抗,37℃孵育30 min后,DAB显色,苏木精对比染色,脱水,中性树胶封片。用已知PDCD4阳性切片作为阳性对照,PBS液代替一抗作为阴性对照。实验结果判定:所有免疫组织化学染色结果均由2名病理科医师通过双盲法进行独立评估。随机选取5个高倍视野(×400)进行观察。细胞着色强度:无色为0分、浅黄色为1分、棕黄色为2分、黄褐色为3分。细胞着色数量:< 25%为0分、25%~50%为1分、≥50%~75%为2分、≥75%为3分。对细胞着色强度与着色数量的乘积进行计算,选取的5个视野中任一视野计分 > 3分记为阳性,否则为阴性。
1.5 Western blot检测PDCD4的表达将组织样本100 mg切碎研磨并放入组织匀浆器球状部位后加入蛋白提取裂解液2 ml,放置于冰上30 min。2 000 r/min,离心30 min后,提取上清液1.5 ml至EP管中。通过BCA法对蛋白定量后进行SDS-PAGE电泳,并于4℃条件下进行转膜。转膜后将PVDF膜放于封闭液中,4℃封闭4 h,加入PDCD4及GAPGH一抗,4℃孵育过夜,再加入二抗,室温孵育2 h。通过凝胶成像系统对目的蛋白以及内参蛋白免疫印迹条带进行灰度值分析。
1.6 MSP法检测PDCD4基因CpG岛甲基化水平严格按照DNA提取试剂盒说明书对组织中DNA进行提取,将10 μl提取后的DNA加入EP管中,完成亚硫酸盐修饰,并对DNA进行纯化,将其浓度调整至适宜范围,再使用甲基化引物进行PCR扩增。PDCD4甲基化引物通过MethPrimer软件设计,由上海生工生物工程有限公司合成。引物序列为:5’-TCG TCG TTA CGA TTG GTT AGT C-3’和5’-GAA AAA TCT CTA ACC CTT CTC GC-3’。USP引物序列为5’-GGT TTT GTT GTT ATG ATT GGT TAG TT-3’和5’-CAA AAA ATC TCT AAC CCT TCT CAC T-3’。PCR 20 μl反应体系包括:Taq酶0.5 μl、dNTP 0.5 μl、甲基化上游引物、下游引物各0.5 μl、10×Buffer 2 μl、亚硫酸盐修饰后DNA模板2 μl以及水13 μl。体系配置好后放入PCR仪中进行PCR扩增。扩增结束后利用琼脂糖凝胶电泳进行检测,凝胶扫描仪查看结果,扩增后得到非甲基化引物扩增产物为非甲基化(U),出现甲基化引物扩增产物为甲基化(M)。实验中用经甲基化转移酶处理修饰DNA作为阳性对照,未处理者作为阴性对照,无DNA模板作为空白对照。甲基化程度=100/[1+2(CtCG探针值-CtTG探针值)],结果 < 40为阳性。
1.7 RT-PCR检测PDCD4 mRNA表达通过TRIzol法提取标本中总RNA,通过分光光度计法检测RNA的完整性,符合反转录实验要求后,根据cDNA合成试剂盒说明书反转录合成cDNA,反转录条件:37℃ 30 min,98℃ 5 min,-20℃保存。以cDNA为模板,与基因特异性引物进行PCR扩增。扩增条件:94℃ 30 s,1个循环;94℃ 50 s、59℃ 30 s共40个循环;95℃ 2 s、60℃ 15 s、95℃ 2 s,一个循环,于50℃保存。对解离曲线进行分析,确定只有一种产物被扩增,再进行相对定量分析,结果以2-ΔΔCt表示,GAPDH为内参基因[8]。
1.8 统计学方法采用SPSS16.0统计软件对数据进行分析,卡方检验对PDCD4表达水平、PDCD4甲基化水平与临床病理情况之间的关系进行分析,P < 0.05为差异有统计学意义。
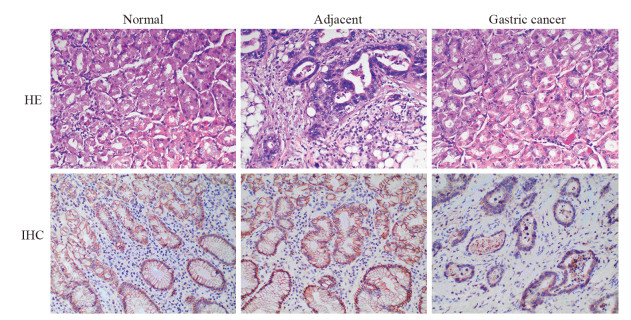
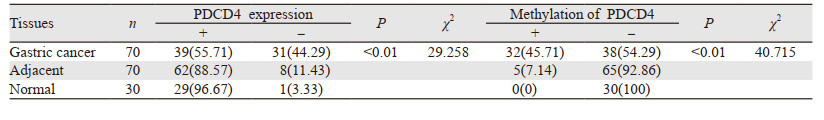
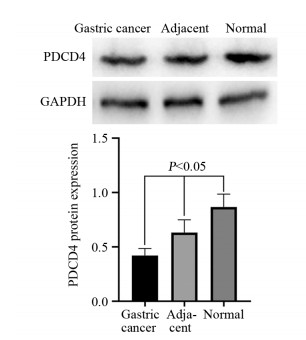
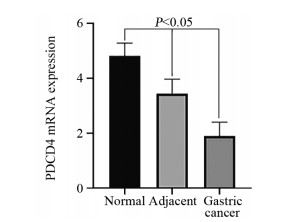
2 结果 2.1 胃癌组织中PDCD4表达PDCD4主要表达于细胞质,见图 1。其中胃癌组织中PDCD4表达阳性率(55.71%)较癌旁(88.57%)以及正常组织(96.67%)显著下降(P < 0.05);癌旁组织中PDCD4表达阳性率较正常胃黏膜组织有所降低,但差异无统计学意义(P > 0.05),见表 1。Western blot法检测结果显示胃癌组织中PDCD4表达显著低于癌旁及正常组织(P < 0.05),见图 2。RT-PCR检测结果显示胃癌组织中PDCD4 mRNA表达水平显著低于癌旁及正常组织(P < 0.05),见图 3。
|
| 图 1 胃癌、正常及癌旁组织中PDCD4蛋白表达(×200) Figure 1 PDCD4 protein expression in gastric cancer, normal and para-carcinoma tissues (×200) |
|
|
| 图 2 Western blot法检测正常、癌旁以及胃癌组织中PDCD4表达情况 Figure 2 Expression of PDCD4 in normal tissues, adjacent tissues and gastric cancer tissues detected by Western blot |
|
| 图 3 胃癌、癌旁及正常组织中PDCD4 mRNA表达 Figure 3 PDCD4 mRNA expression in normal tissues, adjacent tissues and gastric cancer tissues |
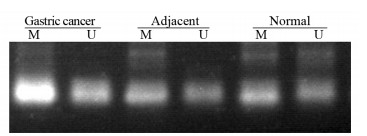
MSP检测结果显示与癌旁(7.14%)及正常组织(0.00%)相比,胃癌组织(45.71%)中PDCD4基因启动子甲基化显著增强(P < 0.05);癌旁组织中PDCD4甲基化程度较正常胃黏膜有所升高,但差异无统计学意义(P > 0.05),见图 4、表 1。
|
| M: methylation; U: unmethylation. 图 4 胃癌、癌旁以及正常组织中PDCD4启动子甲基化情况 Figure 4 Methylation of PDCD4 gene promoter in gastric cancer, adjacent and normal tissues |
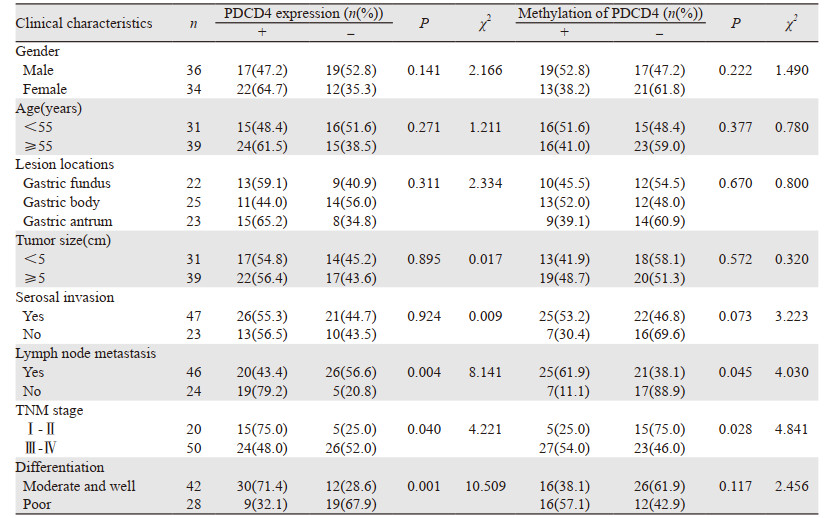
研究结果发现PDCD4表达缺失与胃癌的分化、临床分期以及淋巴结转移密切相关(P < 0.05),PDCD4启动子高甲基化与胃癌的临床分期及淋巴结转移密切相关(P < 0.05),见表 2。
|
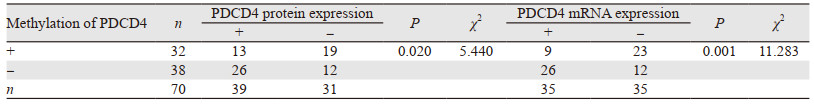
以胃癌组织中PDCD4 mRNA相对表达量的中位数(1.76)将胃癌组织分为PDCD4 mRNA高表达组(> 1.76)和低表达组(< 1.76)各35例。对PDCD4蛋白表达、mRNA表达水平与PDCD4甲基化水平之间相关性进行分析,结果显示PDCD4甲基化水平与PDCD4蛋白以及mRNA表达水平均呈负相关(P < 0.05),见表 3。
|
近几十年来,虽然胃癌发病率持续下降,但依旧是最常见的肿瘤之一。由于胃癌的发病机制尚不清楚,且缺乏有效的早期诊断方法,对晚期胃癌难以取得理想的治疗效果。抑癌基因表达缺失在胃癌的发生发展过程中扮演着重要的角色,深入探究其发生机制对胃癌的诊治具有重要价值。PDCD4定位于人10q24染色体,可通过转录及翻译阶段调节与细胞增殖、凋亡相关的多种蛋白的表达起到抑制胃癌的作用[9]。PDCD4表达缺失已被证实与多种肿瘤的发生发展密切相关。Tao等[6]在研究中发现miR-21可在转录后水平抑制PDCD4的表达,增强乳腺癌细胞的增殖能力和对紫杉醇的耐药性;Dorrello等[10]发现S6K1可通过泛素依赖机制下调PDCD4的表达,促进胶质瘤细胞的增殖。Zeng等[11]通过质粒转染上调PDCD4表达后有效抑制了宫颈癌细胞的增殖、迁移以及侵袭能力,并促进其发生凋亡。本研究通过免疫组织化学、Western blot以及RT-PCR法进行检测,发现与癌旁以及正常组织相比,胃癌组织中PDCD4蛋白及mRNA表达水平均显著下调。分析PDCD4表达水平与胃癌患者临床病理特征之间的关系发现,PDCD4蛋白表达缺失与胃癌的分化、分期以及淋巴结转移密切相关,与其他研究结果一致,表明PDCD4表达缺失与胃癌的发生发展相关,而其低表达可能发生于转录以及转录后阶段。
DNA甲基化是人体内重要的表观遗传修饰途径,其在基因表达调控中发挥着关键作用。启动子CpG岛甲基化通常会导致基因转录受阻,是导致抑癌基因表达缺失的一种重要机制。Ding等[12]在研究中发现5’CpG岛高甲基化可能是肝癌中PDCD4蛋白和mRNA低表达的原因;Gao等[13]也通过研究证实启动子高甲基化与PDCD4 mRNA表达缺失密切相关。本研究通过MSP法进行检测,发现胃癌组织中PDCD4启动子区甲基化水平显著高于癌旁以及正常组织,且PDCD4高甲基化与胃癌淋巴结转移及临床分期密切相关。此外,我们还发现PDCD4甲基化水平与PDCD4蛋白及mRNA表达水平均呈负相关。与其他研究结果相符,表明PDCD4高甲基化与胃癌发生发展相关,且可能是PDCD4表达缺失的原因。
本研究发现,在胃癌组织中PDCD4表达显著减弱,且与胃癌的分化、分期以及转移密切相关;而启动子区高甲基化可能是PDCD4表达缺失的原因。该研究结果表明PDCD4的甲基化水平以及表达水平与胃癌的发生发展密切相关,对于胃癌的诊断以及临床病理特征的评估具有参考意义。miR-21是与胃癌发生发展密切相关的一种miRNA,并可下调PDCD4的表达[14-15]。下一步研究中,我们将观察胃癌中miR-21对PDCD4启动子甲基化水平的影响,以探究胃癌组织中PDCD4启动子高甲基化的机制。
作者贡献
巴赫:试验实施、研究结果分析及论文撰写与修改
彭强:提供试验标本
朱耀东:研究设计、主持并指导研究
| [1] |
Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-386. |
| [2] |
Charalampakis N, Economopoulou P, Kotsantis I, et al. Medical management of gastric cancer: a 2017 update[J]. Cancer Med, 2018, 7(1): 123-133. |
| [3] |
Song Z, Wu Y, Yang J, et al. Progress in the treatment of advanced gastric cancer[J]. Tumour Biol, 2017, 39(7): 1010428317714626. |
| [4] |
Zennami K, Choi SM, Liao R, et al. PDCD4 Is an Androgen-Repressed Tumor Suppressor that Regulates Prostate Cancer Growth and Castration Resistance[J]. Mol Cancer Res, 2019, 17(2): 618-627. |
| [5] |
Zhang Y, Zhu Z, Huang S, et al. lncRNA XIST regulates proliferation and migration of hepatocellular carcinoma cells by acting as miR-497-5p molecular sponge and targeting PDCD4[J]. Cancer Cell Int, 2019, 19: 198. |
| [6] |
Tao L, Wu YQ, Zhang SP. MiR-21-5p enhances the progression and paclitaxel resistance in drug-resistant breast cancer cell lines by targeting PDCD4[J]. Neoplasma, 2019, 66(5): 746-755. |
| [7] |
Wong CC, Kang W, Xu J, et al. Prostaglandin E2 induces DNA hypermethylation in gastric cancer in vitro and in vivo[J]. Theranostics, 2019, 9(21): 6256-6268. |
| [8] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 25(4): 402-408. |
| [9] |
Matsuhashi S, Manirujjaman M, Hamajima H, et al. Control Mechanisms of the Tumor Suppressor PDCD4: Expression and Functions[J]. Int J Mol Sci, 2019, 20(9): 2304. |
| [10] |
Dorrello NV, Peschiaroli A, Guardavaccaro D, et al. S6K1-and betaTRCP-mediated degradation of PDCD4 promotes protein translation and cell growth[J]. Science, 2006, 314(5798): 467-471. |
| [11] |
Zeng T, Zhang Q, Yu X, et al. Inhibition of cell migration and invasion and promotion of cell apoptosis by overexpression of programmed cell death 4(PDCD4) in cervical cancer Siha cells[J]. Int J Clin Exp Path, 2018, 11(9): 4676-4683. |
| [12] |
Ding X, Cheng X, Gong M, et al. Hypermethylation and Expression Silencing of PDCD4 Gene in Hepatocellular Carcinoma: A Consort Study[J]. Medicine(Baltimore), 2016, 95(6): e2729. |
| [13] |
Gao F, Wang X, Zhu F, et al. PDCD4 gene silencing in gliomas is associated with 5'CpG island methylation and unfavourable prognosis[J]. J Cell Mol Med, 2009, 13(10): 4257-4267. |
| [14] |
Bautista-Sánchez D, Arriaga-Canon C, Pedroza-Torres A, et al. The Promising Role of miR-21 as a Cancer Biomarker and Its Importance in RNA-Based Therapeutics[J]. Mol Ther Nucleic Acids, 2020, 20: 409-420. |
| [15] |
吴佳成, 陆雅君, 姜力. miR-21下调程序性死亡细胞4对抑制裸鼠肾细胞癌肿瘤转化和增殖的实验研究[J]. 疑难病杂志, 2019, 18(1): 61-66. [Wu JC, Lu YJ, Jiang L. Inhibitory effect of down-regulation of programmed death cell 4 by microRNA-21 on tumorigenesis and proliferation of renal cell carcinoma in nude mice[J]. Yi Nan Bing Za Zhi, 2019, 18(1): 61-66.] |
 2020, Vol. 47
2020, Vol. 47


