文章信息
- 局部复发鼻咽癌的外科挽救治疗
- Salvage Surgery of Local Recurrent Nasopharyngeal Carcinoma
- 肿瘤防治研究, 2020, 47(4): 235-242
- Cancer Research on Prevention and Treatment, 2020, 47(4): 235-242
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0173
- 收稿日期: 2020-03-06
- 修回日期: 2020-04-03
2. 510060 广州,华南肿瘤学国家重点实验室,肿瘤医学协同创新中心,广东省鼻咽癌诊治重点实验室
2. State Key Laboratory of Oncology in South China; Collaborative Innovation Center for Cancer Medicine; Guangdong Key Laboratory of Nasopharyngeal Carcinoma Diagnosis and Therapy, Guangzhou 510060, China
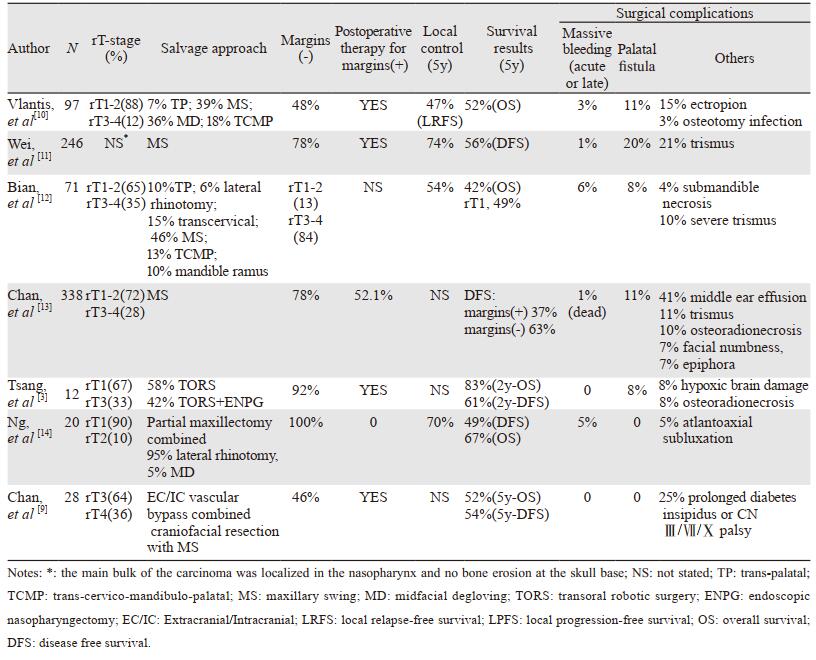
挽救性外科治疗应用于局部复发鼻咽癌的主要原因为:手术直接切除放疗不敏感的病灶,避免了二次放射性损伤,相关后遗症较轻;首程放疗除杀灭可见的肿瘤原发灶和转移淋巴结外,还封闭了淋巴转移通道,因此对于残留、复发鼻咽癌原位或区域淋巴结病灶,只需要将病灶进行扩大切除,无需进行扩大的鼻咽原发灶与颈部淋巴结联合根治手术。然而美国NCCN指南对于鼻咽部复发癌灶并未完全首推手术治疗,根本原因在于鼻咽切除术创伤大,难度高,普及性差:鼻咽位于头颅的中央,解剖位置深,在传统鼻外径路需要掀开面部才能暴露鼻咽腔,手术创伤大,难以按肿瘤外科原则进行整块根治性切除;鼻咽毗邻许多重要组织器官,尤其是咽旁间隙内的颈内动脉(internal carotid artery, ICA),误伤后果严重。因此,只有少数肿瘤中心才能开展此类手术,大部分局部复发患者仍需接受二程放疗。随着耳鼻咽喉头颈外科医师的经验积累,以及近十余年来微创外科的发展,鼻咽癌原发灶挽救手术逐步得到广泛认可,成为局部复发鼻咽癌的主流治疗手段。
1 鼻外径路开放式手术复发鼻咽癌手术入路选择的基本原则是在外科创伤尽可能小的前提下,充分暴露鼻咽,彻底切除鼻咽肿瘤。鼻咽类似于六面长方体,手术入路可归纳为自前、后、上、下、侧方五类。前方可经鼻中隔、双侧后鼻孔区进入鼻咽,下方经软腭,侧方经咽旁间隙及咽鼓管区进入鼻咽,这些入路相对创伤较小,较为常用。而上方入路必须经过前颅底暴露蝶窦和蝶鞍,再由蝶窦底壁进入鼻咽,操作复杂、严重并发症较多,可用于前三个入路的联合手段。后方可经枕骨基底部和第1、2颈椎进入鼻咽,但需穿越脑干、脊髓,得不偿失,罕有报道。
1.1 下方入路即经腭入路,是鼻咽部手术的最常用、最经典的入路,暴露鼻咽距离最短,操作相对简单。适用于鼻咽癌放疗后鼻咽顶后壁残留或复发的患者,并要求患者无张口受限。但该进路鼻咽暴露不充分,难以切除超出鼻咽腔及咽旁间隙的病灶。
1.1.1 传统经腭入路(Trans-Palatal)1988年,屠规益教授、Fee等独立报道了经腭入路切除复发鼻咽癌病灶。为扩大切除范围、保护ICA,可以进一步联合颈部、下颌骨切开,即经颈-下颌-腭入路(Trans-Cervico-Mandibulo-Palatal),1996年由Morton首次报道。该入路可以完全暴露鼻咽部,且能够清晰地自颈部解剖ICA至颅底,避免手术误伤,缺点是会破坏大量正常组织并引起术后并发症,如腭瘘、张口受限等。
1.1.2 经口机器人手术(Transoral Robotic Surgery, TORS)Ozer等[1]首次报道了经口机器人鼻咽切除术试验。2010年,香港大学玛丽医院Wei等[2]报道了第一例用达芬奇手术机器人治疗复发性鼻咽癌的临床病例。2015年,Tsang等[3]又报道了12例,其中4例rT3患者均合并经鼻内镜鼻咽切除术(endoscopic Nasopharyngectomy, ENPG),2年OS和无病生存率(disease-free survival, DFS)分别为83%和61%,然而这些病例仍需切开上腭。为克服这一问题,Richmon[4]、Tsang等[5]在实验室中实现了经口不切开软腭的鼻咽切除术。2017年,Chan等[6]临床研究表明经口保留软腭的方法可以暴露鼻咽,但未证实实际应用于鼻咽切除术的可行性。达芬奇手术机器人能够呈现高清三维图像,且具有三个机械臂,能够双手操作,并过滤手部颤动,使手术更加精密敏捷;然而其缺少骨钻等仪器,在处理鼻咽部、颅底部等多骨质环绕的病灶仍存在较大局限。
1.2 侧方入路 1.2.1 颞下窝入路(Infratemporal Fossa)1983年Fisch首次将其用于残留/复发鼻咽癌的切除。2005年Choi等[7]曾用该入路治疗11例复发鼻咽癌患者,其中6例局限于同侧咽隐窝或侵及咽旁的rT1、rT2病灶手术切缘阴性;但超过中线的2例rT1、rT2不能整块切除。该术式可以切除侵及鼻咽侧壁和咽旁间隙的癌瘤或沿咽鼓管侵及中耳乳突者,但对于癌灶已侵及对侧鼻咽者不宜使用,且创伤大、操作复杂,易出现第Ⅴ颅神经损伤、听力障碍、张口受限等并发症。
1.2.2 经下颌骨翼突入路(Trans-Mandibular-Pterygoid)该入路由Yomoto等于1992年报道,适用于鼻咽侧壁的残留或复发癌且伴有咽旁间隙淋巴结残留或复发的病例。术中容易处理和保护大血管、颅神经,可切除鼻咽、咽旁和颅底的肿瘤。但创伤大,术中需暂时切断下颌骨升支,切除下颌骨冠状突,损伤颞颌关节和面神经下颌缘支。
1.3 前方入路 1.3.1 面中部脱套入路(Midfacial Degloving incision)2001年To等[8]首次报道了15例经此入路治疗的复发鼻咽癌患者,其中80%rT1~2患者切缘阴性。该术式主要优点是没有面部切口且不会破坏上颚功能,术后并发症轻微;缺点是术野相对狭小,鼻咽侧壁暴露不佳,术中无法将手指伸入咽旁间隙触诊,辅助定位ICA。
1.3.2 上颌骨外翻入路(Maxillary swing)1991年由韦霖教授首次介绍,适用于鼻咽侧壁复发及向外轻度侵犯咽旁间隙的鼻咽癌患者。该术式是迄今为止影响力最大、报道病例数最多的鼻咽癌鼻外径路之一,解决了常规鼻外进路面临的三大难题:(1)鼻咽暴露和操作空间:该术式可以充分暴露鼻咽前壁、侧壁、顶壁、顶后壁及鼻咽旁间隙,操作空间大,能够安全地将鼻咽及浸润至鼻咽旁间隙的肿瘤整块切除。(2)ICA的识别与保护:术中可触及ICA搏动,其周围病变可在直视下分离。(3)鼻咽部创面的愈合:由于鼻咽部接受过根治性放疗,鼻咽黏膜愈合能力差,术后易发生颅底骨质骨髓炎、颅内感染等并发症;该术式在上颌骨外翻后仍附着于颊瓣上,由颊部肌皮瓣供血,术后上颌骨坏死发生率较低,创面可用游离肌皮瓣修复,有利于鼻咽部创面愈合。2016年,陈汝威等[9]报告了颅内外血管搭桥术后联合颅面切除术(面部切口采用上颌骨外翻入路)治疗的rT3~4期鼻咽癌患者28例,此方法能够直接切除受侵ICA,达到整块切除的目的,扩大了鼻咽挽救手术的适应证。然而25%患者有手术相关并发症,生存质量评分显示术后躯体功能、吞咽、语言、张口受限、口干等与术前相比均有恶化。
无论采取哪一种手术径路,常规鼻外径路无一避免地需要切除或者切开头面部正常组织结构,从而给患者造成永久性的后遗症,见表 1。面中部脱套入路虽没有面部切口,无需游离上颌骨, 但需切除双侧鼻腔外侧壁和鼻中隔, 彻底牺牲了双侧鼻腔、鼻窦的生理功能,并非真正的微创。作为鼻外径路最新进展的机器人鼻咽切除术,在最大程度上减轻了腭进路的副损伤,但是依旧需要切开软腭,并受到患者张口程度、肿瘤位置等多种限制。实际上,虽然常规鼻咽癌救援手术的疗效增益比挽救性放疗大,但由于创伤较大,已逐渐被鼻内镜外科手术所取代。
|
1990年代后期,随着鼻内镜器械的发展及功能性鼻内镜外科技术的成熟,微创外科开始应用于鼻窦恶性肿瘤治疗。21世纪初,经鼻内镜手术治疗局部复发鼻咽癌的探索也随之展开,并逐渐成为主流技术。
2.1 内镜肿瘤消融术上世纪80年代开始,软性纤维镜开始应用于鼻咽部检查,与间接鼻咽镜相比优势明显。然而,由于早期纤维软镜依靠镜头处的吸引管吸引分泌物,镜头容易污染,视野不够清晰;吸引管管径小、负压不足,难以吸除浓稠分泌物,且容易堵塞,无法清理结痂的块状分泌/坏死物;需双手持镜,镜身较粗,转向和操作不方便等缺点,无法进行常规外科切割、分离、止血等操作,因而多采取肿瘤消融手段。1998年,吴鸿泉等首次报告了3例经鼻内镜下微波治疗放疗后残留的鼻咽癌患者。2009年,Mai等[15]总结了采用内镜下微波固化术治疗rT1期鼻咽癌患者55例,术后局部复发5例,5年局部无进展生存率(local progression-free survival, LPFS)和OS分别为90.7%和93.6%,均无严重并发症。同年,Ko等[16]应用KTP激光治疗复发鼻咽癌,其中rT1期12例,rT2期16例,术后仅3例切缘阳性,rT1和rT2的2年OS分别为90.9%和38.5%。据以上研究,初步可认为对于rT1患者内镜下行肿瘤消融效果满意。相较于鼻咽切除术,该方法操作简单,无需长期外科训练,内镜医师即可操作。但仍存在以下不足:(1)适应证窄:以微波消融术为例,仅适用于局限于鼻咽顶后壁中线附近,直径小于1.5 cm的小结节,受众患者少;(2)难以获得手术切缘病理情况,手术效果无法准确评估。随着经鼻内镜鼻咽切除术的日渐成熟,内镜消融手术逐渐被取代。
2.2 经鼻内镜鼻咽切除术相较于软镜,硬性鼻内镜仅需单手持镜,解放了外科医生的一只手;并将吸引和手术操作的通道剥离,将其发展为配套的外科器械,仅保留暴露功能;分辨率更高,借助不同角度的广角镜头,鼻咽暴露更加清楚。然而,功能性鼻内镜外科运用于鼻咽癌内镜下根治切除,依然存在三个技术瓶颈。
2.2.1 如何整块切除鼻咽癌并获得足够的安全边界2005年,Yoshizaki等通过切除鼻中隔后部来增加器械操作的空间并改善可视化效果,并使用内窥镜固定器,使外科医生可以双手操作。2007年,陈明远等[17]进一步提出“第三只手”、“包饺子技术”和“六面鼻咽切除法”等一系列概念:术中由助手使用吸引器清除烟雾,并配合主刀辅助牵拉,成为主刀的“第三只手”,减少鼻咽狭窄、操作困难的限制;通过切除包绕癌灶的周围正常组织,做到不接触并整块切除癌灶;鼻咽腔呈六面长方体状,周围大部分为骨质所包绕,内镜术中只要沿着鼻咽腔外骨面进行剥离、切除,即可切除鼻咽前壁、顶壁和顶后壁的黏膜,不易伤及毗邻重要器官,并做到根治性切除。Becker等[18]进行尸头解剖后认为,鼻内镜手术可以控制的范围包括:破裂孔上方、咽鼓管峡部后上方、翼外板外侧、头长肌和茎突咽肌后方、斜坡后上方、颅咽筋膜外侧;在此区域以内的肿瘤,均可在鼻内镜下根治性切除。据此可见,经鼻内镜鼻咽切除术可以实现以最小的生理代价彻底切除肿瘤,切除范围与鼻外径路相仿甚至更大。
2.2.2 如何妥善修复伤口放射治疗和手术创伤均可造成鼻咽及颅底组织缺血,愈合能力下降,此为术后创面感染的重要原因,而当感染侵袭ICA时则可诱发致死性ICA出血,故而术后鼻咽颅底重建至关重要。由于鼻内进路无法使用鼻外径路常用的带血管游离皮瓣,既往多采用无血供游离皮片、黏膜片或肌肉浆等,修复效果极差。陈明远教授等率先报道带蒂中鼻甲黏膜瓣修复鼻咽切口,96%(24/25)的患者鼻咽创面均能够完全愈合,结果较为成功,但中鼻甲黏膜瓣面积过小,无法完全覆盖整个鼻咽创面[17];带蒂鼻中隔-鼻底黏膜瓣可进一步扩大修复面积,研究显示12例患者(2例术前经历二程放疗)创面修复成功率100%[19]。目前已涌现更多的颅底重建方法,例如下鼻甲黏膜瓣、鼻腔外侧壁黏膜瓣、颞浅筋膜瓣以及局部人工材料等。
2.2.3 如何保护ICA常用的ICA解剖标志有:咽鼓管软骨定位咽旁段ICA,腭帆张肌定位上咽旁段ICA;若肿瘤侵犯咽旁间隙深部或伴有岩尖侵犯,可采用翼管、翼管神经定位破裂孔段ICA,但需广泛暴露上颌窦、翼腭窝等鼻咽毗邻组织。在精确定位ICA的前提下,对于肿瘤或坏死病灶接近ICA的患者,术前需行ICA球囊闭塞试验(balloon occlusion test, BOT),评估误伤ICA导致大出血、偏瘫的机会。同时我们认为对于BOT阴性且术中ICA出血风险极高者,术前可预防性栓塞ICA[20]。
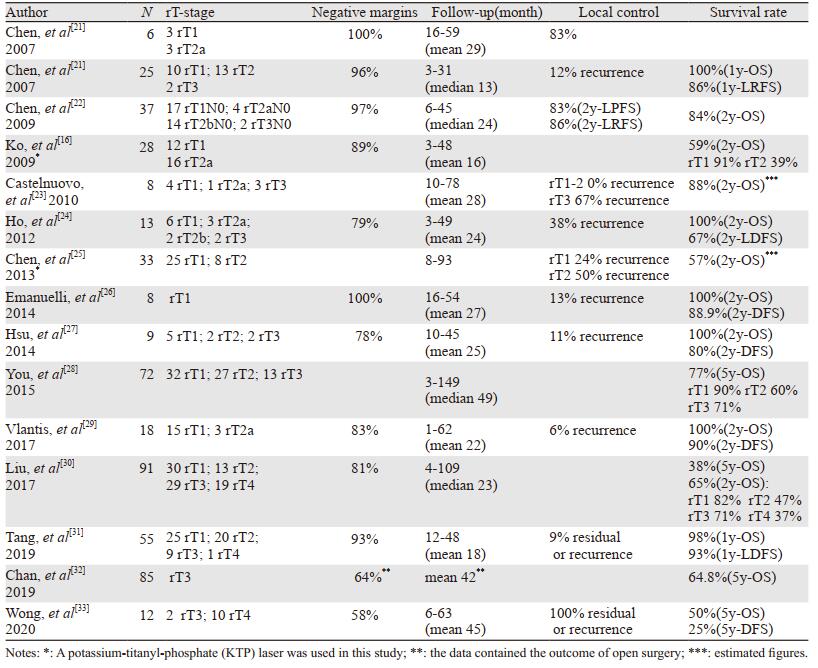
基于以上三个问题的解决,经鼻内镜鼻咽切除术日臻成熟并得以广泛实践,见表 2。陈明远教授率先发表了ENPG治疗复发鼻咽癌的论著[17],该研究报道25例rT1~3患者中,24例均为连续、整块切除,手术切缘均阴性,1年OS、局部无复发生存率(local relapse-free survival, LRFS)分别为100%、86.0%。2009年,Chen等[22]再次报道了37例(17例rTl,4例rT2a,14例rT2b,2例rT3),术后未追加放疗,仅1例切缘阳性,平均随访24月,2年OS、LRFS和LPFS分别为84.2%、86.3%和82.6%,其中rT1~2a期患者局部复发率仅为4.8%(1/21)。以上研究显示了经鼻内镜挽救手术对于早期复发鼻咽癌良好的应用前景。
|
随着鼻内镜技术的发展及术者的经验积累,经鼻内镜挽救手术的适应证也在逐步扩展,目前已有应用于rT4期患者的报道。2019年,复旦大学附属眼耳鼻喉科医院鼻颅底外科团队[34]对Castelnuovo教授提出的鼻内镜下鼻咽部切除术的手术分型进行了优化,并建立了ICA处理的分级策略。在新分型中,Ⅲ型手术切除范围可向外侧扩展至岩斜区外侧、颞下窝、中颅窝底(硬膜外)、眼眶及眶上裂、海绵窦及颅神经,用于处理rT3期(旁中线区)和rT4期(颅外)鼻咽癌;Ⅳ型手术在Ⅲ型的基础上对ICA的斜坡段、破裂孔段和咽旁段进行暴露,可连同ICA一起切除,也适用于侵犯中颅窝内的病变,并指出对于侵及ICA者,若术前BOT阴性,可行ICA闭塞,视病变侵犯程度切除相应ICA;若BOT阳性,可联用颅内外血管搭桥术后切除该段ICA,以获得干净切缘。此方法无疑扩大了鼻咽部可切除范围,为局部晚期鼻咽癌患者提供了另一种根治性治疗选择。然而该类手术多为分块切除,难以遵循肿瘤外科原则;手术创伤较大,术中切除咽鼓管、翼内肌等,易引起分泌性中耳炎和张口受限;术野曾接受过照射,术后伤口延迟愈合易致鼻咽坏死(12.1%)、鼻咽部大出血(9.9%)、颞叶坏死(2.2%)等[30];手术难度大、风险高,推广度受限。目前有研究报道ENPG治疗rT4期患者的2年OS为36.8%[30]、5年OS为40%[33],而基于IMRT治疗的rT3~4期鼻咽癌患者3年OS为47%~64%[35-36]、5年OS约为27.5%~28.8%[37-38]。由于手术治疗均为高选择病例、且数量较少,生存数据偏倚较大,尚无法判断孰优孰劣。如此大范围的手术治疗是否为局部晚期复发鼻咽癌的最佳选择,仍需更多循证医学证据。
多项临床研究已证实经鼻内镜救援性手术是局限性复发鼻咽癌的首选治疗手段。一项荟萃分析显示行挽救手术(开放入路及内镜手术)的779例患者,5年OS和疾病特异性生存率(disease-specific survival, DSS)分别为58%和63%,与二程放疗5年OS为26%~45%[39-40]相比,手术切除显然更具有优势;对于高分期肿瘤,ENPG较传统开放入路5年OS明显提高(66% vs. 12%, P=0.009)[41]。本团队通过倾向性得分匹配得到72对肿瘤大小、分期等均衡分布的、分别行ENPG和IMRT治疗的复发鼻咽癌患者队列,分析发现ENPG组5年OS(77.1% vs. 55.5%)、DSS(82.5% vs. 54.7%)均高于IMRT组,ENPG组相关病死率(5.6% vs. 34.7%)、并发症发生率(12.5% vs. 65.3%)和医疗成本(23 645.9元vs. 118 122.53元)均低于IMRT组,且多项生存质量评分显示ENPG组生活质量更好[28]。基于以上研究结果,我国《复发鼻咽癌治疗专家共识》指出,早期局部复发鼻咽癌,手术或放疗均可以应用,而对于区域复发患者,手术治疗为首选;英国鼻咽癌多学科指南明确手术治疗局部复发鼻咽癌为首选,放射治疗仅作为二线方案;美国国立综合癌症网络(NCCN)头颈部肿瘤临床实践指南将复发性鼻咽癌归于极晚期头颈部肿瘤,建议可手术切除的局部复发鼻咽癌亦可选择手术治疗。然而指南中并未明确定义复发鼻咽癌“可切除范围”的具体标准。
为了便于推广鼻咽癌微创外科治疗,2015年,本团队在UICC/AJCC rTNM分期系统的基础之上,通过目前最大宗的复发鼻咽癌研究(n=894),建立了“复发鼻咽癌外科分期”[42]:首先确立复发鼻咽癌微创外科的“可切除”范围,即局限在鼻咽腔内(rT1),或轻度侵犯咽旁间隙且距离ICA大于0.5 cm(rT2),或局限于蝶窦底壁或翼突基底部骨质侵犯且距离ICA、海绵窦大于0.5 cm的局部复发病灶(rT3),以及未浸润颈椎、臂丛神经、颈部肌肉、颈动脉的颈部复发病灶(rN1~3),超出此范围视为“不可切除”。据此将UICC/AJCC临床的rT1~4及rN0~3各期均细分为“可切除”“不可切除”两类(T分期共8亚组,N分期共7亚组),相近HR值和相似临床特点的不同亚组重新组合,将复发鼻咽癌分为四期:sⅠ期(微小病灶期),复发肿瘤局限在鼻咽腔,ENPG、IMRT、2D-CRT的5年OS分别为93.4%、71.1%、26.8%(P < 0.001),故首选微创外科治疗。sⅡ期(局限复发期),部分肿瘤虽超越鼻咽腔,但仍处于“可切除”范围内,ENPG和IMRT的5年OS分别为61.8%和53.8%(P=0.14),可见二者疗效相当,然而ENPG并发症更少,死亡风险较低,因此,选择微创外科可能更好。sⅢ期(广泛复发期),复发病灶已“不可切除”,IMRT、2D-CRT和单纯化疗的5年OS分别为27.7%、15.9%和16.2%(P < 0.05),故首选IMRT。sⅣ期(远处播散期),治疗上以姑息化疗为主,而单纯姑息化疗和联合放疗/手术5年OS分别为8.1%、16.4%(P=0.482),可见联合积极的局部区域治疗有助于提高疗效。相对于经典的UICC/AJCC rTNM分期系统,新型“复发鼻咽癌外科分期”不仅能够更好地预测预后(ROC曲线下面积为0.68 vs. 0.63, P < 0.001),且能够帮助医生和患者选择更合理的治疗。
3 小结鼻内镜外科与传统开放式手术相比,不仅微创,且能达到甚至超过传统手术切除范围;对于“可切除范围”的复发鼻咽癌,与IMRT相比,疗效更好、生存质量更优、费用更低,已成为sⅠ~Ⅱ期局部复发鼻咽癌的首选疗法。随着鼻内镜外科技术的进步,“可切除范围”仍然在不断突破,将给更多鼻咽癌患者带来福音。同时,其他治疗手段也日新月异。超分割调强放疗、质子重粒子放疗及应用于临床不久的FLASH放疗等,均有望减轻放射治疗毒性:上海质子重粒子中心[43]报道了用质子重粒子放射治疗的75例复发鼻咽癌患者(76%rT3~4期),1年OS及DSS高达98%及100%,急性和晚期毒性发生率均较低。化疗、靶向治疗以及免疫治疗将给患者带来长期缓解的机会:张力等[44]研究显示,吉西他滨加顺铂(GP方案)联合PD-1治疗转移和(或)复发鼻咽癌患者,总体反应率和疾病控制率高达91%和100%,最新随访结果显示,中位无病生存时间长达22月。
无论采取何种治疗方法,复发鼻咽癌的治疗目的和原则应该是以最小的生理和心理创伤为代价,换取最佳的肿瘤控制、最长的生存时间和最优的生存质量。如何消除学科偏见和盲区,综合运用新技术,根据患者的个人意愿和肿瘤特征,结合医疗中心的医疗水平和主治医师的特长习惯,选择个体化精准治疗方法,是我们目前亟需研究和解决的临床科学问题和职业道德问题。临床医师在临床决策过程中,需始终以患者利益为中心,能给予患者最佳方案则施以最佳治疗;若力不能及则应推荐至更加专业的中心/医生治疗,做到“有所为,有所不为”。
作者贡献
丁茜:文章撰写
陈明远:指导文章修改及审校
| [1] |
Ozer E, Waltonen J. Transoral robotic nasopharyngectomy: a novel approach for nasopharyngeal lesions[J]. Laryngoscope, 2008, 118(9): 1613-1616. |
| [2] |
Wei WI, Ho WK. Transoral robotic resection of recurrent nasopharyngeal carcinoma[J]. Laryngoscope, 2010, 120(10): 2011-2014. |
| [3] |
Tsang RK, To VS, Ho AC, et al. Early results of robotic assisted nasopharyngectomy for recurrent nasopharyngeal carcinoma[J]. Head Neck, 2015, 37(6): 788-793. |
| [4] |
Richmon JD. Transoral palate-sparing nasopharyngectomy with the Flex(R) System: preclinical study[J]. Laryngoscope, 2015, 125(2): 318-322. |
| [5] |
Tsang RK, Holsinger FC. Transoral endoscopic nasopharyngectomy with a flexible next-generation robotic surgical system[J]. Laryngoscope, 2016, 126(10): 2257-2262. |
| [6] |
Chan JYK, Wong EWY, Tsang RK, et al. Early results of a safety and feasibility clinical trial of a novel single-port flexible robot for transoral robotic surgery[J]. Eur Arch Otorhinolaryngol, 2017, 274(11): 3993-3996. |
| [7] |
Choi JY, Lee WS. Curative surgery for recurrent nasopharyngeal carcinoma via the infratemporal fossa approach[J]. Arch Otolaryngol Head Neck Surg, 2005, 131(3): 213-216. |
| [8] |
To EW, Teo PM, Ku PK, et al. Nasopharyngectomy for recurrent nasopharyngeal carcinoma: an innovative transnasal approach through a mid-face deglove incision with stereotactic navigation guidance[J]. Br J Oral Maxillofac Surg, 2001, 39(1): 55-62. |
| [9] |
Chan JY, Wong ST, Chan RC, et al. Extracranial/intracranial vascular bypass and craniofacial resection: New hope for patients with locally advanced recurrent nasopharyngeal carcinoma[J]. Head Neck, 2016, 38(Suppl 1): E1404-E1412. |
| [10] |
Vlantis AC, Chan HS, Tong MC, et al. Surgical salvage nasopharyngectomy for recurrent nasopharyngeal carcinoma: a multivariate analysis of prognostic factors[J]. Head Neck, 2011, 33(8): 1126-1131. |
| [11] |
Wei WI, Chan JY, Ng RW, et al. Surgical salvage of persistent or recurrent nasopharyngeal carcinoma with maxillary swing approach-Critical appraisal after 2 decades[J]. Head Neck, 2011, 33(7): 969-975. |
| [12] |
Bian X, Chen H, Liao L. A retrospective study of salvage surgery for recurrent nasopharyngeal carcinoma[J]. Int J Clin Oncol, 2012, 17(3): 212-217. |
| [13] |
Chan JY, Tsang RK, Wei WI. Morbidities after maxillary swing nasopharyngectomy for recurrent nasopharyngeal carcinoma[J]. Head Neck, 2015, 37(4): 487-492. |
| [14] |
Ng LS, Lim CM, Loh KS. Long-term outcomes of nasophar- yngectomy using partial maxillectomy approach[J]. Laryngoscope, 2016, 126(5): 1103-1107. |
| [15] |
Mai HQ, Mo HY, Deng JF, et al. Endoscopic microwave coagulation therapy for early recurrent T1 nasopharyngeal carcinoma[J]. Eur J Cancer, 2009, 45(7): 1107-1110. |
| [16] |
Ko JY, Wang CP, Ting LL, et al. Endoscopic nasopharyngectomy with potassium-titanyl-phosphate (KTP) laser for early locally recurrent nasopharyngeal carcinoma[J]. Head Neck, 2009, 31(10): 1309-1315. |
| [17] |
陈明远, 郭翔, 文卫平, 等. 局限性残留、复发鼻咽癌的鼻内镜进路救援性外科治疗[J]. 癌症(英文版), 2007, 26(7): 673-678. [Chen MY, Guo X, Wen WP, et al. Salvage surgical operation via endoscopic transnasal approach for local persistent or recurrent nasopharyngeal carcinoma[J]. Ai Zheng(Ying Wen Ban), 2007, 26(7): 673-678.] |
| [18] |
Becker AM, Hwang PH. Endoscopic endonasal anatomy of the nasopharynx in a cadaver model[J]. Int Forum Allergy Rhinol, 2013, 3(4): 319-324. |
| [19] |
Chen MY, Wang SL, Zhu YL, et al. Use of a posterior pedicle nasal septum and floor mucoperiosteum flap to resurface the nasopharynx after endoscopic nasopharyngectomy for recurrent nasopharyngeal carcinoma[J]. Head Neck, 2012, 34(10): 1383-1388. |
| [20] |
Zou X, Wang SL, Liu YP, et al. A curative-intent endoscopic surgery for postradiation nasopharyngeal necrosis in patients with nasopharyngeal carcinoma[J]. Cancer Commun (Lond), 2018, 38(1): 74. |
| [21] |
Chen MK, Lai JC, Chang CC, et al. Minimally invasive endoscopic nasopharyngectomy in the treatment of recurrent T1-2a nasopharyngeal carcinoma[J]. Laryngoscope, 2007, 117(5): 894-896. |
| [22] |
Chen MY, Wen WP, Guo X, et al. Endoscopic nasopharyngectomy for locally recurrent nasopharyngeal carcinoma[J]. Laryngoscope, 2009, 119(3): 516-522. |
| [23] |
Castelnuovo P, Dallan I, Bignami M, et al. Nasopharyngeal endoscopic resection in the management of selected malignancies: ten-year experience[J]. Rhinology, 2010, 48(1): 84-89. |
| [24] |
Ho AS, Kaplan MJ, Fee WE Jr, et al. Targeted endoscopic salvage nasopharyngectomy for recurrent nasopharyngeal carcinoma[J]. Int Forum Allergy Rhinol, 2012, 2(2): 166-173. |
| [25] |
Chen YF, Wang YF, Wang CP, et al. Magnetic resonance imaging following endoscopic nasopharyngectomy with a potassium-titanyl-phosphate (KTP) laser for early locally recurrent nasopharyngeal carcinoma[J]. Neuroradiology, 2013, 55(11): 1413-1421. |
| [26] |
Emanuelli E, Albu S, Cazzador D, et al. Endoscopic surgery for recurrent undifferentiated nasopharyngeal carcinoma[J]. J Craniofac Surg, 2014, 25(3): 1003-1008. |
| [27] |
Hsu NI, Shen PH, Chao SS, et al. En bloc resection concept for endoscopic endonasal nasopharyngectomy: surgical anatomy and outcome[J]. Chin Med J (Engl), 2014, 127(16): 2934-2939. |
| [28] |
You R, Zou X, Hua YJ, et al. Salvage endoscopic nasopharyngectomy is superior to intensity-modulated radiation therapy for local recurrence of selected T1-T3 nasopharyngeal carcinoma-A case-matched comparison[J]. Radiother Oncol, 2015, 115(3): 399-406. |
| [29] |
Vlantis AC, Lee DL, Wong EW, et al. Endoscopic nasopharyngectomy in recurrent nasopharyngeal carcinoma: a case series, literature review, and pooled analysis[J]. Int Forum Allergy Rhinol, 2017, 7(4): 425-432. |
| [30] |
Liu J, Yu H, Sun X, et al. Salvage endoscopic nasopharyngectomy for local recurrent or residual nasopharyngeal carcinoma: a 10-year experience[J]. Int J Clin Oncol, 2017, 22(5): 834-842. |
| [31] |
Tang IP, Ngui LX, Ramachandran K, et al. A 4-year review of surgical and oncological outcomes of endoscopic endonasal transpterygoid nasopharyngectomy in salvaging locally recurrent nasopharyngeal carcinoma[J]. Eur Arch Otorhinolaryngol, 2019, 276(9): 2475-2482. |
| [32] |
Chan JYW, Wong STS, Wei WI. Surgical salvage of recurrent T3 nasopharyngeal carcinoma: Prognostic significance of clivus, maxillary, temporal and sphenoid bone invasion[J]. Oral Oncol, 2019, 91: 85-91. |
| [33] |
Wong EHC, Liew YT, Loong SP, et al. Five-year Survival Data on the Role of Endoscopic Endonasal Nasopharyngectomy in Advanced Recurrent rT3 and rT4 Nasopharyngeal Carcinoma[J]. Ann Otol Rhinol Laryngol, 2020, 129(3): 287-293. |
| [34] |
刘全, 孙希才, 于华鹏, 等. 鼻内镜下鼻咽癌切除术的手术分型[J]. 山东大学耳鼻喉眼学报, 2019, 33(2): 39-45. [Liu Q, Sun XC, Yu HP, et al. Types of endoscopic transnasal nasopharyngectomy for nasopharyngeal carcinoma[J]. Shangdong Da Xue Er Bi Hou Yan Xue Bao, 2019, 33(2): 39-45.] |
| [35] |
Chan OS, Sze HC, Lee MC, et al. Reirradiation with intensity-modulated radiotherapy for locally recurrent T3 to T4 nasopharyngeal carcinoma[J]. Head Neck, 2017, 39(3): 533-540. |
| [36] |
Ng WT, Ngan RKC, Kwong DLW, et al. Prospective, Multicenter, Phase 2 Trial of Induction Chemotherapy Followed by Bio-Chemoradiotherapy for Locally Advanced Recurrent Nasopharyngeal Carcinoma[J]. Int J Radiat Oncol Biol Phys, 2018, 100(3): 630-638. |
| [37] |
Zou X, Han F, Ma WJ, et al. Salvage endoscopic nasopharyngectomy and intensity-modulated radiotherapy versus conventional radiotherapy in treating locally recurrent nasopharyngeal carcinoma[J]. Head Neck, 2015, 37(8): 1108-1115. |
| [38] |
Tian YM, Huang WZ, Yuan X, et al. The challenge in treating locally recurrent T3-4 nasopharyngeal carcinoma: the survival benefit and severe late toxicities of re-irradiation with intensity-modulated radiotherapy[J]. Oncotarget, 2017, 8(26): 43450-43457. |
| [39] |
Wei WI, Kwong DL. Current management strategy of nasopharyngeal carcinoma[J]. Clin Exp Otorhinolaryngol, 2010, 3(1): 1-12. |
| [40] |
Han F, Zhao C, Huang SM, et al. Long-term outcomes and prognostic factors of re-irradiation for locally recurrent nasopharyngeal carcinoma using intensity-modulated radiotherapy[J]. Clin Oncol (R Coll Radiol), 2012, 24(8): 569-576. |
| [41] |
Na'ara S, Amit M, Billan S, et al. Outcome of Patients Undergoing Salvage Surgery for Recurrent Nasopharyngeal Carcinoma: A Meta-analysis[J]. Ann Surg Oncol, 2014, 21(9): 3056-3062. |
| [42] |
You R, Zou X, Wang SL, et al. New surgical staging system for patients with recurrent nasopharyngeal carcinoma based on the AJCC/UICC rTNM classification system[J]. Eur J Cancer, 2015, 51(13): 1771-1779. |
| [43] |
Hu J, Bao C, Gao J, et al. Salvage treatment using carbon ion radiation in patients with locoregionally recurrent nasopharyngeal carcinoma: Initial results[J]. Cancer, 2018, 124(11): 2427-2437. |
| [44] |
Fang W, Yang Y, Ma Y, et al. Camrelizumab (SHR-1210) alone or in combination with gemcitabine plus cisplatin for nasopharyngeal carcinoma: results from two single-arm, phase 1 trials[J]. Lancet Oncol, 2018, 19(10): 1338-1350. |
 2020, Vol. 47
2020, Vol. 47


