文章信息
- 肿瘤标志物在脐尿管癌诊断中的价值
- Application of Tumor Markers in Patients with Urachal Carcinoma
- 肿瘤防治研究, 2020, 47(9): 676-679
- Cancer Research on Prevention and Treatment, 2020, 47(9): 676-679
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0161
- 收稿日期: 2020-03-03
- 修回日期: 2020-07-02
2. 430030 武汉,华中科技大学同济医学院附属同济医院检验科
2. Department of Clinical Laboratory, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
Competing interests: The authors declare that they have no competing interests.
脐尿管是胚胎时期从膀胱顶向脐延伸的管状结构,出生前以及婴儿期管状结构消失退化成为脐正中韧带,位于脐正中皱襞内[1]。脐尿管癌是起源于脐尿管的一种罕见的泌尿生殖系统肿瘤,年发病率约为1/5 000 000[2],占膀胱癌的0.35%~0.7%[3-4]。该病虽然发病率低,但起病隐匿,早期无临床表现,当发现时常常处于Ⅲ期以上,预后差,外科手术难以有效控制肿瘤,且缺乏有效的全身性治疗手段,严重威胁患者生命安全,故术前或早期诊断尤为重要。国内有关脐尿管癌的文献不少,但大多为个案报道和经验总结,提到血清肿瘤标志物有阳性表达的很少[5]。目前国内尚无文献具体报道血清肿瘤标志物CEA、CA199、CA724在脐尿管癌患者中的应用价值,国外相关报道也很少。血清肿瘤标志物检测对患者来说具有无创、费用低、简单便捷的优势,能够做到早期监测。故本文重点研究血清肿瘤标志物在脐尿管癌患者治疗中的应用价值。
1 资料与方法 1.1 一般资料收集华中科技大学同济医学院附属同济医院2005年10月—2019年5月收治的12例进行了相关肿瘤标志物检测的脐尿管癌患者资料,其中男11例、女1例,年龄25~69(46.25±14.21)岁,分为远处转移组4例和非转移组8例。纳入标准:(1)所有患者均经病理、影像学等资料确诊为脐尿管癌; (2)患者均为首次确诊,入组前未接受任何抗肿瘤治疗; (3)所有检测结果均由我院检验科检测,所有指标均为未接受任何治疗前的检测结果。排除标准:患者合并有能够引起所研究指标改变的任何其他系统疾病。在病案科及检验科分别随机搜索出同期的40例膀胱尿路上皮癌患者和40例健康人群的血清肿瘤标志物数据作为对照组。膀胱尿路上皮癌组男34例、女6例,年龄32~81(60.53±11.74)岁; 健康对照组男29例、女11例,年龄30~51(40.80±5.94)岁,经体检生理各项指标正常,无引起所研究指标升高的任何其他疾病。三组受试者在性别、年龄等基线资料比较差异无统计学意义(P > 0.05),排除了其他因素的干扰,具有可比性。
1.2 检测方法和指标判定采用双抗夹心免疫化学发光法测定CEA、CA199和CA724,试剂由罗氏公司提供,按说明书进行操作。我院血清肿瘤标志物CEA、CA199、CA724的表达水平正常浮动范围分别为0~5 ng/ml、0~34 u/ml、0~3.3 u/ml。检测值大于该范围的上限者则定为阳性。
1.3 指标分析(1) 脐尿管癌组、尿路上皮癌组、健康对照组血清肿瘤标志物CEA、CA199、CA724的表达水平比较; (2)比较转移组和非转移组,三种指标的检出率; (3)三个指标单独检测和联合检测的诊断效能。
1.4 统计学方法采用统计学软件SPSS 23.0和MedCalc 19进行统计分析,用单样本K-S检验进行数据的正态性检验; 符合正态分布计量资料以均数±标准差(x±s)表示,采用t检验; 计数资料采用卡方检验; 肿瘤标志物符合非正态分布,采用中位数(四分位数)[M(P25, P75)]表示,用非参数检验法进行统计分析,检验水准α=0.05(双侧),P < 0.05表示差异有统计学意义。通过建立Logistic回归模型,绘制ROC曲线并计算曲线下面积(AUC)评价各血清肿瘤标志物单独与联合检测对脐尿管癌的诊断效能。
2 结果 2.1 脐尿管癌组、膀胱尿路上皮癌组、健康对照组肿瘤标志物表达水平比较脐尿管癌组患者CEA表达水平明显高于尿路上皮癌组和健康对照组,差异有统计学意义(P=0.01),而尿路上皮癌组和健康对照组CEA表达差异无统计学意义,CA199、CA724在三组中的表达差异均无统计学意义,见表 1。
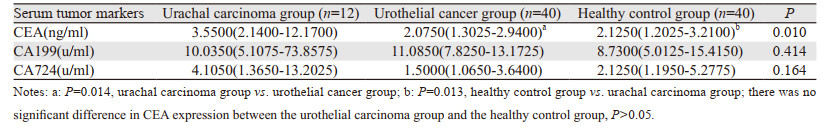
|
CA724在远处转移组中的阳性检出率高于非转移组,组间差异有统计学意义(P=0.018),而CEA、CA199在转移组和非转移组中的检出率差异无统计学意义(均P > 0.05),见表 2。
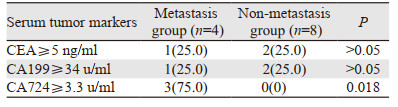
|
3种肿瘤标志物单独检测时,CEA诊断脐尿管癌的AUC最大,与另两种肿瘤标志物的差异无统计学意义,且CA199诊断脐尿管癌的AUC < 0.5。CEA、CA724联合检测与三种肿瘤标志物联合检测的AUC均大于单项检测的AUC,但两者间差异无统计学意义(0.817 vs. 0.805, P=0.8509),见表 3、图 1。
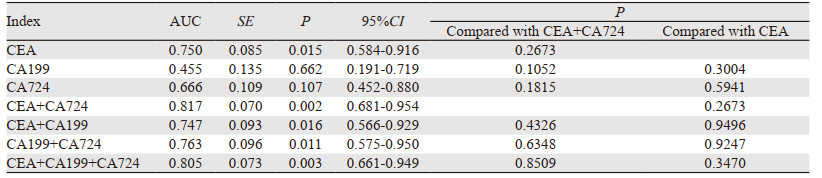
|
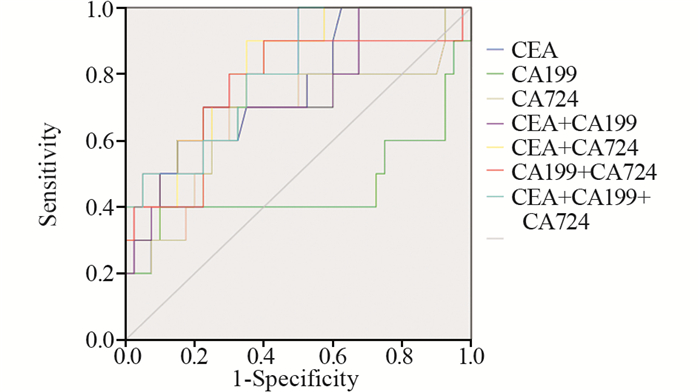
|
| 图 1 3种肿瘤标志物单独检测及不同联合检测的ROC曲线 Figure 1 ROC curves of three tumor markers in single and combination detection |
脐尿管癌的发病机制目前尚不清楚,发现时通常处于较晚期,因为早期脐尿管癌局限于脐尿管中,无明显临床症状,当肿瘤突破膀胱黏膜时才有临床症状,血尿作为脐尿管癌的最常见症状[6],同时也是膀胱肿瘤的最常见症状,而膀胱肿瘤90%左右是尿路上皮癌,故本文将尿路上皮癌作为重点对照组。
有研究证实CEA、CA199和CA724为结直肠腺癌、肺腺癌、胃腺癌、胰腺癌等腺癌的重要监测标志物,与疾病的发展、治疗、预后密切相关[7-10]。脐尿管癌的主要组织学类型为腺癌,占90%以上[11],在组织形态学上与结直肠腺癌等腺癌具有明显相似性,故研究CEA、CA199和CA724在脐尿管癌中的应用价值有据可依。本研究表明,单项指标作为诊断试验时CEA的AUC最大,且表达水平明显高于膀胱尿路上皮癌组和健康对照组。CA199的AUC < 0.5,说明CA199对脐尿管癌的诊断价值意义不大。CA724的AUC=0.666,在脐尿管癌转移组中阳性检出率明显高于非转移组,且差异有统计学意义(P=0.018),说明CA724对脐尿管癌的远处转移及预后有一定的预测意义。CEA、CA724联合检测的AUC最大,均大于单独检测和其他联合检测,但差异均无统计学意义,可能与本次研究的样本量不够有关。
本研究发现分期越晚的脐尿管患者肿瘤标志物表达量越高,术后或者化疗后肿瘤标志物可明显降低,与肿瘤分期和治疗反应性相关,有希望应用于脐尿管癌的监测和预后评估。但由于脐尿管癌样本量少,数据不完整,无法做出统计学差异性分析。Siefker-Radtke等[12]研究也发现59%的脐尿管癌患者(中位数:36 ng/ml)CEA血清水平升高(> 3 ng/ml),CEA也因化疗而降低,提示CEA检测在脐尿管癌监测(或随访)中具有潜在的应用价值,与本研究结果一致。Reis等[13]和Zong等[14]研究发现CA724在肿瘤发生转移或者复发时明显升高,与本研究得出的CA724在脐尿管癌转移组中阳性检出率明显高于非转移组的结论一致。Reis等[13]研究表明,有55.7%的患者在诊断时血清CEA水平升高,此外,血清CA199和CA125升高分别为50.8%和51.4%,诊断时CEA水平的升高与更差的中位总生存期(overall survival, OS)(P=0.008)和中位无进展生存期(progression free survival, PFS)(P=0.009)有关,CA199水平升高也意味者更差的OS和PFS(P=0.09),CA125与预后无关。由此可知血清肿瘤标志物对疾病诊断、分期、进展、治疗反应及预后的都具有一定的参考价值,为脐尿管癌的诊治及预后评估提供另一种辅助思路和方法。
本研究也有不足之处,由于脐尿管癌的发病率很低,研究的样本量不足,其次是单中心的回顾性研究,故需要进一步的多中心大数据进行结论的验证。
综上所述,脐尿管癌患者CEA表达水平明显增高。CEA、CA199、CA724的表达水平与疾病的治疗和进展可能有一定的相关性。CA724可能作为脐尿管癌远处转移及预后的预测指标之一,与CEA联合检测可为脐尿管癌的临床诊断提供有效的参考。
作者贡献
柯春锦:数据收集、论文撰写及修改
胡志全、杨春光:研究设计及论文写作指导
岳道远、沈源清、甘家骅:数据收集
田继华、李宋、李乐:数据分析
| [1] |
Wilcox DT, Godbole PP, Koyle MA. Pediatric urology: Surgical complications and management[M]. BK: Blackwell Publishing Ltd, 2008: 92-97.
|
| [2] |
Scabini S, Rimini E, Romairone E, et al. Urachal tumour: case report of a poorly understood carcinoma[J]. World J Surg Oncol, 2009, 7: 82. DOI:10.1186/1477-7819-7-82 |
| [3] |
Gopalan A, Sharp DS, Fine SW, et al. Urachal carcinoma: a clinicopathologic analysis of 24 cases with outcome correlation[J]. Am J Surg Pathol, 2009, 33(5): 659-668. DOI:10.1097/PAS.0b013e31819aa4ae |
| [4] |
Johnson DE, Hodge GB, Abdul-Karim FW, et al. Urachal carcinoma[J]. Urology, 1985, 26(3): 218-221. DOI:10.1016/0090-4295(85)90112-8 |
| [5] |
牛海涛, 董平, 王佳妮, 等. 手术后脐尿管癌的治疗及预后分析[J]. 中华医学杂志, 2016, 96(24): 1923-1925. [Niu HT, Dong P, Wang JN, et al. Analysis of treatment and prognosis in post-operative patients with urachal carcinoma[J]. Zhonghua Yi Xue Za Zhi, 2016, 96(24): 1923-1925.] |
| [6] |
Szarvas T, Módos O, Niedworok C, et al. ClinicaI, prognostic, and therapeutic aspects of urachal carcinoma-A comprehensive review with meta-analysis of 1010 cases[J]. Urol Oncol, 2016, 34(9): 388-398. DOI:10.1016/j.urolonc.2016.04.012 |
| [7] |
魏玮, 王艺, 杨旭光. CA19-9、CEA对不同CRP水平晚期胰腺癌患者预后判断的临床价值[J]. 中华胰腺病杂志, 2018, 18(6): 384-388. [Wei W, Wang Y, Yang XG. Clinical value of CA19-9 and CEA level in predicting the outcome of advanced pancreatic cancer patients with different C-reaction protein level[J]. Zhonghua Yi Xian Bing Za Zhi, 2018, 18(6): 384-388.] |
| [8] |
叶进军, 辛乐, 刘继东, 等. 血清微小RNA-183在结肠癌诊断中的价值[J]. 中华实验外科杂志, 2018, 35(10): 1937-1939. [Ye JJ, Xin L, Liu JD, et al. Analysis on the value of serum microRNA-183 in the diagnosis of colon cancer[J]. Zhonghua Shi Yan Wai Ke Za Zhi, 2018, 35(10): 1937-1939.] |
| [9] |
曹仲年, 郑容, 魏正茂, 等. 肿瘤标志物和肺门淋巴结与肺腺癌全身骨显像骨转移的关系[J]. 肿瘤防治研究, 2019, 46(2): 149-152. [Cao ZN, Zheng R, Wei ZM, et al. Relationship of Tumor Markers and Hilar Lymph Nodes with Bone Metastasis of Whole Body Bone Imaging in Lung Adenocarcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(2): 149-152.] |
| [10] |
蔡晓娟, 王堃, 喻晶. 异常凝血酶原联合CEA、CA72-4和CA199在胃癌诊治中的价值[J]. 肿瘤防治研究, 2018, 45(6): 395-399. [Cai XJ, Wang K, Yu J. Clinical Value of Abnormal Prothrombin Combined with CEA, CA72-4 and CA199 on Patients with Gastric Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(6): 395-399.] |
| [11] |
Dhillon J, Liang Y, Kamat AM, et al. Urachal carcinoma:a pathologic and clinical study of 46 cases[J]. Human Pathol, 2015, 46(12): 1808-1814. DOI:10.1016/j.humpath.2015.07.021 |
| [12] |
Siefker-Radtke AO, Gee J, Shen Y, et al. Multimodality management of urachal carcinoma: the M. D. Anderson Cancer Center experience[J]. J Urol, 2003, 169(4): 1295-1298. DOI:10.1097/01.ju.0000054646.49381.01 |
| [13] |
Reis H, Krafft U, Niedworok C, et al. Biomarkers in Urachal Cancer and Adenocarcinomas in the Bladder: A Comprehensive Review Supplemented by Own Data[J]. Dis Markers, 2018, 2018: 7308168. |
| [14] |
Zong L, Chen P. Surgical and chemotherapeutic experience regarding a urachal carcinoma with repeated relapse: case report and literature review[J]. World J Surg Oncol, 2013, 11: 170. DOI:10.1186/1477-7819-11-170 |
 2020, Vol. 47
2020, Vol. 47


