文章信息
- 知母皂苷通过调控Hedgehog信号通路介导的SOX2抑制肺癌增殖及干细胞形成
- Timosaponin Inhibit Proliferation and Stem Cell Formation of Lung Cancer Through Regulating Hedgehog Signaling-mediated SOX2
- 肿瘤防治研究, 2020, 47(8): 590-595
- Cancer Research on Prevention and Treatment, 2020, 47(8): 590-595
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0109
- 收稿日期: 2020-02-17
- 修回日期: 2020-05-19
2. 710012 西安,西安交通大学医学院基础医学院
2. School of Basic Medicine, School of Medicine, Xi'an Jiaotong University, Xi'an 710012, China
肺癌是癌症死亡的主要原因,占所有癌症相关死亡的20%[1]。化学疗法可在一定程度上提高生存率,但由于侵袭性肿瘤的复发,总体生存率较低[2]。癌症干细胞(cancer stem cell, CSC)占总癌细胞群的一小部分,具有很强的致癌特性[3]。CSC的特征是自我更新、分化、致瘤性和对化疗的耐药性[4-5]。肺癌中的CSC标记包括代谢标记醛脱氢酶同工型1(ALDH1)和表面标记CD133、CD44和CD166 [6]。
知母皂苷(Timosaponin, TMS)作为传统中药知母的主要成分之一,具有广泛的生物活性,包括抗氧化、抗老年痴呆、保护脑缺血损伤及降糖等作用。近年来,其抗肿瘤活性逐渐被引起重视,对胃癌、肝癌、乳腺癌、胰腺癌及肺癌等细胞增殖均具有一定的抑制作用,可通过作用于丝裂原活化蛋白激酶、血管内皮生长因子及IL-18等发挥抗肿瘤活性[7-8],其多靶点抗肿瘤机制,为其开发成为新型抗肿瘤药物提供可能。本研究基于其抗肺癌作用,探讨其对CSC的影响及具体作用机制,进一步明确其多靶点抗肿瘤机制。
1 材料与方法 1.1 TMS制备、细胞培养及成球实验TMS的制备采用70%乙醇为提取溶剂,回流提取2 h,以等体积饱和正丁醇萃取至皂苷显色为阴性,合并有机层,挥干溶剂后,以标准曲线法测得知母皂苷的含量,以总皂苷摩尔浓度给药。
人肺癌A549细胞培养于含有10%胎牛血清和1%青霉素/链霉素的RPMI培养基中。为了形成肺肿瘤球,将5×104个A549细胞装在有Cancer Stem Premium培养基(ProMab Biotechnologies Inc., Richmond, CA, USA)的超低黏附平板中,并于37℃、5%CO2培养箱中培养7天。使用NICE程序估算肿瘤球的数量。通过确定肿瘤球形成效率(TFE)(%)来估计肿瘤球的形成。
1.2 抗体和siRNA抗GLI1、抗GLI2、抗Smoothened(SMO)和抗SOX2抗体购自美国Cell Signaling Technology公司。抗肌动蛋白抗体获自美国Santa Cruz Biotechnology公司。抗CD44 FITC和抗CD24 PE抗体获自美国BD Pharmingen公司。人SMO和SOX2特异的siRNA获自韩国Bioneer公司。
1.3 MTS法检测细胞增殖将肺癌A549细胞以2×104个/毫升的密度接种于96孔板,37℃孵育过夜至细胞完全贴壁后,加入不同浓度的TMS,共培养48 h后,使用CellTiter 96 ® Aqueous One Solution细胞试剂盒评估肿瘤细胞增殖[9],并使用酶标仪于OD490下测量。
1.4 平板克隆形成和迁移实验对于平板克隆形成实验,将A549细胞以每孔1 000个接种于6孔板中,与TMS共孵育7天并计数。为了进行迁移测定,将细胞以2×105个/毫升的密度接种于24孔板中培养过夜,至细胞贴壁后,使用移液管吸头进行刮擦,RPMI/10%FBS洗涤后,以TMS处理肺癌细胞,于显微镜下拍照[10]。
1.5 流式细胞术检测细胞凋亡将肺癌细胞与TMS(20 mol/L)在6孔板中培养。根据说明书,通过Annexin V/PI染色检测凋亡细胞,样品通过Accuri C6进行细胞凋亡分析。
1.6 Hoechst染色和ALDEFLUOR分析将A549细胞用30 mol/L的TMS处理1天,然后将其与Hoechst 33342溶液(10 mg/ml)在37℃下孵育30 min,用荧光显微镜观察对凋亡小体的影响。ALDEFUORTM测定试剂盒测定醛脱氢酶活性,根据说明书操作,将细胞在乙醛脱氢酶(acetaldehyde dehydrogenase, ALDH)测定缓冲液中于37℃培养30 min,使用Accuri C6对ALDH阳性细胞进行计数。
1.7 RT-qPCR检测基因表达提取和纯化来自癌细胞的总RNA,按试剂盒操作测定RT-qPCR,其引物序列,见表 1。
从肺癌细胞和肿瘤球中提取总蛋白,使用12%SDS-PAGE进行电泳分析后,将其转移至PVDF膜,在Odyssey封闭缓冲液中孵育1 h,然后分别与一抗孵育后,Odyssey缓冲液洗涤3次后与二抗孵育。使用Odyssey CLx系统进行图像分析。
1.9 检测Caspase-3/7活性将A549细胞与TMS(40和80 mol/L)共孵育,Caspase-Glo 3/7试剂盒测定Caspase-3/7活性。按试剂盒说明操作,将100 μl的Caspase-Glo 3/7试剂添加到96孔板中并孵育,并用GloMax® Explorer光度计测量活性。
1.10 siRNA转染为了验证SOX2和SMO对肿瘤球形成的影响,用人SOX2和SMO siRNA转染A549细胞。根据说明书要求进行转染,使用Lipofectamine 3000温育和转染癌细胞。通过Western blot确定SOX2和SMO的蛋白质水平。
1.11 异种移植瘤实验实验流程参照文献报道[11],雄性裸鼠(4周龄)购自上海斯莱克公司,并在小鼠设施中放置1周后进行实验。十二只雄性裸鼠于右背部皮下注射5×106个/毫升的A549细胞,取TMS溶于DMSO中并以0.9%氯化钠溶液稀释,每天10 mg/kg腹腔注射给药,对照组给予相同量的0.9%氯化钠溶液,给药55天后计算肿瘤体积,计算公式为:肿瘤体积=(宽2×长度)/ 2。
1.12 统计学方法所有数据均使用GraphPad Prism 5.0进行统计分析。所有数据均以平均值±标准差表示,单因素方差对数据进行分析,P < 0.05为差异有统计学意义。
2 结果 2.1 TMS抑制A549肺癌细胞增殖并诱导其凋亡通过评估TMS对A549人肺癌细胞生长的影响,发现TMS具有显著抗肿瘤细胞增殖活性(P < 0.05),见图 1A。TMS可诱导凋亡小体的形成,见图 1B,进而诱导A549的细胞凋亡,见图 1C。TMS可增加A549细胞中caspase 3/7的活性(P < 0.05),见图 1D,抑制肺癌细胞的迁移和克隆形成(P < 0.05),见图 1E~1F。研究表明,TMS可有效抑制肺癌细胞的生长、凋亡、细胞迁移和克隆形成。

|
| TMS: Timosaponin; *: P<0.05, compared with Control group or 0 μmol/L of TMS group; A: MTS detecs the antitumor proliferation effect of TMS; B: the effect of TMS on apoptotic bodies; C: the effect of TMS on cell apoptosis; D: the effect of TMS on caspase 3/7 activity; E: the effect of TMS on cell migration; F: the effect of TMS on cell clone formation. 图 1 TMS抑制A549肺癌细胞增殖并诱导其凋亡 Figure 1 TMS could inhibit the proliferation and induces apoptosis of A549 lung cancer cells |
测定TMS对异种移植瘤裸鼠模型中肿瘤生长的影响,对照组和TMS治疗组的裸鼠体重相似,见图 2A。经TMS治疗的裸鼠的肿瘤重量及肿瘤体积显著低于对照组(P < 0.0001),见图 2B~2C,表明TMS可显著抑制裸鼠模型中的肺癌细胞生长。
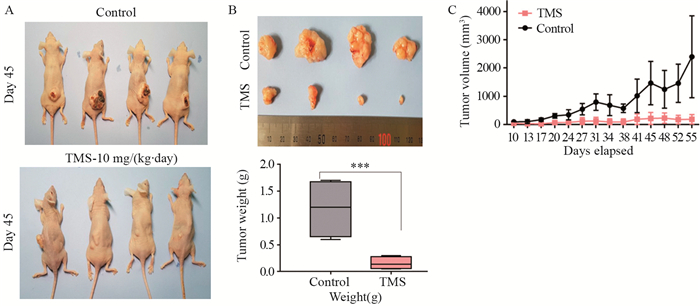
|
| **: P<0.001, Control group vs. TMS group; A, B: the effect of TMS on tumor weight; C: the effect of TMS on tumor volume. 图 2 TMS可显著抑制裸鼠模型中肿瘤生长 Figure 2 TMS can significantly inhibit tumor growth in nude mouse models |
为检测TMS是否抑制肺癌细胞中肿瘤球的形成,用不同浓度TMS作用于A549细胞肿瘤球,TMS可显著抑制肺肿瘤球的形成(P < 0.05),见图 3A。通过检测TMS对肺癌CSC标志物ALDH1水平的影响,发现TMS可将ALDH1阳性细胞分数从5.0%降低至2.5%,见图 3B,结果表明TMS能抑制肿瘤球的形成。

|
| TFE: tumorsphere formation efficiency; *: P<0.05, compared with Control group. A: the effect of TMS on the formation of lung tumor ball; B: the effect of TMS on the level of lung cancer cancer CSC marker ALDH1. 图 3 TMS可显著减少肺癌细胞肿瘤球的形成并降低ALDH阳性分数 Figure 3 TMS could reduce the formation of tumor sphere and the ALDH-positive fraction in lung cancer cells |
在TMS作用下,GLI1和GLI2的转录水平显著降低,而GLI3并未降低,TMS可降低GLI1、GLI2和SMO蛋白表达水平,见图 4A。为了进一步验证SMO在肿瘤球形成中的功能,考察SMO siRNA沉默后,细胞的肿瘤球形成能力,SMO特异性siRNA转染的肺癌细胞的肿瘤球形成减少了40%(P < 0.05),见图 4B,表明SMO和Hedgehog信号对于肺癌的肿瘤球形成至关重要。
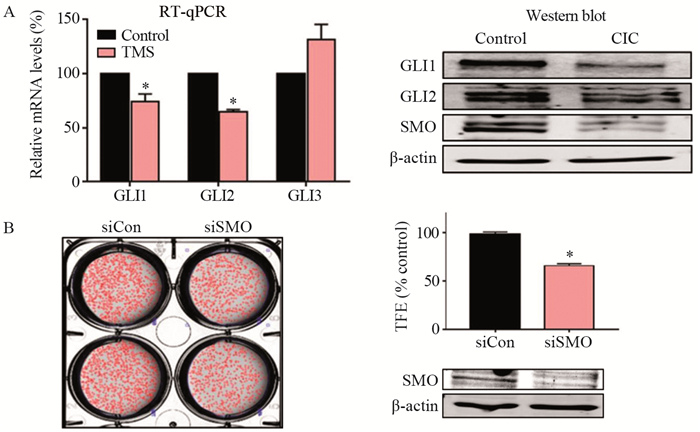
|
| *: P<0.05, compared with siCon group or Control group. siCon: Control-siRNA; siSMO: SMD-siRNA. A: the effect of TMS on GLI1, GLI2, GLI3 and SMO; B: the effect of silencing SMO on the tumor sphere formation ability of cells. 图 4 TMS通过调控Hedgehog信号通路抑制肿瘤球形成 Figure 4 TMS inhibits tumor sphere formation by regulating Hedgehog signaling pathway |
由于GLI1介导的SOX2调控可调节肺和黑色素瘤CSC的自我更新,因此推测TMS可能对SOX2的表达具有调控作用。通过实验发现,TMS可显著降低SOX2的转录和蛋白表达水平(P < 0.05),见图 5A。为了明确Hedgehog信号对SOX2基因的调控,使用SMO基因的siRNA敲低SMO基因并检测SOX2转录,SMO可显著调节SOX2基因表达(P < 0.05),见图 5A。为了研究SOX2在肿瘤球形成中的功能,通过对SOX2进行siRNA沉默,发现用SOX2特异性siRNASOX转染的肺癌细胞的肿瘤球形成减少了70%(P < 0.05),见图 5B。结果表明,TMS可降低SOX2和Hedgehog信号转导,严重影响肺癌肿瘤球的形成。
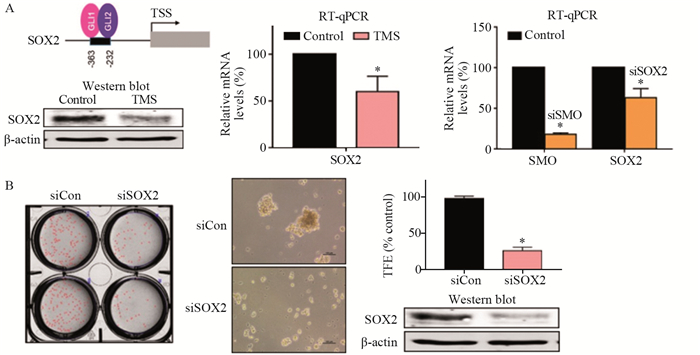
|
| *: P<0.05, compared with Control grou p or siCon grou p; TSS: transcription of SMO and SOX2; siSOX: SOX2-siRNA; A: the effect of TMS on the transcription and protein expression of SOX2; B: the effect of SOX2 on the formation of tumor balls. 图 5 TMS通过GLI介导调控SOX2抑制肿瘤球形成 Figure 5 TMS inhibits tumor sphere formation through GLI-mediated regulation of SOX2 |
通过检测CSC特异性基因的转录水平,明确TMS是否通过抑制CSC特异性基因发挥作用。TMS可显著降低CSC中特定基因SOX2、Nanog、c-Myc和Snail的转录水平(P < 0.05),见图 6A。向肿瘤球培养基中加入TMS并培养来自肿瘤球的癌细胞,发现TMS可诱导肿瘤球的细胞死亡,见图 6B。

|
| *: P<0.05. 图 6 TMS降低肿瘤球中Snail、SOX2、Nanog和c-Myc的mRNA表达水平并诱导肿瘤球细胞死亡 Figure 6 TMS could reduce the mRNA expression levels of Snail, SOX2, Nanog, and c-Myc in tumor spheres and induce the cell death of cancer cells from tumorspheres |
肺癌严重威胁人类健康,其死亡率占癌症相关死亡的20%[12],显著高于其他癌症。CSC及其他引发癌症的细胞被认为是癌细胞的一个亚群,可赋予癌细胞侵略性和耐药性,其中CSC具有自我更新、引发肿瘤和经历多种分化的能力。因此,CSC的特性已经成为肺癌治疗的靶标。
Hedgehog信号在胚胎发生和发育过程中被激活,并在许多实体瘤中被重新激活[13-15]。Hedgehog信号涉及的蛋白质根据物种分为Sonic Hedgehog(Shh),Indian Hedgehog(Ihh)和Desert Hedgehog(Dhh)。Hedgehog信号通路由三种蛋白组成,即GPCR样蛋白Smoothed(SMO),经典受体Patched(PTCH1)和GLI1/2/3蛋白。Hedgehog信号对于自我更新、细胞命运决定和CSC形成至关重要。此外,Hedgehog信号通路还涉及肺癌的化学耐药性、复发和转移[16]。SOX2蛋白参与多种癌症,包括黑色素瘤及乳腺癌等[17-18],并在结肠直肠癌中维持CSCs[19]。有研究[20]表明,Hedgehog-GLI信号转导与癌症的生长、致瘤性和干性有关,通过Hedgehog-GLI信号转导,GLI调节SOX2基因,而GLI介导的SOX2调节诱导黑色素瘤和肺癌CSC的自我更新。
本研究通过使用siRNA靶向敲低SMO,发现TMS可减少GLI1和GLI2的转录,并在肺癌CSC形成中发挥重要作用,表明TMS可能通过调节Hedgehog信号来抑制肺癌CSC。在裸鼠模型和细胞实验中,TMS的抗增殖浓度分别为10和5 mg/kg,所使用的TMS浓度非常高且可能诱导细胞毒性,很难将TMS用作抗癌药。为了克服这个问题,TMS的临床应用具有两种选择:一种是开发具有强抗癌活性的TMS类似物,另一种是在接受化疗的癌症患者中共同使用TMS药物。
CSC可导致肿瘤耐药、复发和转移,这是癌症死亡的主要原因[21]。Hedgehog信号异常在多种癌症中诱导肿瘤发生和进展,包括CSC维持。SOX2调节人类黑色素瘤起始细胞的自我更新。本研究表明TMS降低了Hedgehog信号转导和SOX2表达,通过Hedgehog介导的Hedgehog信号/SOX2途径调节肺癌CSC的形成。研究结果揭示了一种新的机制,涉及由TMS在肺癌CSC中诱导的Hedgehog信号和SOX2蛋白表达,也为靶向Hedgehog信号阻止CSC的形成提供了可能,提示TMS在抗肿瘤治疗和炎性反应中的应用潜力。
综上所述,本研究发现TMS可抑制肺癌细胞的增殖和CSCs的生长,其通过降低GLI1、GLI2和SMO的蛋白表达水平,降低SOX2的转录和蛋白表达水平,调控Hedgehog信号转导以及SOX2途径调节了肺癌CSC的形成,为靶向Hedgehog信号通路和SOX2抑制肺癌CSC的形成治疗肺癌提供可能。
作者贡献
曹松:实验设计、实施及文章撰写
严晓燕、马军:实验实施
景文江、张淑莲:图表分析及文章修改
王娟毅、李翔:实验设计及指导
吴翔:实验评估及指导
| [1] |
Maiuthed A, Chantarawong W, Chanvorachote P. Lung cancer stem cells and cancer stem cell-targeting natural compounds[J]. Anticancer Res, 2018, 38(7): 3797-3809. DOI:10.21873/anticanres.12663 |
| [2] |
Schaal CM, Bora-Singhal N, Kumar DM, et al. Regulation of Sox2 and stemness by nicotine and electronic-cigarettes in non-small cell lung cancer[J]. Mol Cancer, 2018, 17(1): 149. DOI:10.1186/s12943-018-0901-2 |
| [3] |
Batlle E, Clevers H. Cancer stem cells revisited[J]. Nat Med, 2017, 23(10): 1124-1134. DOI:10.1038/nm.4409 |
| [4] |
Nassar D, Blanpain C. Cancer stem cells: basic concepts and therapeutic implications[J]. Annu Rev Pathol, 2016, 11: 47-76. DOI:10.1146/annurev-pathol-012615-044438 |
| [5] |
Adorno-Cruz V, Kibria G, Liu X, et al. Cancer Stem Cells: Targeting the Roots of Cancer, Seeds of Metastasis, and Sources of Therapy Resistance[J]. Cancer Res, 2015, 75(6): 924-929. DOI:10.1158/0008-5472.CAN-14-3225 |
| [6] |
Prabavathy D, Swarnalatha Y, Ramadoss N. Lung cancer stem cells-origin, characteristics and therapy[J]. Stem Cell Investig, 2018, 5: 6. DOI:10.21037/sci.2018.02.01 |
| [7] |
Han FY, Song XY, Chen JJ, et al. Timosaponin AIII: A novel potential anti-tumor compound from Anemarrhena asphodeloides[J]. Steroids, 2018, 140: 125-130. DOI:10.1016/j.steroids.2018.09.014 |
| [8] |
刘艳平. 知母皂苷成分的药理活性及作用机制研究进展[J]. 药学实践杂志, 2018, 36(1): 24-29. [Liu YP. Progress on pharmacological activities and mechanism of Anemarrhena saponin[J]. Yao Xue Shi Jian Za Zhi, 2018, 36(1): 24-29.] |
| [9] |
Choi HS, Kim JH, Kim SL, et al. Catechol derived from aronia juice through lactic acid bacteria fermentation inhibits breast cancer stem cell formation via modulation Stat3/IL‐6 signaling pathway[J]. Mol Carcinog, 2018, 57(11): 1467-1479. DOI:10.1002/mc.22870 |
| [10] |
Choi HS, Kim SL, Kim JH, et al. Triterpene acid (3-Op-coumaroyltormentic acid) isolated from aronia extracts inhibits breast cancer stem cell formation through downregulation of c-Myc protein[J]. Int J Mol Sci, 2018, 19(9): 2528. DOI:10.3390/ijms19092528 |
| [11] |
Kim SL, Choi HS, Kim JH, et al. Dihydrotanshinone-induced NOX5 activation inhibits breast cancer stem cell through the ROS/Stat3 signaling pathway[J]. Oxid Med Cell Longev, 2019, 2019: 9296439. |
| [12] |
Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386. DOI:10.1002/ijc.29210 |
| [13] |
Xiao WF, Li YS, Deng A, et al. Functional role of hedgehog pathway in osteoarthritis[J]. Cell Biochem Funct, 2020, 38(2): 122-129. DOI:10.1002/cbf.3448 |
| [14] |
Huang D, Wang Y, Tang J, et al. Molecular mechanisms of suppressor of fused in regulating the hedgehog signalling pathway[J]. Oncol Lett, 2018, 15(5): 6077-6086. |
| [15] |
Giroux-Leprieur E, Costantini A, Ding VW, et al. Hedgehog signaling in lung cancer: From oncogenesis to cancer treatment resistance[J]. Int J Mol Sci, 2018, 19(9): 2835. DOI:10.3390/ijms19092835 |
| [16] |
Cochrane CR, Szczepny A, Watkins DN, et al. Hedgehog signaling in the maintenance of cancer stem cells[J]. Cancers (Basel), 2015, 7(3): 1554-1585. DOI:10.3390/cancers7030851 |
| [17] |
Santini R, Pietrobono S, Pandolfi S, et al. SOX2 regulates self-renewal and tumorigenicity of human melanoma-initiating cells[J]. Oncogene, 2014, 33(38): 4697-4708. DOI:10.1038/onc.2014.71 |
| [18] |
Leis O, Eguiara A, Lopez-Arribillaga E, et al. Sox2 expression in breast tumours and activation in breast cancer stem cells[J]. Oncogene, 2012, 31(11): 1354-1365. DOI:10.1038/onc.2011.338 |
| [19] |
Takeda K, Mizushima T, Yokoyama Y, et al. Sox2 is associated with cancer stem-like properties in colorectal cancer[J]. Sci Rep, 2018, 8(1): 17639. |
| [20] |
Alexaki VI, Javelaud D, Van Kempen LCL, et al. GLI2-mediated melanoma invasion and metastasis[J]. J Natl Cancer Inst, 2010, 102(15): 1148-1159. DOI:10.1093/jnci/djq257 |
| [21] |
Shibue T, Weinberg RA. EMT, CSCs, and drug resistance: the mechanistic link and clinical implications[J]. Nat Rev Clin Oncol, 2017, 14(10): 611-629. DOI:10.1038/nrclinonc.2017.44 |
 2020, Vol. 47
2020, Vol. 47

