文章信息
- 肿瘤患者静脉血栓栓塞症的风险评估模型及其应用
- Risk Assessment Models of Venous Thromboembolism for Cancer Patients and Their Applications
- 肿瘤防治研究, 2020, 47(11): 880-884
- Cancer Research on Prevention and Treatment, 2020, 47(11): 880-884
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0099
- 收稿日期: 2020-02-13
- 修回日期: 2020-05-16
静脉血栓栓塞症(venous thromboembolism, VTE)包括肺栓塞和深静脉血栓,是肿瘤患者常见的并发症[1-2]。首次发生VTE的病例中20%~30%与肿瘤相关[3]。VTE的发生提示肿瘤患者的预后较差,VTE是肿瘤患者第二大死亡原因[4]。因此,VTE的预防得到越来越多的关注。预防性抗凝治疗可以降低肿瘤患者VTE的发生风险,但并不是所有的肿瘤患者都需要进行预防性抗凝治疗。哪些肿瘤患者需要进行预防性抗凝治疗,需要应用有效的VTE风险评估模型对肿瘤患者进行风险分层,对其中的血栓高危人群,在排除抗凝禁忌后进行预防性抗凝。但肿瘤疾病存在复杂性,手术患者和非手术患者、不同的病理类型和分期、不同的抗肿瘤治疗方案、住院化疗患者和门诊化疗患者的VTE的发生风险和发生特点均可能不同,而目前专门针对肿瘤患者的VTE风险评估模型仍然有限,本文对目前国内外比较认可的几种VTE风险评估模型进行综述,并介绍各自适用的肿瘤患者人群、模型的局限性和发展前景。
1 VTE风险评估模型的发展在了解VTE风险评估模型之前,须明确两方面内容:(1)VTE发生的危险因素;(2)建立VTE风险评估模型的目的和意义。
1.1 VTE发生的危险因素既往研究[5]表明,许多因素与VTE的发生存在相关性,例如:年龄、长期制动、恶性肿瘤、外科大手术、多发性创伤、既往VTE病史和慢性心力衰竭等,见表 1。活动性肿瘤是发生VTE的重要危险因素,但是肿瘤患者的情况复杂,肿瘤存在自身疾病特点。例如,多发性骨髓瘤(multiple myeloma, MM)与VTE发生的关系尤为密切[6]。治疗MM的免疫调节剂,如沙利度胺和来那度胺等药物可明显增加VTE的发生率,特别是在与化疗和大剂量皮质类固醇联合使用时[7-8]。另外,所有住院化疗的肿瘤患者均为VTE的高危人群[9]。
在了解VTE危险因素的基础上,需要评估患者发生VTE的风险大小,因此引入了风险评估模型。这种模型的建立,可以帮助区分不同情况下患者发生VTE的风险,从而更加有针对性的采取预防措施,降低VTE的发生风险。基于肿瘤患者的不同特征,并没有一个统一的标准的风险评估模式适用于所有患者,而是要根据不同的情况,分别建立不同的VTE血栓风险评估模型。
2 临床常用的VTE风险评估模型及应用 2.1 Caprini血栓风险评估模型Caprini风险评估模型由Caprini评分量表和VTE风险分层组成,见表 2,该评估量表由美国Caprini等[10]基于临床经验和研究结果设计。第9版ACCP(American College of Chest Physicians)指南推荐使用Caprini风险评估模型对外科手术患者进行血栓风险评估[11]。Caprini评估量表已被广泛验证,纳入验证的患者群包含内科和外科住院患者[12-13],即Caprini评估量表适用于外科住院患者,也适用于内科住院患者。但对于内科患者Caprini评估量表相对较为复杂,并且其中有些危险因素并不适用于内科患者。
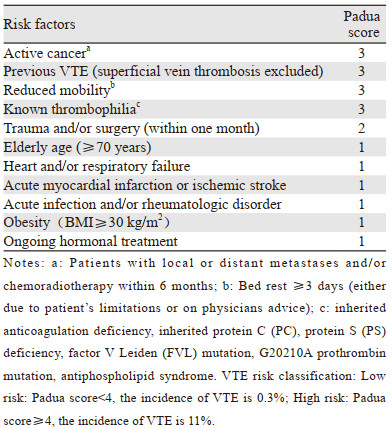
由意大利Padua(帕多瓦)大学多学科协同完成,主要针对以往的内科住院患者VTE风险评估模型进行回顾,并在其基础上发展而来[14],见表 3。该模型经临床验证显示有很好的VTE预测价值。一项前瞻性队列研究纳入1 180例内科患者,根据Padua评估量表将总体人群分为VTE高危组(评分≥4分)和低危组(评分 < 4分),随访90天统计患者症状性VTE发生率。结果显示高危组中11%的患者发生VTE,而低危组0.3%的患者发生VTE[15]。国内有研究对Padua风险评估模型进行验证,结果显示Padua风险评估模型简单易用,对内科住院患者VTE的早期筛查和预防具有重要意义[16]。虽然Padua评估模型更适合内科患者,但并不是专门针对肿瘤患者设计的血栓风险评估模型。
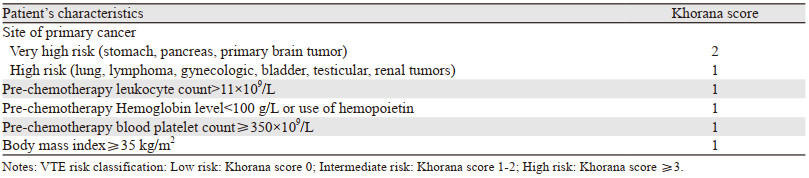
由美国医生Khorana博士等[17]共同设计,评估化疗相关的门诊患者VTE风险。2013年调整后被美国临床肿瘤学会采用,评估化疗相关VTE风险,见表 4。该模型主要针对门诊化疗的肿瘤患者设计。
为进一步提高肿瘤患者VTE风险预测的准确性,在Khorana评估模型基础上产生许多新的评估模型。例如,PROTECT评估模型[18]在Khorana评估模型基础上增加了化疗药物的因素。Vienna CATS评估模型[19]在Khorana评估模型基础上增加了P-选择素和D-二聚体的化验指标因素。ONKOTEV评估模型[20]在Khorana评估模型基础上增加了VTE病史、肿瘤远处转移和血管/淋巴管受压等因素。Tic-ONCO评估模型[21]在Khorana评估模型基础上增加了基因风险评分。这些VTE风险评估模型对于不同情况的肿瘤患者针对性更强,但是评估系统变得越来越复杂,并且尚有待大规模的临床数据进行验证。
2.5 其他的VTE风险评估模型CATS风险评估模型只包括两个因素:原发肿瘤部位和D-二聚体的水平[22]。COMPASS-CAT风险评估模型纳入的因素包括:蒽环类或激素治疗、癌症诊断后的时间、中心静脉导管、肿瘤分期、存在的心血管危险因素、最近急性疾病住院治疗、既往VTE病史和血小板计数[23]。
3 VTE风险评估模型的应用价值因为预防VTE的原则是推荐高危风险的患者进行预防性抗凝治疗,而低风险患者无须进行常规的预防性抗凝治疗。例如,行动不便需要住院化疗的肿瘤患者均属于VTE高危患者,因此应该进行VTE的一级预防。而门诊化疗的患者VTE发生风险不同,如何识别门诊化疗的高危人群,是目前研究的热点。Khorana风险评估模型中,评分≥3分的肿瘤患者是VTE的高危人群,应考虑进行VTE的一级预防,以此为基础进行了一些大规模的临床试验[24-25]。其中CASSINI研究[24]显示,对于血栓高风险的门诊癌症患者(Khorana评分≥2分),服用利伐沙班10 mg,每日1次,与安慰剂相比能显著减少VTE和VTE相关死亡的发生(2.6% vs. 6.4%, HR=0.40, 95%CI: 0.2~0.8, P=0.007)。基于CASSINI研究,2019年的ASCO(The American Society of Clinical Oncology)肿瘤血栓指南和ISTH(International Society on Thrombosis and Haemostasis)指南均推荐对起始化疗、Khorana评分≥2分、无药物间相互作用且无出血高风险(如胃肠道肿瘤)的门诊肿瘤患者,在起始化疗时可应用利伐沙班作为血栓一级预防[26]。另一项AVERT研究[25]也是将Khorana评分≥2分的中高危患者作为研究对象,探讨阿哌沙班对于VTE的预防作用,研究显示阿哌沙班与安慰剂相比明显降低门诊化疗患者的VTE发生风险(4.2% vs. 10.2%, P < 0.001)。但是,也有研究表明Khorana评估模型用于某些类型的肿瘤患者时敏感度较低,例如肺癌和胰腺癌[27-29]。因此,需要更为精准的VTE风险评估模型指导肿瘤患者VTE的一级预防。
4 VTE风险评估模型的前景随着“大数据”时代的到来,患者的健康档案和电子病历系统能够提供许多可供分析的数据,因此VTE风险评估模型可与人工智能/机器学习结合起来,产生新的甚至是互联网上的在线VTE风险计算器。在不久的将来,VTE风险预测和分层的自动预测模型可能为临床决策提供巨大支持[30-32]。
综上所述,VTE是肿瘤患者常见的并发症和死亡原因,预防性抗凝治疗可以减低肿瘤患者的血栓发生风险。VTE风险评估模型有助于从不同情况的肿瘤患者中筛选出高危患者,从而指导临床干预措施。合理选择VTE风险评估模型,建立更加准确和简便易行的风险评估模型,有利于对肿瘤患者进行个体化全程抗凝管理,尽可能降低肿瘤患者VTE的发生、改善肿瘤患者的预后。
作者贡献
韩森:论文撰写和修改
马旭:论文选题和文献资料收集整理
方健:论文整体规划和审阅
| [1] |
雷海科, 李小升, 龙波, 等. 恶性肿瘤合并静脉血栓栓塞症患者的临床特点分析[J]. 肿瘤防治研究, 2020, 47(4): 256-261. [Lei HK, Li XS, Long B, et al. Clinical features of cancer patients with venous thromboembolism[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(4): 256-261.] |
| [2] |
Heit JA, Spencer FA, White RH. The epidemiology of venous thromboembolism[J]. J Thromb Thrombolysis, 2016, 41(1): 3-14. DOI:10.1007/s11239-015-1311-6 |
| [3] |
Noble S, Pasi J. Epidemiology and pathophysiology of cancer-associated thrombosis[J]. Br J Cancer, 2010, 102 Suppl 1: S2-S9. |
| [4] |
Khorana AA. Venous thromboembolism and prognosis in cancer[J]. Thromb Res, 2010, 125(6): 490-493. DOI:10.1016/j.thromres.2009.12.023 |
| [5] |
Anderson FA, Spencer FA. Risk factors for venous thromboembolism[J]. Circulation, 2003, 107(23 Suppl): I9-16. |
| [6] |
Catovsky D, Ikoku NB, Pitney WR, et al. Thromboembolic complications in myelomatosis[J]. Br Med J, 1970, 3(5720): 438-439. DOI:10.1136/bmj.3.5720.438 |
| [7] |
Dimopoulos M, Spencer A, Attal M, et al. Lenalidomide plus dexamethasone for relapsed or refractory multiple myeloma[J]. N Engl J Med, 2007, 357(21): 2123-2132. DOI:10.1056/NEJMoa070594 |
| [8] |
Osman K, Comenzo R, Rajkumar SV. Deep venous thrombosis and thalidomide therapy for multiple myeloma[J]. N Engl J Med, 2001, 344(25): 1951-1952. DOI:10.1056/NEJM200106213442516 |
| [9] |
Khorana AA, Francis CW, Culakova E, et al. Thromboembolism in hospitalized neutropenic cancer patients[J]. J Clin Oncol, 2006, 24(3): 484-490. DOI:10.1200/JCO.2005.03.8877 |
| [10] |
Caprini JA, Arcelus JI, Reyna JJ. Effective risk stratification of surgical and nonsurgical patients for venous thromboembolic disease[J]. Semin Hematol, 2001, 38(2 suppl 5): 12-19. |
| [11] |
Gould MK, Garcia DA, Wren SM, et al. Prevention of VTE in nonorthopedic surgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines[J]. Chest, 2012, 141(2 Suppl): e227S-e277S. |
| [12] |
Zhou HX, Peng LQ, Yan Y, et al. Validation of the Caprini risk assessment model in Chinese hospitalized patients with venous thromboembolism[J]. Thromb Res, 2012, 130(5): 735-740. DOI:10.1016/j.thromres.2012.08.001 |
| [13] |
Bahl V, Hu HM, Henke PK, et al. A validation study of a retrospective venous thromboembolism risk scoring method[J]. Ann Surg, 2010, 251(2): 344-350. DOI:10.1097/SLA.0b013e3181b7fca6 |
| [14] |
Barbar S, Noventa F, Rossetto V, et al. A risk assessment model for the identifi cation of hospitalized medical patients at risk for venous thromboembolism: the Padua Prediction Score[J]. J Thromb Haemost, 2010, 8(11): 2450-2457. DOI:10.1111/j.1538-7836.2010.04044.x |
| [15] |
Kahn SR, Lim W, Dunn AS, et al. Prevention of VTE in nonsurgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines[J]. Chest, 2012, 141(2 Suppl): e195S-e226S. |
| [16] |
陶俊荣, 宋红霞. Padua风险评估模型在预防内科住院患者静脉血栓栓塞症中的应用[J]. 中国实用护理杂志, 2018, 34(32): 2496-2501. [Tao JR, Song HX. Validate padua prediction score's ability to predict the risk of venous thromboembolism in medical inpatients[J]. Zhongguo Shi Yong Hu Li Za Zhi, 2018, 34(32): 2496-2501.] |
| [17] |
Khorana AA, Kuderer NM, Culakova E, et al. Development and validation of a predictive model for chemotherapy-associated thrombosis[J]. Blood, 2008, 111(10): 4902-4907. DOI:10.1182/blood-2007-10-116327 |
| [18] |
Verso M, Agnelli G, Barni S, et al. A modified Khorana risk assessment score for venous thromboembolism in cancer patients receiving chemotherapy: the Protect score[J]. Intern Emerg Med, 2012, 7(3): 291-292. |
| [19] |
Ay C, Dunkler D, Marosi C, et al. Prediction of venous thromboembolism in cancer patients[J]. Blood, 2010, 116(24): 5377-5382. DOI:10.1182/blood-2010-02-270116 |
| [20] |
Cella CA, Di Minno G, Carlomagno C, et al. Preventing venous thromboembolism in ambulatory cancer patients: The ONKOTEV Study[J]. Oncologist, 2017, 22(5): 601-608. DOI:10.1634/theoncologist.2016-0246 |
| [21] |
Muñoz M, Ortega I, Font C, et al. Multivariable clinical-genetic risk model for predicting venous thromboembolic events in patients with cancer[J]. Br J Cancer, 2018, 118(8): 1056-1061. DOI:10.1038/s41416-018-0027-8 |
| [22] |
Pabinger I, van Es N, Heinze G, et al. A clinical prediction model for cancer-associated venous thromboembolism: A development and validation study in two independent prospective cohorts[J]. Lancet Haematol, 2018, 5(7): e289-e298. DOI:10.1016/S2352-3026(18)30063-2 |
| [23] |
Gerotziafas GT, Taher A, Abdel-Razeq H, et al. A predictive score for thrombosis associated with breast, colorectal, lung, or ovarian cancer: The Prospective COMPASS-Cancer-Associated Thrombosis Study[J]. Oncologist, 2017, 22(10): 1222-1231. DOI:10.1634/theoncologist.2016-0414 |
| [24] |
Khorana AA, Soff GA, Kakkar AK, et al. Rivaroxaban for thromboprophylaxis in high-risk ambulatory patients with cancer[J]. N Engl J Med, 2019, 380(8): 720-728. DOI:10.1056/NEJMoa1814630 |
| [25] |
Carrier M, Abou-Nassar K, Mallick R, et al. Apixaban to prevent venous thromboembolism in patients with cancer[J]. N Engl J Med, 2019, 380(8): 711-719. DOI:10.1056/NEJMoa1814468 |
| [26] |
Wang TF, Zwicker JI, Ay C, et al. The use of direct oral anticoagulants for primary thromboprophylaxis in ambulatory cancer patients: Guidance from the SSC of the ISTH[J]. J Thromb Haemost, 2019, 17(10): 1772-1778. DOI:10.1111/jth.14564 |
| [27] |
Noble S, Alikhan R, Robbins A, et al. Predictors of active cancer thromboembolic outcomes: Validation of the Khorana score among patients with lung cancer: Comment[J]. J Thromb Haemost, 2017, 15(3): 590-591. DOI:10.1111/jth.13594 |
| [28] |
Alexander M, Burbury K. A systematic review of biomarkers for the prediction of thromboembolism in lung cancer-Results, practical issues and proposed strategies for future risk prediction models[J]. Thromb Res, 2016, 148: 63-69. DOI:10.1016/j.thromres.2016.10.020 |
| [29] |
van Es N, Franke VF, Middeldorp S, et al. The Khorana score for the prediction of venous thromboembolism in patients with pancreatic cancer[J]. Thromb Res, 2017, 150: 30-32. DOI:10.1016/j.thromres.2016.12.013 |
| [30] |
Lustig DB, Rodriguez R, Wells PS. Implementation and validation of a risk stratification method at The Ottawa Hospital to guide thromboprophylaxis in ambulatory cancer patients at intermediate-high risk for venous thrombosis[J]. Thromb Res, 2015, 136(6): 1099-1102. DOI:10.1016/j.thromres.2015.08.002 |
| [31] |
Wu PY, Cheng CW, Kaddi CD, et al. -Omic and electronic health record Big Data analytics for precision medicine[J]. IEEE Trans Biomed Eng, 2017, 64(2): 263-273. DOI:10.1109/TBME.2016.2573285 |
| [32] |
Alonso SG, de la Torre Díez I, Rodrigues JJPC, et al. A systematic review of techniques and sources of Big Data in the healthcare sector[J]. J Med Syst, 2017, 41(11): 183. DOI:10.1007/s10916-017-0832-2 |
 2020, Vol. 47
2020, Vol. 47