文章信息
- HK2通过Wnt/β-catenin信号通路上调Cyclin D1、MMP7和Slug表达促进宫颈癌细胞增殖和迁移
- HK2 Promotes Proliferation and Migration of Cervical Cancer Cells by Up-regulating Cyclin D1 and MMP7 Expression Through Wnt/β-catenin Signaling Pathway
- 肿瘤防治研究, 2020, 47(9): 649-654
- Cancer Research on Prevention and Treatment, 2020, 47(9): 649-654
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0094
- 收稿日期: 2020-02-10
- 修回日期: 2020-06-16
2. 710061 西安,西安交通大学医学部;
3. 710021 西安,西安医学院基础医学部细胞与遗传教研室
2. Medical College of Xi'an Jiaotong University, Xi'an 710061, China;
3. Department of Cell and Genetics, Basic Medicine, Xi'an Medical University, Xi'an 710021, China
Competing interests: The authors declare that they have no competing interests.
宫颈癌是一种严重威胁女性健康和生命的生殖系统恶性肿瘤之一。在全球范围内,宫颈癌是次于乳腺癌和结直肠癌的女性第四种常见的肿瘤类型[1]。己糖激酶2(Hexokinase 2, HK2)是己糖激酶(Hexokinase, HK)同工酶的一种,是糖酵解途径中的一个关键酶,低氧状态、葡萄糖、胰岛素等因素均可上调HK2在肿瘤细胞中的表达,目前的研究发现HK2在胶质瘤、胃癌、结直肠癌等肿瘤中高表达,其表达水平与肿瘤的恶性程度密切相关[2]。HK2与线粒体外膜结合后,通过促进异常糖酵解,可以抑制细胞凋亡从而促进肿瘤细胞增殖[3]。但HK2通过Wnt/β-catenin信号转导通路调节宫颈癌细胞生物学行为的研究仍不多见。因此,本研究通过观察HK2对宫颈癌HeLa细胞增殖、细胞活力、细胞周期、迁移和侵袭等生物学行为的影响,探讨HK2通过Wnt/β-catenin信号转导通路中相关蛋白的表达,从而促进宫颈癌细胞增殖和迁移的分子机制,为宫颈癌的治疗探索新的路径。
1 材料与方法 1.1 材料宫颈癌细胞系HeLa购自美国ATCC。质粒表达载体pCAG-IRES2-AcVEC-neo由本实验室保存。DMEM培养基购自上海源培生物科技有限公司,胎牛血清购自以色列Biological Industries公司,Slug蛋白抗体购自美国Cell Signaling Technology公司,HK2、β-catenin、Cyclin D1、MMP7和GAPDH蛋白抗体均购自美国Santa Cruz公司, Wnt/β-catenin信号通路抑制剂(XAV-939)购自美国Selleck公司,其余试剂为国产分析纯。
1.2 方法 1.2.1 细胞培养人宫颈癌细胞HeLa培养于含10%胎牛血清的DMEM培养基中,置于5%CO2的37℃孵箱中进行常规培养。
1.2.2 G418压力筛选稳定表达HK2蛋白的HeLa细胞系将1×105个细胞接种于6孔板内,待细胞生长至70%~80%融合时,将2 μg重组质粒DNA通过Lipofectamine 2000脂质体转染试剂转染于细胞中。24 h后,将细胞按照1:10比例接种到100 mm培养皿中,加入含有1 000 mg/ml G418的培养基,G418压力筛选3~4周后,挑取细胞单克隆至24孔板中,继续扩增培养。通过Western blot及细胞免疫化学实验,鉴定HK2表达阳性的单克隆细胞。
1.2.3 细胞免疫化学将对数生长期的细胞常规消化后制备成细胞悬液,接种于0.5 cm×0.5 cm的爬片上,待细胞融合度达到70%左右,PBS液洗涤5 min×3次后,4%多聚甲醛室温固定30 min。PBS液洗涤5 min×3次,加入0.2%TritonX-100,室温放置10 min。PBS洗涤5 min×3次后,将细胞爬片粘在载玻片上滴加一抗,4℃湿盒过夜。次日,取出湿盒,室温放置30 min,PBS洗涤5 min×3次,滴加二抗,室温放置30 min。PBS洗涤5 min×3次后,DAB显色,中性树胶封片,光学显微镜下观察。
1.2.4 细胞计数法检测细胞增殖将细胞胰酶消化后制备成单细胞悬液,按照4×104个每皿的浓度接种于6孔板里。接种后1、3、5、7 d分别进行细胞计数。根据细胞计数结果绘制细胞生长曲线,每组试验设置3个复孔。实验重复3次。
1.2.5 MTT法检测细胞活性将细胞胰酶消化后制成单细胞悬液,以1×103个每孔浓度接种于96孔培养板中。于接种后1、3、5、7 d,采用MTT法检测各组OD值。步骤如下:每孔加入20 μl MTT (5 mg/ml),5%CO2培养箱孵育4 h,吸弃上清液,加入100 μl的DMSO,摇床震荡10 min后于酶标仪上测定490 nm波长吸光度值,根据吸光度值绘制生长曲线,各实验组均设置3个复孔,实验重复3次。
1.2.6 细胞周期分析胰酶消化收集对数生长期细胞,1 000 r/min离心5 min,用预冷的PBS液洗涤细胞2次,加入预冷的70%酒精,4℃冰箱固定细胞12 h。1 000 r/min离心5 min,PBS液洗涤2次。用含0.01% RNase的PI染液100 μl处理细胞,4℃避光染色30 min。使用流式细胞仪进行检测,通过CellQuest软件分析结果。重复实验至少3次。
1.2.7 Western blot实验收集处于对数生长期的细胞,加入细胞裂解液收集细胞蛋白,并测定各组细胞的蛋白浓度。将蛋白样本与蛋白质分子量标准分别上样于加样孔,进行SDS-PAGE分离蛋白。电泳结束后,进行转膜,转膜结束后,将膜移至含5%的脱脂奶粉的TBST缓冲液中室温封闭1 h,用TBST洗膜10 min×4次。加入一抗,4℃孵育过夜。次日,TBST洗膜10 min×4次,加二抗,室温孵育1 h,TBST洗膜10 min×4次,化学发光检测液进行发光反应,Western blot化学发光成像一体机(陕西鑫来博生物工程有限公司)拍照分析。
1.2.8 细胞划痕实验将细胞接种于6孔板中生长至90%~95%融合度,用20 μl无菌枪头划一横线,PBS清洗细胞3次,加入无血清的DMEM培养基继续培养24 h,用倒置显微镜进行观察及拍照,选取5个视野进行统计分析。
1.2.9 Transwell体外迁移实验HeLa细胞饥饿24h后制备成细胞悬液,PBS清洗1遍后,调整细胞浓度为每毫升20×105个。将200 μl细胞悬液加入于Transwell上室,下室中加入600 μl的含10% FBS的DMEM培养基,之后置于含5%CO2的37℃孵箱中进行孵育。24 h后,用棉签擦去上室内残留的细胞,甲醛固定10 min后,用0.1%的结晶紫室温孵育10 min,PBS清洗3遍后,将Transwell小室底面朝上于显微镜下拍照观察,随机选取5~10个视野进行计数,进行统计分析,重复上述实验3次。
1.2.10 Transwell体外侵袭实验Transwell上室中平铺1:3的Matrigel胶50 μl,紫外灯照射消毒6 h后,将200 μl的细胞悬液加入Transwell上室,下室中加入600 μl的含10% FBS的DMEM培养基,后续步骤同体外迁移实验。
1.2.11 抑制Wnt/β-catenin信号转导通路在HK2过表达HeLa细胞中的活性Wnt/β-catenin信号通路抑制剂XAV-939按照说明书溶于DMSO,XAV-939工作浓度参考本实验室前期使用浓度,以80 µmol/L为本研究工作浓度开展后续实验[4]。将细胞培养液更换为含XAV-939培养液后,分别于培养1、3、5、7天进行细胞计数和MTT。将Transwell小室内外细胞培养液更换为含XAV-939的DMEM培养液后,进行Transwell体外迁移和侵袭实验,孵育48 h后记录结果; 收集经过XAV-939培养液培养的细胞(孵育24 h后),加入细胞裂解液收集细胞蛋白,通过Western blot检测相关蛋白表达。
1.2.12 TOP/FOP萤火虫荧光素酶报告系统实验(TOP/FOP-Flash Luciferase reporter assay)取对数生长期的各组细胞,0.25%胰酶消化重悬为单细胞悬液,以5×104个/孔细胞浓度接种于24孔板。将TOP/FOP-Flash报告基因质粒与内参载体海参(pRL-TK)报告基因质粒按照LipofectamineTM 2000脂质体转染系统说明操作分别共转染于HeLa-VEC和HeLa-Slug细胞。转染48 h后,按照双荧光素酶报告基因检测试剂盒操作说明检测荧光素酶活性:弃去24孔板中的培养基,加入PBS,轻轻洗涤细胞后弃去洗涤液,加入100 μl的1×PLB细胞裂解液裂解细胞,将细胞悬液移入1.5 ml EP管,待测。取待测样品20 μl加入EP管中,然后加入100 μl荧光素酶测试试剂LARⅡ吹打混合后,放入发光检测仪中检测萤火虫荧光素酶活性,记录第一次发光值为FLU。加入等体积的1×Stop & GloTM试剂,轻轻混匀,放入发光检测仪中检测Renilla荧光素酶活性,记录第二次发光值为RLU。以FLU/RLU比值评估TOP/FOP-Flash报告基因的相对表达量。
1.3 统计学方法用SPSS17.0软件进行数据的统计学分析,实验数据结果以均数±标准差(x±s)表示,多组样本间的均数比较采用单因素方差分析,两组样本间的均数比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 HK2促进HeLa细胞的体外增殖和细胞活力Western blot结果显示,经过G418压力筛选后,成功获得了稳定表达HK2蛋白的HeLa-HK2-5、HeLa-HK2-9及对照细胞HeLa-VEC-1和HeLa-VEC-2细胞系,见图 1A。通过绘制细胞生长曲线,发现过表达HK2可以促进HeLa细胞的增殖(P=0.0054),见图 1B。MTT法检测结果显示,过表达HK2可以增强HeLa细胞的细胞活力(P=0.0078),见图 1C。细胞计数和MTT实验均表明,过表达HK2可以促进宫颈癌细胞HeLa的体外增殖。

|
| **: P < 0.01; A: expression of HK2 in stable transfected HeLa cell was detected by Western blot; the proliferation(B), viability(C) and cell cycle(D) of HeLa-VEC and HeLa-HK2 cells were detected by cell growth curves, MTT assay and flow cytometry, respectively. 图 1 HK2对宫颈癌HeLa细胞的影响 Figure 1 Effect of HK2 on HeLa cells |
流式细胞仪分析结果显示,HeLa细胞中过表达HK2后,HeLa-HK2细胞中处于G0/G1的细胞百分比为(45.46±3.43)%,明显低于HeLa-VEC细胞(57.75±1.03)%(P=0.0092),HeLa-HK2细胞中处于S期的细胞百分比为(38.02±2.31)%,明显高于HeLa-VEC细胞(26.62±3.49)%(P=0.0091),见图 1D。这些结果表明,在HeLa细胞中过表达HK2可以促进细胞周期从G1期向S期转换。
2.2 HK2促进HeLa细胞的体外迁移和侵袭细胞划痕实验结果显示,在观察48 h时,HeLa-HK2中细胞划痕的愈合速度快于HeLa-VEC细胞(P=0.0045),见图 2A。Transwell体外迁移实验结果显示,过表达HK2后,每个视野下穿过Transwell小室的细胞数量(249.33±21.78)多于HeLa-VEC细胞数量(147.67±8.51),P=0.0017,见图 2B。Transwell体外侵袭实验结果表明,过表达HK2后,每个视野下穿过Transwell小室的细胞数量(118.34±10.69)多于HeLa-VEC细胞(45.11±10.34),P=0.015,见图 2C。这些结果提示过表达HK2后可以增强HeLa细胞体外迁移和侵袭的能力。
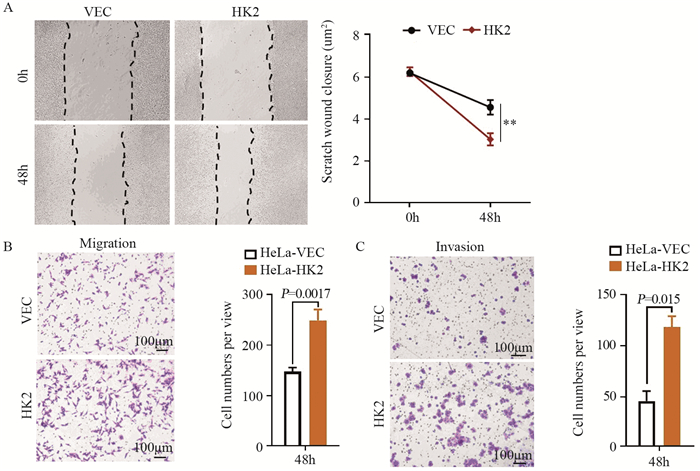
|
| **: P < 0.01. 图 2 HK2增强HeLa细胞迁移(A, B)和侵袭(C)的能力 Figure 2 Effect of HK2 on migration(A, B) and invasion(C) abilities of HeLa cells detected by wound-healing assay and Transwell assay |
Western blot和免疫细胞化学检测结果表明,过表达HK2后,可以显著上调β-catenin、Cyclin D1、MMP7和Slug蛋白在HeLa细胞中的表达(P < 0.05),见图 3A、B。萤火虫荧光素酶(TOP/FOP)实验结果也证实,过表达HK2后可增强Wnt/β-catenin信号转导通路活性(P=0.025),见图 3C。
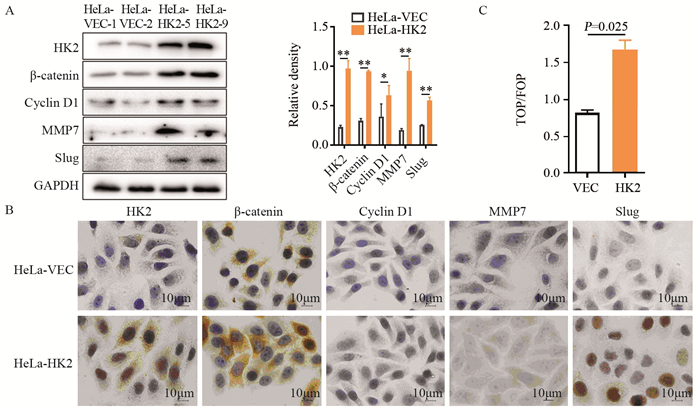
|
| *: P < 0.05, **: P < 0.01; A: expression of HK2, β-catenin, Cyclin D1, MMP7 and Slug in HeLa-VEC and HeLa-HK2 cells was detected by Western blot and immunocytochemistry (B ×100); C: the activity of Wnt/β-catenin signalling pathway was detected by TOP/FOP assay. 图 3 HK2增强Wnt/β-catenin信号转导通路活性 Figure 3 HK2 enhanced activity of Wnt/β-catenin signaling pathway in HeLa cells |
在HK2过表达HeLa细胞中添加Wnt/β-catenin信号通路抑制剂(XAV-939)后,可以显著抑制β-catenin及Wnt/β-catenin信号通路下游蛋白Cyclin D1、MMP7和Slug在HeLa-HK2细胞中的表达(P < 0.05),见图 4A。细胞计数和MTT实验表明,XAV-939可以抑制HeLa-HK2细胞的增殖(P=0.0095)和细胞活力(P=0.0083),见图 4B~C。Transwell体外迁移和侵袭实验的结果也证实,XAV-939可以抑制HeLa-HK2细胞体外迁移(P=0.0065)和侵袭能力(P=0.0088),见图 4D~E。上述结果提示,在HeLa-HK2细胞中使用XAV-939抑制Wnt/β-catenin信号转导通路活性后,可逆转HK2对HeLa细胞增殖、迁移和侵袭的促进作用。
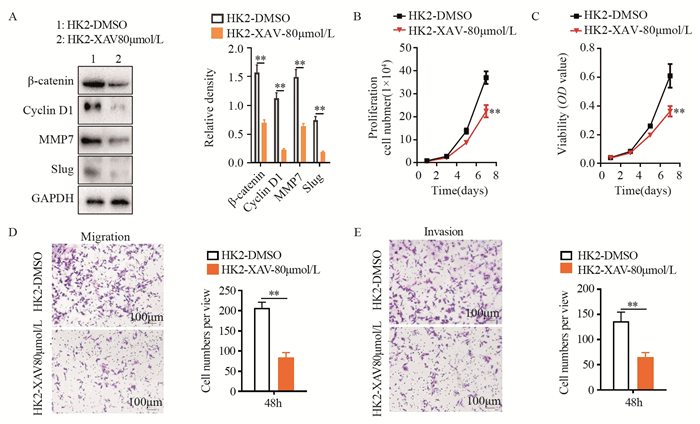
|
| **: P < 0.01; A: expression of β-catenin, Cyclin D1, MMP7 and Slug was detected by Western blot in XAV-939 or DMSO treated HeLa-HK2 cells; the proliferation (B) and viability (C) of XAV-939 or DMSO treated HeLa-HK2 cells were detected by growth curves and MTT; the migration(D) and invasion (E) of XAV-939 or DMSO treated HeLa-HK2 cells was analyzed by Transwell cell migration and invasion assay. 图 4 抑制Wnt/β-catenin信号转导通路活性可以减弱HK2对HeLa细胞增殖、迁移和侵袭的影响 Figure 4 Treating with the Wnt/β-catenin inhibitor XAV-939 inhibited HK2-induced HeLa cell growth, migration and invasion |
宫颈癌是一种妇科易发的恶性肿瘤,好发于20~50岁妇女,近年来宫颈癌的发病逐渐呈现出年轻化的倾向,其发展是一个缓慢的、多阶段的过程,在多种致癌因素的刺激下,宫颈鳞状上皮底层细胞增生活跃和分化不良,逐渐形成宫颈上皮的不典型增生,随着病情的进展,逐渐向鳞状上皮内病变、早期浸润癌、浸润癌发展[5]。
在葡萄糖代谢过程中,葡萄糖被己糖激酶磷酸化,转化为葡萄糖-6-磷酸,可以为肿瘤细胞的快速增殖提供能量支持。HK2被认为参与多种肿瘤细胞的生理过程,如神经胶质瘤[6]、胶质母细胞瘤[7]、结肠癌[8]和肝细胞癌[9]等,而HK2表达缺失可以抑制细胞增殖、促进细胞凋亡、抑制肿瘤生长。既往研究[10-11]发现HK2在宫颈癌中呈高表达状态,通过PI3K/Akt信号转导通路,可以促进SiHa细胞的增殖和迁移。本研究中,过表达HK2可以显著促进宫颈癌HeLa细胞的增殖和细胞活力。流式细胞术分析结果发现,在HeLa-HK2细胞中G0/G1期细胞数明显少于HeLa-VEC细胞,S期细胞数明显多于HeLa-Vec细胞。上述结果表明,在HeLa细胞中,HK2通过促进细胞周期从G0/G1期向S期的转换,促进细胞增殖。此外,在HeLa细胞中过表达HK2也可以显著增强HeLa细胞体外迁移和侵袭的能力。
在肿瘤细胞中,多种信号转导通路参与调节细胞的增殖、迁移和侵袭,而且糖代谢也与多种细胞内信号转导通路相关。那么HK2能否通过调节细胞内信号转导通路参与肿瘤细胞的增殖、迁移和侵袭?本研究中,HK2可以显著上调Wnt/β-catenin信号转导通路中关键蛋白β-catenin在HeLa细胞中的表达。TOP/FOP实验结果也证实,HK2可以增强Wnt/β-catenin信号转导通路在HeLa细胞中的活性。既往研究[12]证实,Wnt/β-catenin信号转导通路通过调节其下游蛋白的表达,参与肿瘤细胞的增殖、迁移和侵袭。本研究进一步发现,HK2可以上调Wnt/β-catenin信号转导通路下游蛋白Cyclin D1、MMP7和Slug的表达。
Cyclin D1作为一种细胞周期调节蛋白可以调节多种肿瘤细胞的增殖,而MMP7和Slug是上皮间质转化(EMT)过程中的两个重要蛋白,参与多种肿瘤细胞EMT进程,促进细胞的迁移和肿瘤的转移[13]。此外,在HK2过表达HeLa细胞中使用Wnt/β-catenin信号转导通路抑制剂XAV-939后,可以抑制β-catenin、Cyclin D1、MMP7和Slug蛋白的表达,同时也可以减弱HK2在HeLa细胞中对增殖、迁移和侵袭的促进作用。因此,本研究推测,HK2通过Wnt/β-catenin信号转导通路上调Cyclin D1、MMP7和Slug的表达,促进细胞体外增殖、迁移和侵袭。
综上所述,本研究发现HK2高表达可以促进宫颈癌细胞HeLa体外的增殖、迁移和侵袭; HK通过激活Wnt/β-catenin信号转导通路,可以上调Cyclin D1表达,促进HeLa细胞的增殖; HK2通过激活Wnt/β-catenin信号转导通路,可以上调MMP7和Slug的表达,增强HeLa细胞的体外迁移和侵袭。上述结果提示HK2通过增强Wnt/β-catenin信号转导通路活性可以在HeLa细胞中发挥促进增殖、迁移和侵袭的作用。但HK2作为一种己糖激酶是通过直接还是间接作用调节Wnt/β-catenin信号转导通路活性的分子机制仍有待进一步的研究。
Competing interests: The authors declare that they have no competing interests.
作者贡献
冯倩、崔南:设计实验、撰写论文、修改论文
刘宪:实验实施、采集数据、统计分析
张妮:分析和解释数据
| [1] |
Yu M, Xu B, Yang H, et al. MicroRNA-218 regulates the chemo-sensitivity of cervical cancer cells through targeting survivin. Cancer Manag Res[J]. Cancer Manag Res, 2019, 11: 6511-6519. DOI:10.2147/CMAR.S199659 |
| [2] |
Fan K, Fan ZY, Cheng H, et al. Hexokinase 2 dimerization and interaction with voltage-dependent anion channel promoted resistance to cell apoptosis induced by gemcitabine in pancreatic cancer[J]. Cancer Med, 2019, 8(13): 5903-5915. DOI:10.1002/cam4.2463 |
| [3] |
Fei X, Jing JY, Yun G, et al. MiR-885-5p Negatively Regulates Warburg Effect by Silencing Hexokinase 2 in Liver Cancer[J]. Mol Ther Nucleic Acids, 2019, 18: 308-319. DOI:10.1016/j.omtn.2019.09.002 |
| [4] |
Cui N, Yang WT, Zheng PS. Slug inhibits the proliferation and tumor formation of human cervical cancer cells by up-regulating the p21/p27 proteins and down-regulating the activity of the Wnt/β-catenin signaling pathway via the trans-suppression Akt1/p-Akt1 expression[J]. Oncotarget, 2016, 7(18): 26152-26167. DOI:10.18632/oncotarget.8434 |
| [5] |
Sundström K, Elfström KM. Advances in cervical cancer prevention: Efficacy, effectiveness, elimination?[J]. PLoS Med, 2020, 17(1): e1003035. DOI:10.1371/journal.pmed.1003035 |
| [6] |
Liu H, Liu N, Cheng Y, et al. Hexokinase 2 (HK2), the tumor promoter in glioma, is downregulated by miR-218/Bmi1 pathway[J]. PLoS One, 2017, 12(12): e0189353. DOI:10.1371/journal.pone.0189353 |
| [7] |
Agnihotri S, Mansouri S, Burrell K, et al. Ketoconazole and Posaconazole Selectively Target HK2 Expressing Glioblastoma Cells[J]. Clin Cancer Res, 2019, 25(2): 844-855. DOI:10.1158/1078-0432.CCR-18-1854 |
| [8] |
Zhu W, Huang Y, Pan Q, et al. MicroRNA-98 Suppress Warburg Effect by Targeting HK2 in Colon Cancer Cells[J]. Dig Dis Sci, 2017, 62(3): 660-668. DOI:10.1007/s10620-016-4418-5 |
| [9] |
Wei L, Yunhan Q, Ji H, et al. Dauricine upregulates the chemosensitivity of hepatocellular carcinoma cells: Role of repressing glycolysis via miR-199a: HK2/PKM2 modulation[J]. Food Chem Toxicol, 2018, 121: 156-165. DOI:10.1016/j.fct.2018.08.030 |
| [10] |
Liu C, Wang X, Zhang Y. The Roles of HK2 on Tumorigenesis of Cervical Cancer[J]. Technol Cancer Res Treat, 2019, 18: 1533033819871306. |
| [11] |
Huang XL, Liu MM, Sun H, et al. HK2 is a radiation resistant and independent negative prognostic factor for patients with locally advanced cervical squamous cell carcinoma[J]. Int J Clin Exp Pathol, 2015, 8(4): 4054-4063. |
| [12] |
Wang CX, Xu JP, Fu HB, et al. TRIM32 promotes cell proliferation and invasion by activating β-catenin signalling in gastric cancer[J]. J Cell Mol Med, 2018, 22(10): 5020-5028. DOI:10.1111/jcmm.13784 |
| [13] |
Cao NJ, Mu L, Yang W, et al. MicroRNA-298 represses hepatocellular carcinoma progression by inhibiting CTNND1-mediated Wnt/β-catenin signaling[J]. Biomed Pharmacother, 2018, 106: 483-484. DOI:10.1016/j.biopha.2018.06.135 |
 2020, Vol. 47
2020, Vol. 47


