文章信息
- LincRNA-p21在癌症机制中的研究进展
- Advances in Mechanism of LincRNA-p21 in Cancer
- 肿瘤防治研究, 2020, 47(10): 802-806
- Cancer Research on Prevention and Treatment, 2020, 47(10): 802-806
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0064
- 收稿日期: 2020-01-30
- 修回日期: 2020-05-27
2. 730000 兰州,兰州大学第一医院普外科
2. Department of General Surgery, The First Hospital of Lanzhou University, Lanzhou 730000, China
非编码RNA(noncoding RNA, ncRNA)是指不编码蛋白质的RNA,包括snRNA、lncRNA、microRNA、circRNA等。由于基因芯片和高通量测序技术的快速发展,大量具有生物学功能的lncRNA被人类发现并认识[1]。lncRNA是指长度大于200 nt的非编码RNA,作用包括:表观遗传调控、调节染色体结构、控制转录、调节mRNA的稳定性、翻译和翻译后的修饰等[2]。
1 lincRNA-p21简介lincRNA-p21最初在小鼠实验中发现并报道,位于第17号染色体上,细胞周期调节基因cdkn1a(也称p21)的上游约15 kb处[3]。在DNA损伤等应激条件下,p53激活小鼠lincRNA-p21(mlincRNA-p21)的转录,mlincRNA-p21聚集在细胞核内,并与核不均核糖核蛋白K(heterogeneous nuclear ribonucleoprotein K, hnRNPK)结合,抑制特定靶基因的转录。lincRNA-p21也存在于人类基因中(hlincRNA-p21,全称tp53cor1),位于第6号染色体,作为p53的靶基因,主要参与p53调控。然而,与mlincRNA-p21不同的是,hlincRNA-p21可被运输至细胞质,并在细胞质中通过激活RISC复合体并抑制特定靶基因的翻译。测序发现hlincRNA-p21只含有单一的外显子,并由两种异构体组成。这两种异构体包含反向重复Alu元件(IRAlus)。lincRNA-p21中IRAlus相互折叠形成二级结构,IRAlus仅存在于灵长类动物的lincRNA-p21序列中,参与lincRNA-p21在细胞核内的定位[3]。
2 lincRNA-p21的作用机制p53是癌症中著名的抑癌基因,当细胞暴露在DNA损伤、端粒侵蚀或缺氧等应激信号中时,就会触发细胞应激反应,导致细胞周期停滞、凋亡和衰老。细胞应激反应的一个关键调节因子是p53。研究表明lincRNA-p21是p53的直接靶点,在基因转录中起抑制作用,通过增强细胞核内p53活性促进细胞凋亡。MDM2、ING1b和p21都是作用于p53的靶标,并与lincRNA-p21相关。
2.1 MDM2与lincRNA-p21MDM2是一种E3泛素蛋白连接酶,通过泛素蛋白酶体途径降解p53[4]。P300是一种乙酰基转移酶,它使p53乙酰化,从而增强p53活性。P300和MDM2通过复杂网络调控p53。MDM2还阻断P300与p53的相互作用,从而抑制p53乙酰化,降低其活性[5]。lincRNA-p21可与MDM2结合,减少p53-MDM2的相互作用,增加p53-P300的相互作用,增加p53的转录。lincRNA-p21通过p53、P300和MDM2相互作用的反馈机制调节p53的活性。
2.2 ING1b与lincRNA-p21ING1b是一种肿瘤抑制因子,可影响基因转录、细胞周期和细胞凋亡,其活性与p53密切相关。研究表明ING1b可减弱p53和MDM2之间相互作用,ING1b和MDM2竞争性的与p53结合调节p53的稳定性和活性。DNA损伤后或ING1b过表达可显著诱导lincRNA-p21转录。lincRNA-p21作用于ING1b的下游基因,ING1b通过与其启动子结合上调lincRNA-p21水平。在缺少lincRNA-p21的情况下,ING1b引起细胞凋亡的能力也受到抑制。在DNA损伤应激中,lincRNA-p21的表达在ING1b诱导的细胞凋亡中起着至关重要的作用,并且这种效应被p53显著增强[6]。因此,lincRNA-p21是ING1b和p53信号通路的交点,诱导细胞凋亡。
2.3 p21与lincRNA-p21细胞周期蛋白依赖性激酶抑制剂p21位于lincRNA-p21上游。p21是p53转录调控的直接靶点,并控制细胞周期从G1期向S期的转变。p53和p21结合MDM2和底物Slug,形成p53/p21/MDM2/Slug复合物,促进降解。由于Slug增强了癌细胞的侵袭能力,其降解有助于p53/p21的抗侵袭作用[7]。lincRNA-p21将hnRNP-K招募到p21启动子上,启动p21转录。因此lincRNA-p21与hnRNP-K共同作为p21的转录激活因子。
2.4 lincRNA-p21与Warburg效应大量研究表明肿瘤细胞的新陈代谢与正常细胞的新陈代谢不同。即使在氧气充足的情况下,肿瘤细胞优先进行糖酵解获取能量,称为Warburg效应[8]。Warburg效应不仅可以满足肿瘤细胞需求,并为肿瘤生长提供优势。缺氧反应的一个关键介质是缺氧诱导因子-1(Hypoxia inducible factor-1, HIF-1)。HIF-1是一种α/β异源二聚体转录因子。在常氧条件下,HIF-1被脯氨酸羟化酶(PHD)羟化,羟基化的HIF-1被VHL蛋白识别,VHL蛋白起泛素E3连接酶的作用,降解HIF-1[9]。但在低氧条件下,PHD活性受到抑制。HIF-1通过与启动子中的缺氧反应元件(HRE)结合,上调糖酵解和下调氧化磷酸化,HIF-1通过以上途径协调Warburg效应。lincRNA-p21是HIF-1α的直接转录靶标,缺氧条件下,lincRNA-p21和HIF-1α可竞争性地结合VHL减少HIF-1α降解,lincRNA-p21诱导HIF-1α的表达,从而形成一个正反馈回路加强Warburg效应[10]。
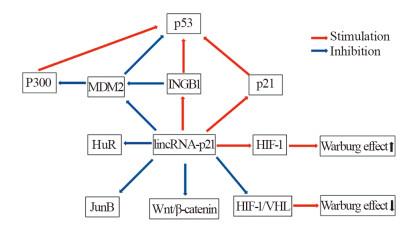
2.5 lincRNA-p21其他方面作用机制HuR是一种普遍存在的RNA结合蛋白,可影响细胞存活、增殖,并产生致癌作用[11]。在正常细胞中,lincRNA-p21通过与HuR/ELAV1的相互作用而保持较低水平状态。HuR与Ago2蛋白和Let-7形成复合物协同作用来破坏lincRNA-p21的稳定性,降低lincRNA-p21相关mRNA的翻译[12]。在体细胞重编程中,lincRNA-p21与hnRNPK结合,通过多功能基因启动子维持H3K9me3和CpG甲基化来阻止重新编程。在研究骨髓间充质干细胞方面,lincRNA-p21通过Wnt/β-catenin信号通路调节氧化应激,使衰老的骨髓间充质干细胞恢复活力[13]。lincRNA-p21还可通过调节Wnt/β-catenin信号通路减轻氧化应激,有效地保护心肌免受阿霉素(Dox)的心脏毒性作用[14]。lincRNA-p21通过与靶标的mRNA结合来抑制翻译,其中一个靶标是JunB,JunB具有促进细胞周期进展和肿瘤进展。因此,lincRNA-p21通过多种机制调节细胞增殖、细胞周期、凋亡、代谢、体细胞重编程等多种生物学行为,见图 1。
|
| 图 1 lincRNA-21机制示意图 Figure 1 Mechanism of lincRNA-21 |
lincRNA-p21与人类疾病的发展密切相关,特别是在肿瘤的进展与治疗方面。lincRNA-p21在绝大多数肿瘤组织和细胞中表达下调,包括结肠癌、胃癌、肝癌、前列腺癌等。
3.1 lincRNA-p21与消化系统 3.1.1 lincRNA-p21与肝癌肝纤维化的最终结局是导致肝硬化、肝癌,而肝星状细胞(HSC)是肝纤维化的关键细胞[15]。已证实,lincRNA-p21在肝纤维化和肝癌组织中表达均下调,低表达与疾病的预后密切相关[16]。lincRNA-p21通过上调p21抑制HSC的细胞周期和增殖,还通过miR-181b/PTEN和Wnt/β-catenin途径抑制HSC的活化,从而抑制肝纤维化[17]。在肝癌的相关研究中显示:(1)lincRNA-p21可诱导肝癌细胞凋亡,并通过Notch/EMT和miR-9/E-cadherin信号通路抑制肝癌细胞的侵袭和转移; (2)lincRNA-p21可通过靶向HIF-1α降低VEGF水平,从而抑制癌细胞增殖和侵袭能力[18];(3)lincRNA-p21促进内质网应激,而内质网应激是索拉非尼治疗肝癌的主要机制,因此lincRNA-p21有助于索拉非尼诱发内质网应激,加强药物疗效。综上所述,lincRNA-p21可作为肝细胞损伤的潜在标志物,以及肝癌预后因子和治疗靶点。
3.1.2 lincRNA-p21与结直肠癌肿瘤干细胞在癌症的进展与治疗中起关键作用。在研究结直肠癌干细胞时发现,lincRNA-p21表达下调,敲除lincRNA-p21显著增加结直肠癌干细胞的致癌性。银杏叶提取物761(EGB761)是一种抗氧化剂,可降低结直肠癌细胞的侵袭性。EGB761通过上调lincRNA-p21并与EZH2结合抑制结直肠癌细胞的转移,lincRNA-p21还通过E-cadherin参与EGB761的抗癌作用[19]。Wnt/β-catenin信号通路是肿瘤进展过程中的重要信号通路。lincRNA-p21主要通过抑制β-catenin信号通路和上调noxa促凋亡基因增强结直肠癌对放疗的敏感度。
3.1.3 lincRNA-p21与胃癌、食管癌胃癌组织中lincRNA-p21表达下调,敲除lincRNA-p21促进肿瘤细胞的浸润与迁移。YAP1/Hippo和p53是保护DNA完整性的关键因素。YAP1是Hippo信号通路的主要效应物,可调节肿瘤发生、细胞周期调控,信号转导和细胞骨架重塑等多种生理过程,lincRNA-p21可通过YAP1的上调来促进胃癌的发展[20]。lincRNA-p21过表达通过调节β-catenin信号通路抑制胃癌细胞增殖并增加胃癌细胞对放射治疗的敏感度[21]。这些数据表明lincRNA-p21在胃癌的发展中起着抑癌基因的作用。lincRNA-p21在食管癌中表达也显著降低,并起着抑癌作用[22]。lincRNA-p21可诱导p21的表达抑制食管癌细胞周期进程和增殖。
3.2 lincRNA-p21与呼吸系统急性呼吸窘迫综合征(ARDS)是各种原因引起顽固性低氧血症为特征的临床综合征。ARDS常导致持续性的肺泡和间质纤维化。lincRNA-p21通过抑制Thy-1的表达而导致ARDS肺纤维化。lincRNA-p21在肺癌组织中表达下调。研究lincRNA-p21与128例非小细胞肺癌患者术后的预后关系发现,高表达lincRNA-p21的患者具有更长的生存期和较好的预后,并且lincRNA-p21是肺腺癌患者预后的独立标志物[23]。
3.3 lincRNA-p21与泌尿系统研究证实在膀胱癌和前列腺癌细胞中lincRNA-p21表达下调,lincRNA-p21表达下调与肿瘤的高分期和预后不良相关[24]。研究表明:(1)lincRNA-p21通过谷氨酰胺酶抑制谷氨酰胺分解代谢来抑制膀胱癌细胞生长; (2)lincRNA-p21在体外和体内均可抑制前列腺癌的生长。lincRNA-p21促进p53与其下游促凋亡基因的启动子结合,从而增加其表达并促进细胞凋亡; (3)lincRNA-p21通过下调PKM2抑制了前列腺癌细胞的增殖和致癌力[25]。血清前列腺特异性抗原(PSA)是前列腺癌的特异性标志物。使用lincRNA-p21与PSA联合检测前列腺癌患者敏感度和特异性分别为52%和94%。因此lincRNA-p21可作为前列腺癌的诊断、预后的标志物。
3.4 lincRNA-p21与循环系统胸主动脉瘤(TAA)患者主动脉组织和血液lincRNA-p21的表达明显升高。lincRNA-p21通过激活TGF-β1信号通路来调节血管平滑肌细胞增殖和凋亡[26]。IgE激活lincRNAp21/p21途径诱导平滑肌细胞衰老,促进腹主动脉瘤的形成[27]。Wu等[28]研究lincRNA-p21与动脉粥样硬化机制时发现,在冠心病患者和小鼠的动脉粥样硬化斑块中,lincRNA-p21的表达下调。lincRNA-p21在体外抑制血管平滑肌细胞和小鼠单核巨噬细胞增殖。
3.5 lincRNA-p21与其他系统疾病lincRNA-p21在头颈部鳞状细胞癌、神经胶质瘤、弥漫性大B细胞淋巴瘤和类风湿关节炎中表达下调,而在帕金森病患者中表达上调。在头颈部鳞状细胞癌中观察到了lincRNA-p21与STAT3结合抑制肿瘤进展[29]。促肾上腺皮质释放因子通过激活lincRNA-p21抑制神经胶质瘤细胞增殖和侵袭。miR-146b-5p通过HuR/lincRNA-p21/β-catenin信号通路促进神经胶质瘤细胞凋亡、细胞周期停滞以及增强放射治疗的敏感度[12, 30]。弥漫性大B细胞淋巴瘤患者表达高水平lincRNA-p21具有良好的预后。此外,lincRNA-p21能通过细胞周期调节蛋白D1、CDK4和p21的表达来抑制弥漫性大B细胞淋巴瘤细胞的生长周期。在治疗类风湿关节炎中,甲氨蝶呤(MTX)可以通过升高lincRNA-p21的表达来降低NF-KB的表达抑制炎性反应。研究认为lincRNA-p21通过激活α-Synuclein表达抑制帕金森氏病的细胞活力并促进细胞凋亡, lincRNA-p21可能成为帕金森病治疗的新靶点[31],见表 1。
lincRNA-p21通过MDM2、ING1b和p21等多个靶标调节p53参与调控细胞周期、增殖、凋亡等多种生物学行为。低氧条件下,lincRNA-p21通过HIF-1α协调Warburg效应参与细胞代谢促进癌症的发生,但是在常氧条件下不具备此种功能。因此下一步可继续探索lincRNA-p21在常氧和低氧条件下在肿瘤中的生物功能及机制。lincRNA-p21与各种疾病关系密切,尤其在肿瘤中,起到抑癌基因的作用,并与癌症的预后和治疗密切相关。lincRNA-p21可作为癌症的诊断、预后的生物标志物和治疗的靶标。虽然lincRNA-p21被证明在生理过程和疾病中是关键调节剂,但是lincRNA-p21的很多生物学功能仍未知。总之,lincRNA-p21在生物医学领域的作用是巨大的,需要更深入研究。
作者贡献
赵素月:文献查阅及论文撰写
朱克祥:论文修改指导
李文军、李汛:论文审校
| [1] |
Sun Q, Hao Q, Prasanth KV. Nuclear long noncoding RNAs: key regulators of gene expression[J]. Trends Genet, 2018, 34(2): 142-157. DOI:10.1016/j.tig.2017.11.005 |
| [2] |
Boon RA, Jae N, Holdt L, et al. Long noncoding RNAs: from clinical genetics to therapeutic targets?[J]. J Am Coll Cardiol, 2016, 67(10): 1214-1226. DOI:10.1016/j.jacc.2015.12.051 |
| [3] |
Chillon I, Pyle AM. Inverted repeat Alu elements in the human lincRNA-p21 adopt a conserved secondary structure that regulates RNA function[J]. Nucleic Acids Res, 2016, 44(19): 9462-9471. |
| [4] |
Feeley KP, Adams CM, Mitra R, et al. Mdm2 is required for survival and growth of p53-deficient cancer cells[J]. Cancer Res, 2017, 77(14): 3823-3833. DOI:10.1158/0008-5472.CAN-17-0809 |
| [5] |
Kannan S, Partridge AW, Lane DP, et al. The dual interactions of p53 with MDM2 and p300: implications for the design of MDM2 inhibitors[J]. Int J Mol Sci, 2019, 20(23): 5996. DOI:10.3390/ijms20235996 |
| [6] |
Chen S, Liang H, Yang H, et al. LincRNa-p21: function and mechanism in cancer[J]. Med Oncol, 2017, 34(5): 98. DOI:10.1007/s12032-017-0959-5 |
| [7] |
Kim EM, Jung CH, Kim J, et al. The p53/p21 complex regulates cancer cell invasion and apoptosis by targeting Bcl-2 family proteins[J]. Cancer Res, 2017, 77(11): 3092-3100. DOI:10.1158/0008-5472.CAN-16-2098 |
| [8] |
Schwartz L, Supuran CT, Alfarouk KO. The warburg effect and the hallmarks of cancer[J]. Anticancer Agents Med Chem, 2017, 17(2): 164-170. DOI:10.2174/1871520616666161031143301 |
| [9] |
Pezzuto A, Carico E. Role of HIF-1 in cancer progression: novel insights. a review[J]. Curr Mol Med, 2018, 18(6): 343-351. |
| [10] |
Shen Y, Liu Y, Sun T, et al. LincRNA-p21 knockdown enhances radiosensitivity of hypoxic tumor cells by reducing autophagy through HIF-1/Akt/mTOR/P70S6K pathway[J]. Exp Cell Res, 2017, 358(2): 188-198. DOI:10.1016/j.yexcr.2017.06.016 |
| [11] |
Grammatikakis I, Abdelmohsen K, Gorospe M. Posttranslational control of HuR function[J]. Wiley Interdiscip Rev RNA, 2017, 8(1): 10. |
| [12] |
Yang W, Yu H, Shen Y, et al. MiR-146b-5p overexpression attenuates stemness and radioresistance of glioma stem cells by targeting HuR/lincRNA- p21/β-catenin pathway[J]. Oncotarget, 2016, 7(27): 41505-41526. |
| [13] |
Xia W, Zhuang L, Deng X, et al. Long noncoding RNAp21 modulates cellular senescence via the Wnt/betacatenin signaling pathway in mesenchymal stem cells[J]. Mol Med Rep, 2017, 16(5): 7039-7047. DOI:10.3892/mmr.2017.7430 |
| [14] |
Xie Z, Xia W, Hou M. Long intergenic noncoding RNAp21 mediates cardiac senescence via the Wnt/betacatenin signaling pathway in doxorubicin-induced cardiotoxicity[J]. Mol Med Rep, 2018, 17(2): 2695-2704. |
| [15] |
Liu WT, Jing YY, Yu GF, et al. Hepatic stellate cell promoted hepatoma cell invasion via the HGF/c-Met signaling pathway regulated by p53[J]. Cell Cycle, 2016, 15(7): 886-894. DOI:10.1080/15384101.2016.1152428 |
| [16] |
Wang T, Liu J, Li S, et al. Effects of knockout of lincRNA-p21 on the proliferation, migration and invasion ability of HepG2 liver cancer cells[J]. Oncol Lett, 2019, 17(6): 5103-5107. |
| [17] |
Yu F, Guo Y, Chen B, et al. LincRNA-p21 inhibits the Wnt/beta-catenin pathway in activated hepatic stellate cells via sponging microrna-17-5p[J]. Cell Physiol Biochem, 2017, 41(5): 1970-1980. DOI:10.1159/000472410 |
| [18] |
Ye Y, Peng Y, Li Y, et al. Effect of lincRNA-p21 targeting HIF-1alpha on biological functions of liver cancer cells[J]. Oncol Lett, 2019, 17(6): 4964-4968. |
| [19] |
Chang L, Liu T, Chai Z, et al. lincRNA-p21 mediates the anti-cancer effect of ginkgo biloba extract EGb 761 by stabilizing E-cadherin protein in colon cancer[J]. Med Sci Monit, 2018, 24: 9488-9496. DOI:10.12659/MSM.911924 |
| [20] |
Chen Y, Wei G, Xia H, et al. Down regulation of lincRNA-p21 contributes to gastric cancer development through Hippo-independent activation of YAP[J]. Oncotarget, 2017, 8(38): 63813-63824. DOI:10.18632/oncotarget.19130 |
| [21] |
Chen L, Yuan D, Yang Y, et al. LincRNA-p21 enhances the sensitivity of radiotherapy for gastric cancer by targeting the beta-catenin signaling pathway[J]. J Cell Biochem, 2019, 120(4): 6178-6187. DOI:10.1002/jcb.27905 |
| [22] |
Zhang Y, Miao Y, Shang M, et al. LincRNA-p21 leads to G1 arrest by p53 pathway in esophageal squamous cell carcinoma[J]. Cancer Manag Res, 2019, 11: 6201-6214. DOI:10.2147/CMAR.S197557 |
| [23] |
Castellano JJ, Navarro A, Viñolas N, et al. LincRNA-p21 impacts prognosis in resected non-small cell lung cancer patients through angiogenesis regulation[J]. J Thorac Oncol, 2016, 11(12): 2173-2182. DOI:10.1016/j.jtho.2016.07.015 |
| [24] |
Zhou Q, Zhan H, Lin F, et al. LincRNA-p21 suppresses glutamine catabolism and bladder cancer cell growth through inhibiting glutaminase expression[J]. Biosci Rep, 2019, 39(4): BSR20182372. DOI:10.1042/BSR20182372 |
| [25] |
Wang X, Xu Y, Wang X, et al. LincRNA-p21 suppresses development of human prostate cancer through inhibition of PKM2[J]. Cell Prolif, 2017, 50(6): e12395. DOI:10.1111/cpr.12395 |
| [26] |
Hu W, Wang Z, Li Q, et al. Upregulation of lincRNA-p21 in thoracic aortic aneurysms is involved in the regulation of proliferation and apoptosis of vascular smooth muscle cells by activating TGF-beta1 signaling pathway[J]. J Cell Biochem, 2019, 120(3): 4113-4120. |
| [27] |
Guo W, Gao R, Zhang W, et al. IgE aggravates the senescence of smooth muscle cells in abdominal aortic aneurysm by upregulating lincRNA-p21[J]. Aging Dis, 2019, 10(4): 699-710. DOI:10.14336/AD.2018.1128 |
| [28] |
Wu G, Cai J, Han Y, et al. LincRNA-p21 regulates neointima formation, vascular smooth muscle cell proliferation, apoptosis, and atherosclerosis by enhancing p53 activity[J]. Circulation, 2014, 130(17): 1452-1465. DOI:10.1161/CIRCULATIONAHA.114.011675 |
| [29] |
Jin S, Yang X, Li J, et al. p53-targeted lincRNA-p21 acts as a tumor suppressor by inhibiting JAK2/STAT3 signaling pathways in head and neck squamous cell carcinoma[J]. Mol Cancer, 2019, 18(1): 38. |
| [30] |
Yang J, Gan X, Tan B, et al. Corticotropin-releasing factor suppresses glioma progression by upregulation of long non-coding RNA-p21[J]. Life Sci, 2019, 216: 92-100. DOI:10.1016/j.lfs.2018.07.003 |
| [31] |
Xu X, Zhuang C, Wu Z, et al. LincRNA-p21 inhibits cell viability and promotes cell apoptosis in Parkinson's Disease through Activating alpha-Synuclein Expression[J]. Biomed Res Int, 2018, 2018: 8181374. |
 2020, Vol. 47
2020, Vol. 47