文章信息
- 18F-FDG PET/CT多参数及Deauville五分法在弥漫大B细胞淋巴瘤疗效评估和预后预测中的价值
- Value of 18F-FDG PET/CT Parameters and Deauville 5-point Scoring in Efficacy Evaluation and Prognosis Prediction of Diffuse Large B Cell Lymphoma Patients
- 肿瘤防治研究, 2020, 47(8): 611-616
- Cancer Research on Prevention and Treatment, 2020, 47(8): 611-616
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0041
- 收稿日期: 2020-01-15
- 修回日期: 2020-05-16
弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)是最常见的非霍奇金淋巴瘤(non-Hodgkin’s lymphoma, NHL),约占成人淋巴瘤的30%左右,具有免疫表型及基因突变异质性[1],且发病率逐年上升,在临床表现、组织形态和预后等多方面具有明显的异质性。随着肿瘤分子生物学的研究发展,DLBCL患者BCL-2和BCL-6蛋白的不同表达在疗效反馈方面有重要的临床意义,但传统的影像学方法不能全面的评估淋巴瘤治疗效果。目前18F-FDG PET/CT显像是淋巴瘤分期和疗效评估有效的影像诊断方法之一,2009年第1次中期PET淋巴瘤国际工作会议推荐使用PET/CT Deauville五分法(5-PS),多年的临床应用也进一步肯定了5-PS用于化疗后评估的可重复性及预后价值。本文回顾性分析55例初治DLBCL患者的临床资料,通过5-PS方法评估疗效,旨在讨论SUVmax、ΔSUVmax、MTV代谢参数以及BCL-2和BCL-6蛋白对DLBCL患者预后的影响,为更好地预测患者预后及制定个体化治疗策略提供依据。
1 资料与方法 1.1 临床资料选取2014年1月1日—2015年12月31日在佛山市第一人民医院首诊初治患者60例。所有患者均经活检确诊为DLBCL,病理诊断参照血液淋巴组织肿瘤WHO(2011)分类第四版标准,并有免疫组织化学报告。所有患者化疗前均行18F-FDG PET/CT显像,中期化疗(3~4疗程)及化疗结束后6~8周分别行PET/CT显像,全疗程化疗结束6~24月后,行PET/CT显像监测复发和随访,55例患者共行218次扫描。排除标准:(1)淋巴瘤病灶已切除,PET/CT未发现阳性病灶;(2)同时并发其他恶性肿瘤;(3)临床资料不完整。其中2例患者术后显像未探查到淋巴瘤病灶,1例同时并发肺癌,2例失访,均予以剔除。最终55例临床及随访资料完整的患者入组,并进行回顾性分析。其中,男27例、女28例,年龄27~77岁,中位年龄56.8岁。
1.2 免疫组织化学采用全自动免疫组织化学仪(BenchMark XT,美国Roche公司)EnVision两步法染色,具体操作步骤参照试剂盒说明书和全自动免疫组织化学仪标准操作流程。染色结果半定量判断标准:(1)弥漫强阳性(强+),> 90%的瘤细胞弥漫强阳性着色;(2)异质性阳性(+),瘤细胞有强弱不等的抗原表达,且阳性细胞占所有瘤细胞的比例在≥25%~90%之间;(3)灶区阳性(弱+),10%~25%的肿瘤细胞强阳性或异质性阳性着色;(4)阴性(-),无阳性肿瘤细胞或阳性瘤细胞比例 < 10%。将病理结果按照阳性百分比分高低,依次记为1~4分:弥漫强阳性记4分;异质性阳性3分;灶区阳性记2分;阴性记1分。
1.3 PET/CT图像采集18F-FDG由广东原子高科同位素医药有限公司提供,放化纯度 > 95%。所有受检者禁食6 h以上,空腹血糖不高于10.0 mmol/L。按照5.18 MBq/kg计算剂量并静脉注射,平静休息60~90 min,显像检查前排尿,取仰卧位,扫描范围从颅顶至股骨上段。PET/CT设备为Philips Gemini Ⅱ,配备2排螺旋CT,PET系统视野中心空间分辨率为4.8 mm,CT扫描条件120 KV,200 Ma,0.75 s/r,层厚7.5 mm,螺距1.0。PET图像以全身3D采集,9~10个床位,3分钟/床位,轴向视野180 mm,相邻床位间重叠50%。PET数据采用三维行处理最大似然算法(3D-RAMLA)重建,并用CT数据进行非均匀衰减校正。
1.4 PET/CT图像分析 1.4.1 PET/CT图像处理所有PET/CT图像均由2名高年资核医学医师共同阅片。55例患者PET/CT原始数据导入西门子肿瘤代谢评估软件进行数据处理。将SUVmax > 1.5倍肝脏平均标准摄取值(SUVmean)和2倍肝脏SUVmean标准差之和的病灶设为可测量病灶,采用相对阈值法,以SUVmax的40%作为阈值,得到SUVmax和MTV[2]。
1.4.2 SUVmax的测量应用感兴趣区(ROI)技术测量SUVmax,治疗前选取摄取最高部位的SUVmax,标记为SUV1max;中期以及治疗结束后PET/CT评估治疗效果时,仍选取摄取最高部位的SUVmax,或当全身未发现高代谢灶时选择治疗前高代谢部位测量SUVmax,并标记为SUV2max。二者的差值SUV1max-SUV2max,标记为ΔSUVmax。
1.4.3 Deauville五分法(5-PS)标准病灶摄取FDG程度和纵隔血池、肝本底比较,1分为无摄取,2分为摄取程度低于纵隔,3分为介于纵隔和肝本底之间,4分为高于肝本底(小于3倍),5分为明显高于肝本底(大于3倍)或出现新病灶。参考Lugano分类[3],将化疗中期和化疗结束的PET/CT结果分为3个等级:(1)治疗无效或疾病进展:评分为4~5分,与治疗前基线比较,FDG摄取程度无明显变化甚至上升,PET/CT示无代谢反应(no metabolic response, NMR)或疾病代谢进展(progressive metabolic disease, PMD);(2)部分缓解或病变残留:评分为4~5分,与治疗前基线比较,FDG摄取程度下降,PET/CT示部分代谢反应(partial metabolic response, PMR);(3)完全缓解:评分为1~2分,标准治疗方案下评分3分,不管有无残留肿块,PET/CT示完全代谢缓解(complete metabolic response, CMR)。
1.5 随访随访时间从化疗结束后开始,截至2019年10月31日,中位随访时间25.8月(10~49月)。以2年无疾病进展生存期(PFS)作为生存评估指标,即自随访开始2年内出现疾病进展或复发、因疾病死亡或至随访截止时停止随访。根据中期化疗结果及截止随访结束,55例患者分为中期观察组(Deauville评分 < 4分)和中期进展组(Deauville评分≥4分)。
1.6 统计学方法采用SPSS21.0进行统计分析,SUVmax用中位数(M)和均值±标准差(x±s)表示,MTV用中位数显示;SUVmax、ΔSUVmax、MTV、BCL-2、BCL-6表达与疗效用Pearson卡方检验行相关性分析。SUVmax、ΔSUVmax、MTV行ROC曲线分析,并寻找最佳临界值,按照临界值对患者分组;对SUVmax、ΔSUVmax、MTV、Deauville评分、BCL-2和BCL-6表达进行Kaplan-Meier生存曲线分析和Cox回归分析,探讨多个指标和患者2年PFS的关系,P < 0.05为差异有统计学意义。
2 结果 2.1 SUVmax、ΔSUVmax、MTV和疗效的相关性治疗前SUV1max=22.1±8.4,中位数18.1;中期化疗结束,SUV2max=12.6±10.3,中位数8.3;ΔSUVmax=15.7±7.8,中位数12.6;MTV中位数26.7 cm3;中期观察组患者40例,中期进展组患者15例。SUV1max、SUV2max和DLBCL患者疗效无显著相关性,ΔSUVmax、MTV和疗效呈负相关,见表 1。
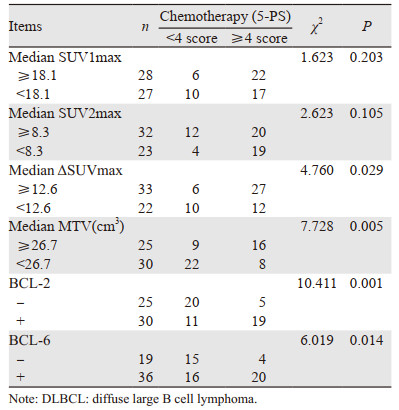
|
中期化疗结束,BCL-2(+)组30例患者中,10例NMR或PMD,9例PMR,11例CMR;BCL-2(-)组25例患者中,3例NMR或PMD,2例PMR,20例CMR。BCL-2(-)患者疗效明显好于BCL-2(+)患者,差异有统计学意义(χ2=10.411, P=0.001)。BCL-6(+)组36例患者中,15例NMR或PMD,5例PMR,16例CMR。BCL-6(-)组19例患者中,3例NMR或PMD,1例PMR,15例CMR。BCL-6(-)患者疗效明显好于BCL-6(+)患者,差异有统计学意义(χ2=6.019, P=0.014),见表 1。
2.3 SUVmax、ΔSUVmax、MTV、Deauville评分、BCL-2、BCL-6表达与患者2年PFS生存分析及Cox回归分析结果利用ROC曲线分别选取敏感度和特异性之和最大所对应的SUVmax、ΔSUVmax和MTV,临界值分别为19.7 cm3(AUC为0.644,敏感度49.4%,特异性79.5%)、10.6 cm3(AUC为0.856,敏感度87.9%,特异性76.4%)、30.1 cm3(AUC为0.832,敏感度72.3%,特异性78.6%),进行生存分析。SUVmax < 19.7组和SUVmax≥19.7组的2年PFS差异无统计学意义(χ2=2.258, P=0.133);ΔSUVmax < 10.6组和ΔSUVmax≥10.6组的2年PFS差异有统计学意义(χ2=7.022, P=0.008),见图 1A;MTV < 30.1组和MTV≥30.1组的2年PFS差异有统计学意义(χ2=8.068, P=0.005),见图 1B。截至随访结束,中期观察组患者31例;中期进展组(Deauville≥4)24例,其中6例在随访期间死于并发症。中期观察组(Deauville < 4)和中期进展组2年PFS差异有统计学意义(χ2=5.420, P=0.020),见图 1C。不同BCL-2和BCL-6表达患者的2年PFS差异有统计学意义(χ2=8.455和10.221, P=0.035和0.004),见图 1D、1E。将ΔSUVmax、MTV、Deauville评分及BCL-2和BCL-6表达分别进行Cox单因素和多因素回归分析显示,ΔSUVmax、MTV、Deauville评分和BCL-6均是2年PFS的独立影响因素(P=0.031、0.017、0.000、0.032),而单因素分析显示,BCL-2表达仅是2年PFS有意义的影响因素(P=0.039),而不是2年PFS的独立影响因素,见表 2。
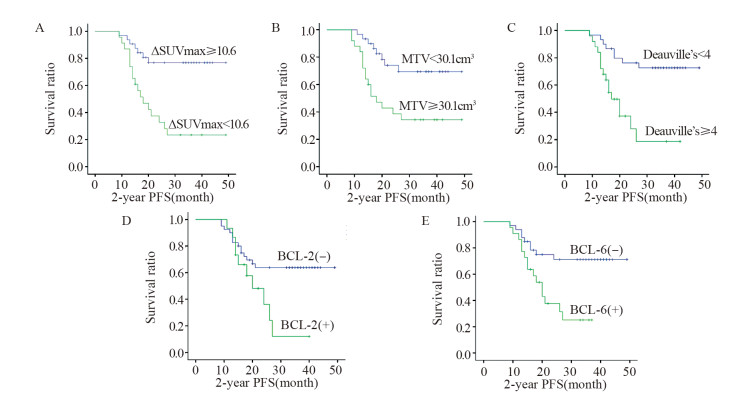
|
| DLBCL patients with ΔSUVmax≥10.6 (A), MTV < 30.1 cm3(B), Deauville's < 4 (C), BCL-2(-) (D) and BCL-6(-) (E) had higher 2-year PFS than those with ΔSUVmax < 10.6 (P=0.008), MTV≥30.1 (P=0.005), Deauville's≥4 (P=0.020), BCL-2(+) (P=0.035) and BCL-6(+) (P=0.004), respectively. PFS: progression-free survival. 图 1 DLBCL患者多个代谢参数对2年PFS的影响 Figure 1 Effect of multiple parameters on 2 year PFS of DLBCL patients |
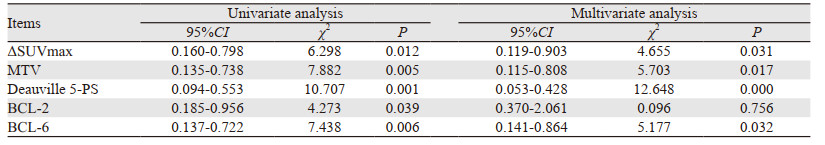
|
目前,SUVmax作为反映FDG代谢程度的一种半定量方法,广泛用于评估恶性肿瘤治疗效果。MyLam等[4]报道治疗后PET/CT结果阳性的患者2年PFS及OS均明显低于治疗后PET/CT结果阴性患者,治疗后PET/CT阳性结果提示患者预后不良。Xie等[5]认为SUVmax和PFS呈负相关。应志涛等[6]认为DLBCL患者规范一线治疗后PET/CT阴性及轻度代谢患者的预后相对较好,而治疗后PET/CT阳性患者预后相对较差,但SUVmax受显像时间、剂量和血糖水平等多重因素影响,且DLBCL患者大部分是多个病灶。Adams等[7]发现SUVmax与所有预后因子均无关。本研究结果也提示SUVmax值和中期化疗效果无相关性,可能是由于靶病灶的选择尚无指南或共识相关标准。活检部位或手术切除的病灶并非全部由PET/CT引导完成,肿瘤负荷最大的或最明显的病灶可能已被清除,也可能是活检的病灶并非是PET/CT摄取最显著的病灶,因此病理和靶病灶SUVmax并非来自同一病灶,影响了彼此的关联性。越来越多研究证实ΔSUVmax的应用价值,Casasnovas等[8]研究发现4程化疗后ΔSUVmax可预测PFS,而用目测SUVmax变化程度无预后意义。Meignan等指出[9]ΔSUVmax在治疗前SUVmax水平较低的情况下,可能出现假阳性。本研究显示,即ΔSUVmax值越大,化疗效果越好。朱璐婷等[10]认为ΔSUVmax可作为DLBCL患者预后的独立影响因素,但其最佳界值点各文献报道不一,成像协议、投照条件及阅片医师一致性等基线标准仍然可能对该值存在影响。
MTV是一种基于肿瘤体积大小的代谢参数,Adam等[7]研究指出MTV和临床分期存在相关性。Sasaneli等[11]分析MTV是DLBCL患者预后的独立影响因素,Cottereau等[12]分析指出MTV和PFS呈负相关,但梁颖等[13]发现MTV和PFS无相关性。丁重阳等[2]也报道MTV不是DLBCL患者预后的独立影响因素。由于MTV值和靶病灶的ROI勾画有直接关系,计算时需排除靶病灶以外的摄取,如心肌、肠道等生理性摄取,因此MTV值的获取存在诸多干扰因素,导致MTV在DLBCL患者的预后影响报道仍存在争议,但多数研究结果都肯定了MTV对DLBCL的预后价值。本研究显示MTV是2年PFS的独立影响因素,但由于样本量偏小,随访时间偏短,未能进一步分析MTV和OS的联系。
Deauville五分法是基于测量病灶SUVmax,只和当次显像的肝脏、纵隔SUVmax比较,而无需严格的基线对照,因此临床应用简便、易掌握。在霍奇金淋巴瘤(Hogkin’s lymphoma, HL)、DLBCL、滤泡性淋巴瘤患者全疗程疗效评估过程中,应用Deauville五分法在不同观察者之间具有很好的一致性[14]。2014年恶性淋巴瘤影像工作小组国际会议专家共识推荐Deauville标准作为DLBCL疗效评判标准,美国国立综合癌症网络(NCCN)指南(2016年第2版)指出应用Deauville评分标准是HL和DLBCL治疗结束后疗效评估的重要工具。秦文琼等[15]认为国际协作项目标准(IHPC)和Deauville标准均可用于疗效评价和预后评估,Deauville标准在一定程度上优于IHPC。Baratto等[16]研究Deauville标准优于IHPC和实体瘤的疗效评价标准(RECIST)1.1。Fuertes等[17]利用5-PS法分析中期PET/CT结果,得分 < 3的患者5年PFS和OS高于得分≥4的患者。本文亦采用5-PS法评估全疗程化疗效果,结果提示Deauville评分 < 4的患者2年PFS明显高于评分≥4的患者。Casasnovas等[18]发现,通过比较3名阅片者利用ΔSUVmax和Deauville五分法,前者的一致性更好。但在低危组淋巴瘤患者中,5-PS法预后价值更高[19]。高艳等[20]报道4疗程化疗后,ΔSUVmax下降比率与Deauville 5-PS呈负相关,即SUVmax下降越明显,5-PS评分越低。本文结果均提示二者对患者2年PFS具有预测价值。但在临床实际应用中,患者化疗后纵隔和肝脏血池本底的稳定性决定5-PS方法评估的准确性,另外显像过程中位移、致密影对PET衰减校正的影响等因素都可能影响纵隔和肝脏血池SUVmax的测量准确性,如何在评估过程中保证测量结果的可重复性,在今后的研究中还需深入探讨。
3.2 BCL-2和BCL-6表达评价中期化疗疗效和预后的价值BCL-2是位于线粒体上的膜蛋白,属于原癌基因,能够抑制肿瘤细胞凋亡,基于BCL-2蛋白的生物学功能,BCL-2蛋白对判断DLBCL的预后有一定价值。BCL-6也是一种具有下调基因转录而抑制细胞凋亡功能的原癌基因,位于3q27染色体,在淋巴细胞分化和生发中心形成过程中起着重要的作用,当发生DLBCL后,BCL-6基因发生断裂重排或扩增,表现为BCL-6蛋白异常表达,从而促进DLBCL的发生和发展。杨莉洁等[21]发现通过调节BCL-2表达及活性,可间接抑制细胞核转录因子(NF-κB)和c-Myc基因的表达,从而抑制DLBCL恶化。DLBCL患者BCL-2高表达,常见于结外受侵、肿瘤未完全缓解及IPI评分较高,表明BCL-2蛋白表达水平可作为DLBCL临床治疗及预后评价的指标。目前BCL-2表达对预后的影响仍存在争议,本研究中也仍然有5例患者表现为化疗效果不理想,复查PET/CT表现进展或部分代谢反应。魏华萍等[22]发现BCL-2阳性组患者3年PFS明显更低,3年OS差异无统计学意义,但BCL-2蛋白并不能作为判断DLBCL患者的预后因素。杨海燕等[23]通过生存分析显示BCL-2蛋白表达对DLBCL整体预后影响不大,但非生发中心起源B细胞亚型(non-GCB)组中,BCL-2蛋白表达与不良预后明显相关,BCL-6蛋白表达为良性预后因素。陈文婷等[24]研究BCL-2和BCL-6蛋白阳性表达会显著缩短其PFS。本文分析得到BCL-6阴性表达患者中期化疗疗效显著好于BCL-6阳性表达患者,且是2年PFS的独立影响因素,这和目前多数研究结果一致。但赵畅等[25]的研究结果不同,BCL-6表达与DLBCL的近期疗效无关。多个研究结果的矛盾性,可能与BCL-2蛋白截点的选择、纳入患者特征不同及随访时间长短有关。
综上所述,在临床实际工作中,用PET/CT评估DLBCL化疗效果的优势不言而喻。本文中讨论不同BCL-2和BCL-6的表达对疗效的预测价值,亦通过5-PS方法进行疗效的评估。因此如何更客观、实用地利用PET/CT代谢参数评估疗效,是影响预后的关键因素。靶病灶的选择、化疗对纵隔和肝血池本底的影响等不利因素仍是待解决的问题。然而这些不足有待通过更具体的前瞻性研究、其他放射性药物的出现及优化PET/CT物理性能等途径加以改进。
作者贡献
杨明:病例资料收集、数据统计分析及论文撰写
冯彦林:指导论文写作与修改
冼伟均、鲁胜男:数据统计分析
王颖、李雯:病例资料收集
黄克敏:临床显像及质量控制
| [1] |
Lenz G, Wright G, Dave SS, et al. Stromal gene signatures in large-B-cell lymphomas[J]. N Engl J Med, 2008, 359(22): 2313-2323. DOI:10.1056/NEJMoa0802885 |
| [2] |
丁重阳, 郭喆, 孙晋, 等. 治疗前18F-FDG PET-CT显像预测中晚期弥漫大B细胞淋巴瘤预后的价值[J]. 中华肿瘤杂志, 2018, 40(7): 528-533. [Ding CY, Guo Z, Sun J, et al. Prognostic value of pretreatment 18F-FDG PET-CT for patients with advanced diffuse large B-cell lymphoma[J]. Zhonghua Zhong Liu Za Zhi, 2018, 40(7): 528-533.] |
| [3] |
Cheson BD, Fisher RI, Barrington SF, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification[J]. J Clin Oncol, 2014, 32(27): 3059-3068. DOI:10.1200/JCO.2013.54.8800 |
| [4] |
MyLam KJ, El-Galaly TC, Hutchings M, et al. Prognostic impact of clinician-based interpretation of 18F-fluorodeoxyglucose positron emission tomography/computed tomography reports obtained in patients with newly diagnosed diffuse large B-cell lymphoma[J]. Leuk Lymphoma, 2014, 55(7): 1563-1569. DOI:10.3109/10428194.2013.850165 |
| [5] |
Xie M, Wu K, Liu Y, et al. Predictive value of F-18 FDG PET/CT quantization parameters in diffuse large B cell lymphoma: a meta analysis with 702 participants[J]. Med Oncol, 2015, 32(1): 446. DOI:10.1007/s12032-014-0446-1 |
| [6] |
应志涛, 王雪鹃, 宋玉琴, 等. 弥漫大B细胞淋巴瘤患者规范治疗后行18F-FDG PET/CT检查的预后意义[J]. 中华血液学杂志, 2012, 33(10): 810-813. [Ying ZT, Wang XJ, Song YQ, et al. Prognostic value of 18F-FDG PET/CT after first-line treatment in patients with diffuse large B cell lymphoma[J]. Zhonghua Xue Ye Xue Za Zhi, 2012, 33(10): 810-813.] |
| [7] |
Adam HJ, de Klerk JM, Fijnheer R, et al. Prognostic superiority of the National Comprehensive Cancer Network International Prognostic Index over pretreatment whole-body volumetric-metabolic FDG-PET/CT metrics in diffuse large B-cell lymphoma[J]. Eur J Haematol, 2015, 94(6): 532-539. DOI:10.1111/ejh.12467 |
| [8] |
Casasnovas RO, Meignan M, Berriolo-Riedinger A, et al. SUVmax reduction improves early prognosis value of interim positron emission tomography scans in diffuse large B-cell lymphoma[J]. Blood, 2011, 118(1): 37-43. DOI:10.1182/blood-2010-12-327767 |
| [9] |
Meignan M, Gallamini A, Itti E, et al. Report on the third international workshop on interim positron emission tomography in lymphoma held in Menton, France, 26-27 September 2011 and Menton 2011 consensus[J]. Leuk Lymphoma, 2012, 53(10): 1876-1881. DOI:10.3109/10428194.2012.677535 |
| [10] |
朱璐婷, 岑溪南, 欧晋平, 等. 中期18F-FDG PET/CT显像不同评价方法对弥漫大B细胞淋巴瘤患者预后判断价值[J]. 中国实验血液学杂志, 2017, 25(2): 431-437. [Zhu LT, Cen XN, Ou JP, et al. Values of Different Evaluation Criteria of Interim 18F-FDG PET/CT Scan for Prediction of Prognosis in Patients with DLBCL[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2017, 25(2): 431-437.] |
| [11] |
Sasaneli M, Meignan M, Haioun C, et al. Pretherapy metabolic tumour volume is an independent predictor of outcome in patients with duffuse large B-cell lymphoma[J]. Eur J Nucl Med Mol Imaging, 2014, 41(11): 2017-2022. DOI:10.1007/s00259-014-2822-7 |
| [12] |
Cottereau AS, Nioche C, Dirand AS, et al. 18F-FDG PET Dissemination Features in Diffuse Large B-Cell Lymphoma Are Predictive of Outcome[J]. J Nucl Med, 2020, 61(1): 40-45. DOI:10.2967/jnumed.119.229450 |
| [13] |
梁颖, 吴宁, 方艳, 等. 18F-FDG PET/CT显像SUVmax、MTV和TLG判断弥漫性大B细胞淋巴瘤的预后价值[J]. 中华核医学与分子影像杂志, 2015, 35(2): 97-101. [Liang Y, Wu N, Fang Y, et al. Prognostic significance of SUVmax, MTV and TLG on 18F-FDG PET/CT imaging in patients with diffuse large B-cell lymphoma[J]. Zhonghua He Yi Xue Yu Fen Zi Ying Xiang Za Zhi, 2015, 35(2): 97-101.] |
| [14] |
Barrinton SF, Mikhaeel NG, Kostakoglu L, et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the Intemational Conference on Malignant Lymphomas Imaging Working Group[J]. J Clin Oncol, 2014, 32(27): 3048-3058. DOI:10.1200/JCO.2013.53.5229 |
| [15] |
秦文琼, 陈秋松, 蔡莉, 等. IHPC和Deauville标准对淋巴瘤疗效评价及预后评估价值探讨[J]. 中华肿瘤防治杂志, 2018, 5(25): 663-667. [Qin WQ, Chen QS, Cai L, et al. Value of IHPC and Deauville criteria in the evaluation of response assement and prognosis in the HL and NHL patients[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2018, 5(25): 663-667.] |
| [16] |
Baratto L, Davidzon GA, Moghbel M, et al. Comparison between different PET and CT-based imaging interpretation criteria at interim imaging in patients with diffuse large B-cell lymphoma[J]. Clin Nucl Med, 2018, 43(1): 1-8. DOI:10.1097/RLU.0000000000001880 |
| [17] |
Fuertes S, Setoain X, Lopez-Guillermo A, et al. Interim FDG PET/CT as a prognostic factor in diffuse large B-cell lymphoma[J]. Eur J Nucl Med Mol Imaging, 2013, 40(4): 496-504. DOI:10.1007/s00259-012-2320-8 |
| [18] |
Casasnovas RO, Meignan M, Berriolo-Riedinger A, et al. Early interim PET scans in diffuse large B-cell lymphoma: Can there be consensus about standardized reporting, and can PET scans guide therapy choices?[J]. Curr Hematol Malig Rep, 2012, 7(3): 193-199. DOI:10.1007/s11899-012-0129-y |
| [19] |
Meignan M, Barrington S, Itti E, et al. Report on the 4th international workshop on positron emission tomography in lymphoma held in Menton, France, 3-5 October 2012[J]. Leuk Lymphoma, 2014, 55(1): 31-37. |
| [20] |
高艳, 赵晋华, 宋建华, 等. △SUV法和Deauville五分法在弥漫性大B细胞淋巴瘤预后中的作用[J]. 中华核医学与分子影像学杂志, 2016, 36(5): 420-425. [Gao Y, Zhao JH, Song JH, et al. Prognostic value of △SUV and Deauville 5-point scoring in patients with diffuse large B-cell lymphoma[J]. Zhonghua He Yi Xue Yu Fen Zi Ying Xiang Xue Za Zhi, 2016, 36(5): 420-425.] |
| [21] |
杨莉洁, 周伟. 弥漫大B细胞淋巴瘤组织中BCL-2、NF-κB、c-Myc蛋白表达及临床意义[J]. 中国医学前沿杂志(电子版), 2016, 8(11): 125-128. [Yang LJ, Zhou W. Expression and clinical effect of BCL-2, NF-κB, c-Myc protein in diffuse large B-cell lymphoma[J]. Zhongguo Yi Xue Qian Yan Za Zhi (Dian Zi Ban), 2016, 8(11): 125-128.] |
| [22] |
魏华萍, 赵小利, 王全顺, 等. BCL-2蛋白在弥漫大B细胞淋巴瘤中的表达及预后价值[J]. 中国实验血液学杂志, 2015, 23(6): 1607-1611. [Wei HP, Zhao XL, Wang QS, et al. Expression and Prognostic Value of BCL-2 Protein in Diffuse Large B-cell Lymphoma[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2015, 23(6): 1607-1611.] |
| [23] |
杨海燕, 尹文娟, 吴美娟, 等. BCL-2、MYC基因异常对弥漫大B细胞淋巴瘤患者预后的影响[J]. 中华血液学杂志, 2015, 36(8): 656-661. [Yang HY, Yin WJ, Wu MJ, et al. Prognostic analysis of BCL-2/MYC double-hit in diffuse large B-cell lymphoma[J]. Zhonghua Xue Ye Xue Za Zhi, 2015, 36(8): 656-661.] |
| [24] |
陈文婷, 姚红霞, 吴从明, 等. MYC、BCL-2、BCL-6检测在弥漫性大B细胞淋巴瘤患者预后判断中的价值[J]. 中国实验血液学杂志, 2019, 27(2): 452-457. [Chen WT, Yao HX, Wu CM, et al. Value of MYC, BCL-2 and BCL-6 for Evaluation of Prognosis in Patients with Diffuse Large B Cell Lymphoma[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2019, 27(2): 452-457.] |
| [25] |
赵畅, 张巧花. BCL-6和Ki-67在弥漫大B细胞淋巴瘤中的表达及其意义[J]. 白血病·淋巴瘤, 2012, 21(4): 221-224. [Zhao C, Zhang QH. Expressions and significance of BCL-6 and Ki-67 in diffuse large B-cell lymphoma[J]. Bai Xue Bing. Lin Ba Liu, 2012, 21(4): 221-224.] |
 2020, Vol. 47
2020, Vol. 47


