文章信息
- 恶性肿瘤家族史与乳腺癌患者临床病理特征的关系
- Association Between Family History of Malignant Neoplasms and Clinicopathological Features of Breast Cancer Patients
- 肿瘤防治研究, 2020, 47(10): 752-755
- Cancer Research on Prevention and Treatment, 2020, 47(10): 752-755
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0027
- 收稿日期: 2020-01-13
- 修回日期: 2020-04-15
乳腺癌是全球女性最常见的恶性肿瘤之一,美国癌症协会2019年公布的数据显示乳腺癌的发病率仍呈缓慢上升趋势[1]。乳腺癌的发生是多种因素长期作用的结果,目前其发病原因尚不完全明确。既往研究发现,乳腺癌家族史被认为是乳腺癌发病的危险因素,有乳腺癌家族史的人群中乳腺癌的发病风险是没有乳腺癌家族史的人群的1.8~3.9倍[2]。鉴于家族成员有相似的遗传易感性且有相似的环境暴露因素,传统观念中,恶性肿瘤家族史(family history of malignant neoplasms, MN-FH)也被认为是乳腺癌的危险因素。然而目前各种不同类型的恶性肿瘤家族史对乳腺癌的生物学影响尚无大规模的报道。本研究通过回顾性研究东南大学附属中大医院乳腺中心手术的乳腺癌患者的临床病理资料,拟探讨MN-FH与乳腺癌患者临床病理特征的关系,现报道如下。
1 资料与方法 1.1 一般资料收集2016年1月至2018年12月于东南大学附属中大医院因乳腺癌行手术治疗的女性患者病例资料。纳入标准:(1)接受手术治疗且术后病理明确为浸润性乳腺癌; (2)术前未接受新辅助治疗; (3)有完整的恶性肿瘤家族史相关信息。排除标准:(1)病理组织学诊断为非乳腺癌(如乳腺弥漫大B细胞淋巴瘤)或者乳腺原位癌; (2)明确有远处转移; (3)术前接受新辅助治疗; (4)无完整的恶性肿瘤家族史相关信息。所有患者均知情同意。
MN-FH均以患者自述或患者配偶或其成年子女的描述为依据,并要求确认既往病历或病理报告单,不能提供者由单独调查人员通过电话随访患有恶性肿瘤的家属或其家庭成员以确认病史。MN-FH阳性是指两代之内有血缘关系的一位或多位亲属患有恶性肿瘤。
1.2 统计学方法采用SPSS21.0统计软件分析数据。计量资料采用两样本t检验,计数资料组间比较用双侧χ2检验,P < 0.05为差异具有统计学意义。
2 结果 2.1 有无MN-FH的两组患者一般情况对比本研究中共纳入417例患者,有MN-FH者67例(16.1%),其中有乳腺癌家族史者27例,其他恶性肿瘤家族史者40例(肺癌11例、胃癌10例,结直肠癌5例、食管癌3例、肝癌3例、宫颈癌2例、其他6例:鼻咽癌、胰腺癌、卵巢癌、肾癌、膀胱癌、白血病各1例)。无MN-FH者350例(83.9%)。两组患者年龄、绝经状态差异均无统计学意义(均P > 0.05),见表 1。

|
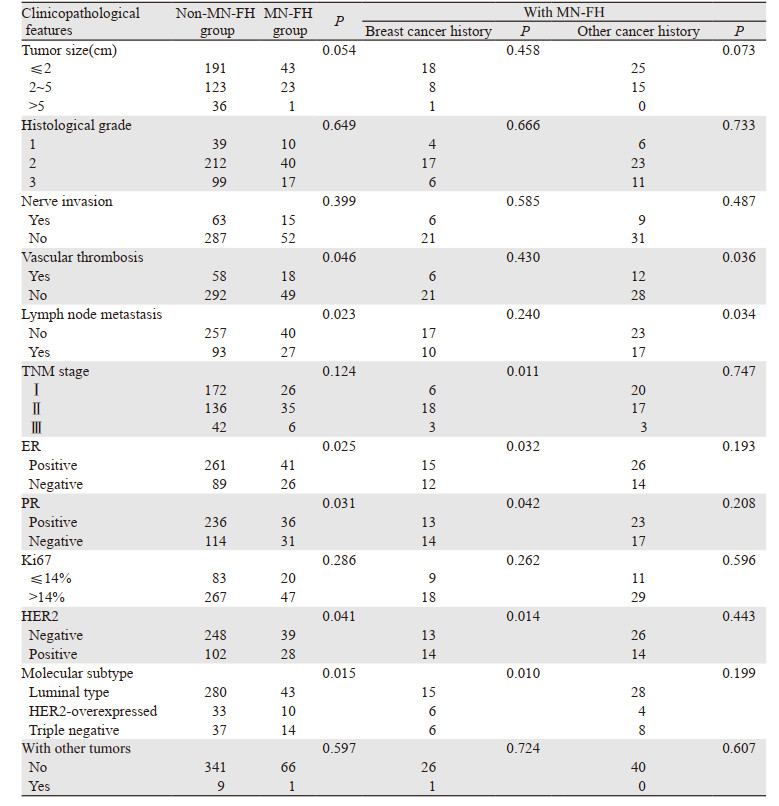
有MN-FH的患者较无MN-FH的患者有更高比例的脉管癌栓(P=0.046)和淋巴结转移(P=0.023),肿瘤更易表现为ER阴性(P=0.025)、PR阴性(P=0.031)和HER2阳性(P=0.041)。两组患者的肿瘤直径、组织学分级、神经侵犯、TNM分期、Ki67、有无合并其他肿瘤等差异均无统计学意义(均P > 0.05)。将MN-FH分为乳腺癌家族史和其他恶性肿瘤家族史,进一步与无MN-FH的患者进行比较。有乳腺癌家族史的患者较无MN-FH的患者有更晚的肿瘤分期(P=0.011)。两组患者分子分型中,进一步采用χ2分割法计算,Luminal型和HER2扩增型、Luminal型和三阴性之间差异有统计学意义(P=0.003),HER2扩增型和三阴性两组之间差异无统计学意义(P > 0.05),有乳腺癌家族史的患者中HER2扩增型和三阴性的比例达44.4%。其他恶性肿瘤家族史的患者较无MN-FH的患者有更高比例的脉管癌栓(P=0.036)和淋巴结转移(P=0.034),而其他病理参数如ER、PR、HER2等差异均无统计学意义(均P > 0.05),见表 2。
|
乳腺癌严重威胁女性生命健康,目前是女性恶性肿瘤的发病首位,女性恶性肿瘤死亡的第二位[1]。早期发现乳腺癌能够延长患者的生存时间,改善患者的生存质量。随着科学技术的不断发展,人们对自身健康的不断重视,定期筛查成为乳腺癌防范的重要一步。肿瘤的发生是内外因素相互作用的结果,具有一定的遗传基础。恶性肿瘤家族史是临床中病史采集的重要部分,传统意义上认为肿瘤家族史一定程度地代表了遗传倾向。既往的多项研究表明,乳腺癌家族史是乳腺癌发病的明确危险因素[2-3]。而除乳腺癌以外的其他恶性肿瘤家族史对乳腺癌的发病及生物学特征的影响目前尚不十分明确。
本研究发现,乳腺癌患者有MN-FH的比例为16.1%,MN-FH相关的肿瘤主要为乳腺癌、肺癌和胃癌。而Chikman等的研究发现,乳腺癌患者中有家族史的比例为23.1%[4]。造成这种差异的原因(如地理环境因素、文化因素等)应在未来的研究中进一步分析讨论。有无MN-FH两组患者的肿瘤直径、组织学分级、神经侵犯、TNM分期、Ki67、有无合并其他肿瘤等方面差异无统计学意义(P > 0.05),无乳腺癌家族史的患者合并其他肿瘤的比例为2.6%。Arpino等[5]回顾性研究也发现有乳腺癌家族史的患者与没有乳腺癌家族史的患者相比,两组肿瘤直径、组织学分级及Ki67差异无统计学意义,有乳腺癌家族史的患者合并其他肿瘤的比例为1%,无乳腺癌家族史的患者合并其他肿瘤的比例为2%,与本研究结果类似。
本研究还发现,有MN-FH的患者有更高比例的脉管癌栓(P=0.046)和淋巴结转移(P=0.023)。脉管癌栓阳性是淋巴结转移的危险因素[6]。既往研究表明,脉管癌栓阳性的患者往往预后更差[7-8]。本研究脉管癌栓的检出率为18.2%,与既往研究报道的9%~50%相符[9]。本研究中,有MN-FH的患者肿瘤更易表现为ER阴性(P=0.025)、PR阴性(P=0.031)和HER2阳性(P=0.041),有乳腺癌家族史的患者中HER2扩增型和三阴性的比例达44.4%,肿瘤更易表现为三阴性和HER2扩增型(P=0.010)。陈晓芬[10]发现家族性乳腺癌与散发性乳腺癌中三阴性乳腺癌的比例分别为22.9%和7.1%,差异有统计学意义。Barnard等研究发现三阴性乳腺癌和乳腺癌家族史有较强的联系[11]。王璟等[12]的Meta分析综合39篇文献结果,也发现乳腺癌家族史或肿瘤家族史都与乳腺癌发病中等相关。
目前明确的家族性乳腺癌发病危险有BRCA基因的突变,邓伟伟等的meta分析发现有BRCA1和BRCA2基因突变的乳腺癌患者总生存低于非携带者[13]。本研究仅仅比较了有无MN-FH两组患者病理特征差异和不同家族史对乳腺癌患者临床病理因素的影响,但造成这种现象的具体原因仍不明确,后续我们将进一步进行探索研究,从分子生物学的层面分析造成这种不同的原因,比如易感基因和(或)抑癌基因突变、基因组拷贝数变异等[14]。同时,我们将继续对这部分患者进行随访,收集这些患者的生存数据,进一步明确MN-FH对乳腺癌患者生存的影响。
总之,本研究结果表明有MN-FH患者更易出现脉管癌栓和淋巴结转移,肿瘤更容易表现为ER阴性、PR阴性或HER2阳性。临床上我们应加重视这类患者的综合治疗和全程管理。对于有恶性肿瘤家族史的人群,也应尽早进行乳腺钼靶的筛查,做到早期诊断、早期治疗。
作者贡献
曹欣华:数据收集、数据分析、论文撰写
韩丽飞:数据收集
吕建鑫:论文修改
胡浩霖、张亚男:论文审阅
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
Collaborative Group on Hormonal Factors in Breast Cancer. Familial breast cancer: collaborative reanalysis of individual data from 52 epidemiological studies including 58, 209 women with breast cancer and 101, 986 women without the disease[J]. Lancet, 2001, 358(9291): 1389-1399. DOI:10.1016/S0140-6736(01)06524-2 |
| [3] |
Yoenny PG, Maikel MG, Diamela AC, et al. Risk Factors for Breast Cancer in the Female Population[J]. Finlay, 2017, 7(4): 283-289. |
| [4] |
Chikman B, Davidson T, Kais H, et al. Is there an association between invasive lobular carcinoma of the breast and a family history of gastric cancer?[J]. Fam Cancer, 2016, 15(4): 41-47. |
| [5] |
Arpino G, Pensabene M, Condello C, et al. Tumor characteristics and prognosis in familial breast cancer[J]. BMC Cancer, 2016, 16(1): 924-932. DOI:10.1186/s12885-016-2962-1 |
| [6] |
Suat B, Cihad T. Predictive factors affecting axillary lymph node metastasis in breast cancer[J]. Haseki Tip Bulteni-Medical Bulletin of Haseki, 2019, 57(4): 356-361. DOI:10.4274/haseki.galenos.2019.4983 |
| [7] |
Zhao Y, Wang X, Huang Y, et al. Conversion of immunohisto-chemical markers conversion and breast density is associated with pathological response and prognosis in very young breast cancer patients who fail to achieve a pathological complete response to neoadjuvant chemotherapy[J]. Cancer Manag Res, 2019, 11: 5677-5690. DOI:10.2147/CMAR.S198844 |
| [8] |
Sobočan M, Turk M, Čater P, et al. Clinical features and their effect on outcomes of patients with triple negative breast cancer with or without lymph node involvement[J]. J Int Med Res, 2019, 11: 300060519887259. |
| [9] |
Gujam FJ, Going JJ, Edwards J, et al. The role of lymphatic and blood vessel invasion in predicting survival and methods of detection in patients with primary operable breast cancer[J]. Crit Rev Oncol Hemat, 2014, 89(2): 231-241. DOI:10.1016/j.critrevonc.2013.08.014 |
| [10] |
陈晓芬.家族性乳腺癌的临床病理特征及BRCA1/2突变的初步探讨[D].广州医科大学, 2018. [Chen XF. The clinicopathologic characteristic and BRCA1/2 mutation in familial breast cancer[D]. Guangzhou Medical University, 2018.]
|
| [11] |
Barnard ME, Boeke CE, Tamimi RM. Established breast cancer risk factors and risk of intrinsic tumor subtypes[J]. Biochim Biophys Acta, 2015, 1856(1): 73-85. |
| [12] |
王璟, 芦文丽, 王媛, 等. 中国女性肿瘤家族史与乳腺癌发病风险关系的meta分析[J]. 中国妇幼保健, 2012, 27(7): 1105-1109. [Wang J, Lu WL, Wang Y, et al. Meta-analysis on the relationship between family history of tumor and the risk of breast cancer among Chinese Women[J]. Zhongguo Fu You Bao Jian, 2012, 27(7): 1105-1109.] |
| [13] |
邓伟伟, 吴军, 霍怡杉, 等. BRCA基因突变对乳腺癌预后影响的meta分析[J]. 国际检验医学杂志, 2019, 40(17): 2058-2065. [Deng WW, Wu J, Huo YS, et al. BRCA gene mutation and its prognostic implication in breast carcinoma:a meta-analysis[J]. Guo Ji Jian Yan Yi Xue Za Zhi, 2019, 40(17): 2058-2065.] |
| [14] |
赵翠翠, 刘红. 年轻乳腺癌的分子生物学发病机制[J]. 肿瘤防治研究, 2020, 47(3): 213-217. [Zhao CC, Liu H. Molecular biological pathogenesis of young breast cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(3): 213-217.] |
 2020, Vol. 47
2020, Vol. 47


