文章信息
- 腹腔热灌注化疗在非根治性阑尾来源低级别腹膜假黏液瘤中的应用价值
- Therapeutic Value of Hyperthermic Intraperitoneal Chemotherapy on Non-radical Appendiceal Low-grade Pseudomyxoma Peritonei
- 肿瘤防治研究, 2020, 47(10): 766-770
- Cancer Research on Prevention and Treatment, 2020, 47(10): 766-770
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.20.0012
- 收稿日期: 2020-01-06
- 修回日期: 2020-05-08
2. 100049 北京,航天中心医院病理科
2. Department of Pathology, Aerospace Center Hospital, Beijing 100049, China
腹膜假黏液瘤(pseudomyxoma peritonei, PMP)是具有分泌黏液功能的肿瘤细胞在腹腔内播散并产生黏液蓄积的罕见临床综合征。依据2016年专家共识,腹腔内只要发现黏液,即可诊断为PMP[1]。PMP最常见的来源为阑尾,约占所有来源90%以上[2-5]。阑尾来源PMP生物学行为表现惰性,少侵袭性生长,自然生存期较长,目前已有研究报道了阑尾来源PMP在接受完全性细胞减灭术(complete cytoreductive surgery, CCRS)联合腹腔热灌注化疗(hyperthermia intraperitoneal chemotherapy, HIPEC)治疗后,10年生存率高达70%[6-7],但对于失去根治性手术机会的患者,接受细胞减灭术(cytoreductive surgery, CRS)以及HIPEC治疗能否获益存在较大争议。
本研究主要通过回顾单中心无法达到根治的阑尾来源低级别PMP患者的临床资料,分析预后影响因素及HIPEC在该部分患者中的治疗价值,旨在为非根治性阑尾来源低级别PMP的治疗提供循证医学证据。
1 资料与方法 1.1 病例资料2008年1月—2019年1月在航天中心医院黏液瘤科接受治疗符合入组条件的非根治性阑尾来源低级别PMP患者300例,其中男125例,女175例,男女比例为1:1.4,平均年龄50岁。排除标准:(1)来源不明或非阑尾来源; (2)病理级别等重要资料缺失; (3)高级别PMP或伴印戒; (4)接受根治性手术治疗。病理分类以2016年PSOGI专家共识为标准,将PMP分为低级别、高级别、高级别伴印戒[1],对于2016年以前未采用该分类标准的病例由病理科专家重新读片按现行标准进行分类。本研究经航天中心医院伦理审查委员会批准,所有患者均知情同意。
1.2 病情评估检测方法所有患者入院后均完善血、尿、便常规,生化、凝血及传染病检查,进行血(腹水)肿瘤标志物检查(CA19-9、CA125、CEA); 常规行腹盆腔增强CT及胃、肠镜,心彩、下肢血管彩超等影像检查,CT检查前口服胃肠显影剂。
1.3 手术方式手术取腹正中切口,上至剑突,下至耻骨联合。进腹充分探查腹腔,评估腹膜肿瘤指数(peritoneal cancer index, PCI)。评价标准按Sugarbaker教授所述[8],将腹盆腔及小肠分为13个区,每区按肿瘤最大直径记0~3分,其中:0分:无肉眼可见肿瘤; 1分:肿瘤直径≤5 mm; 2分:5 mm < 肿瘤直径≤5 cm; 3分:肿瘤直径 > 5 cm; 总分最高为39分。
评估PCI后,采用Sugarbaker教授的CRS流程[9],通过腹膜联合脏器切除手术技巧,尽可能切除所有肉眼可见的肿瘤组织。对于胃周围或小肠表面受累严重无法切除的,以解决影响患者生活质量问题为导向,在保证安全的情况下适当减瘤,而不能一味追求完全减瘤导致过度损伤。CRS结束后再次对腹腔内残余肿瘤负荷(术后PCI)及细胞减灭程度(completeness of cytoreduction, CC)进行评价。CC评价标准[8]如下:CC-0:无肉眼可见残余肿瘤; CC-1:残余肿瘤直径 < 2.5 mm; CC-2:2.5 mm < 残余肿瘤直径 < 2.5 cm; CC-3:残余肿瘤直径 > 2.5 cm。其中CC-0/1定义为完全性细胞减灭术,为根治性手术; CC-2/3定义为最大限度减瘤术(maximal tumor debulking surgery, MTDS)。
1.4 腹腔热灌注化疗完成CRS后,消化道重建之前进行术中封闭式HIPEC,在盆腔和双侧上腹部留置乳胶引流管,7号丝线连续缝合皮肤并固定乳胶引流管,药物选用丝列霉素(Mitomycin, MMC)30 mg,顺铂(Cisplatin, DDP)60~80 mg,用0.9%氯化钠注射液。灌注循环速度控制在800~1000 ml/min,入体管路探头温度为43.5℃,出体温度控制在41℃左右,持续时间为60~90 min。术后视患者恢复情况自第2天起在病房内连续行1~5次腹腔热灌注化疗,用药物为5-Fu 1 g,余同术中。
1.5 术后随访及资料搜集患者术后间隔3~6月进行复查,包括腹盆腔增强CT及肿瘤标志物。随访时间为手术日期至2019年4月30日,统计患者总生存率(overall survival, OS)。随访截止后对围手术期数据及随访结果进行统计收集。并发症情况以Clavien-Dindo术后并发症评级系统为标准[10]。
1.6 统计学方法SPSS25.0统计学软件对数据进行分析,计量资料采用t检验和秩和检验,计数资料采用卡方检验,分类变量相关线性分析采用Logistics回归检验分析; Kaplan-Meier方法计算总生存,生存比较采用Log rank检验,预后多因素分析采用Cox比例风险模型。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料本研究中接受非根治手术治疗的阑尾来源低级别PMP患者共300例,平均手术时间为480 min(90~780 min),平均住院天数为31天(10~753天),见表 1。237例接受术中HIPEC治疗,150例接受术后HIPEC治疗,见表 2。结果显示,接受HIPEC治疗的患者整体肿瘤负荷相对更低,但性别、年龄以及并发症发生未见明显差异。全组整体主要并发症发生率为21%,围手术期死亡率为1%。
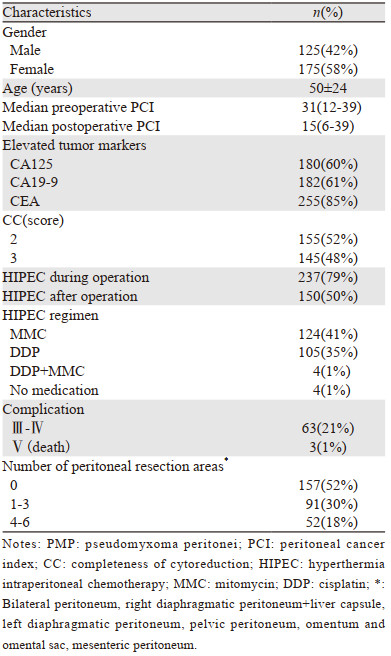
|
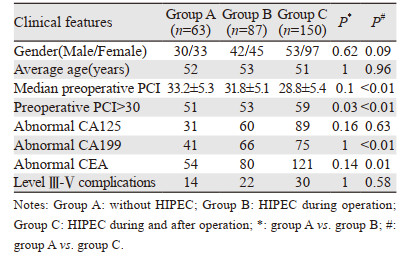
|
中位随访时间34月(3~128月),随访期间86例患者死亡,总体3、5和10年生存率分别为70%、52%和44%,见图 1A。接受术中HIPEC治疗的患者5、10年生存率显著高于未接受术中HIPEC治疗患者(5y-OS: 55% vs. 41%, 10y-OS: 52% vs. 26%, P < 0.001),见图 1B。接受术后HIPEC治疗的患者5、10年生存率亦显著优于未接受术后HIPEC治疗的患者(5y-OS: 60% vs. 43%、10y-OS: 56% vs. 34%, P < 0.001),见图 1C。同时接受术中及术后HIPEC治疗的患者5、10年生存率显著高于单纯接受术中HIPEC治疗的患者(5y-OS: 60% vs. 44%; 10y-OS: 57% vs. 44%, P=0.004),见图 1D。
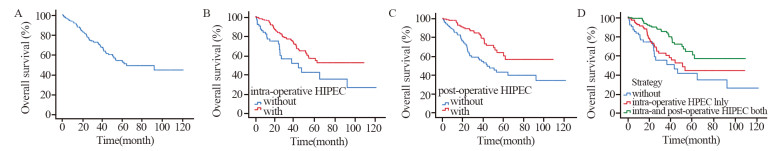
|
| A: overall survival curve of 300 non-radical appendiceal low-grade PMP patients; B: with vs. without HIPCE during operation; C: with vs. without HIPCE after operation; D: with different HIPEC regimens. 图 1 非根治性阑尾来源低级别PMP患者生存曲线 Figure 1 Survival curves of non-radical appendiceal low-grade PMP patients |
相关因素分析结果显示,根治程度(CC-2 vs. CC-3: 55% vs. 35%, P=0.003)、减瘤前肿瘤高负荷(术前PCI > 30 vs. ≤30: 39% vs. 50%, P=0.002)、减瘤后肿瘤高负荷(术后PCI > 30 vs. ≤30: 32% vs. 45%, P < 0.001)和CA19-9异常(正常vs.异常: 57% vs. 41%, P=0.003)为影响总生存的危险因素,而CA125异常(P=0.051)、CEA异常(P=0.104)、是否腹膜切除(P=0.130)、性别(P=0.809)和灌注药物选择(P=0.628)无显著相关性。对显著水平在0.1以内的相关因素纳入Cox回归分析,结果显示仅术中HIPEC和CA125为影响预后的独立危险因素,见表 3。
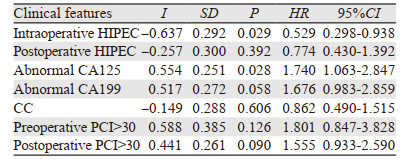
|
基于既往回顾性研究结果,单纯接受CRS治疗的PMP患者复发率高达91%[11]。CCRS+HIPEC综合治疗策略的出现改善了PMP患者的远期预后,成为公认的PMP标准治疗手段,但由于PMP患者病情的特殊性以及个体差异,仍有部分患者无法达到临床根治切除,主要原因是小肠广泛受累,可保留的小肠长度不满足术后正常生理营养需要或肝门结构受侵无法完全切除肿瘤,约占整体比例的10%~33%[12-15],对于该部分患者,临床上多数仅实施姑息性的手术,部分中心联合腹腔热灌注化疗以控制浆液性腹水改善患者临床症状并延长患者生存周期[12]。
Glehen等[16]对非根治性切除的PMP预后进行了报道,174例姑息减瘤的PMP患者中位随访时间为20.5月,5年生存率为15%,但并未对减瘤程度进行详细分级,结果显示反复手术切除以及腹腔热灌注化疗可能提高该部分患者的远期生存,而病理提示高级别或伴印戒细胞、淋巴结转移是显著影响预后的危险因素。Dayal等[17]对205例接受MTDS治疗的患者进行长期随访结果显示3、5和10年生存率分别为47%、30%和22%,其手术切除范围主要为右半结肠、大网膜以及盆腔腹膜,他们认为,即使对于无法根治切除的PMP患者,手术治疗仍可获得良好的远期预后,而高病理级别则提示预后不良,因此提出,对于无法根治切除的患者多采取“watch and wait”策略,在临床症状明显时再进行最终干预处理。Delhorme等[18-19]则认为,通过激进的手术尽可能减瘤,切除80%以上的肿瘤可以延长术后患者临床症状进展时间、提高生活质量、延长总生存期; 其手术切除脏器范围包括远端胃、部分结肠或全结肠、部分小肠以及大网膜,而对于膈肌腹膜、Glisson囊、直肠以及小肠上 < 1 cm残余肿瘤则不进行处理,同时也提出尽量避免对该部分患者进行肠造瘘,因为造瘘往往是永久性的,随着病情进展失去还纳机会。
PMP对静脉化疗不敏感且免疫治疗及靶向治疗缺少相关基因位点,因此,明确HIPEC治疗在无法得到根治切除的PMP患者的临床治疗价值意义重大。目前研究表明,腹腔灌注化疗(常用药物为顺铂、5-Fu、MMC等)过程中,化疗药物渗透深度仅为1~2 mm[20],虽然通过热的协同增敏作用可以加深化疗药渗透深度,但仍不足以覆盖到MTDS治疗后的残余肿瘤,似乎HIPEC并不适用于接受非根治手术治疗的患者。但既往小样本量的回顾性研究结果指出,HIPEC仍能使该部分患者获得生存收益[16, 19]。由此可知,对于无法接受CCRS治疗的PMP患者,临床治疗意见不一,但均提示高级别病理是预后不良的危险因素。那么,对于低级别PMP而言,因本身疾病进展缓慢,对于无法根治切除的患者,手术及HIPEC治疗的临床价值难以得到临床证实,不全的减瘤手术尤其是HIPEC治疗能否延长生存期目前尚无相关文献报道。
本研究入组患者均接受不同程度的减瘤手术或联合HIPEC治疗,总体围手术期Ⅲ~Ⅳ级并发症发生率为21%,围手术期死亡率为1%。关于CRS+HIPEC治疗PMP的国际最大样本量研究报道主要并发症发生率为24%,围手术期死亡率为2%[6];国内其他机构254例PMP研究报道,Ⅲ~Ⅳ并发症发生率32.7%,Ⅴ级并发症发生率1.5%[21]。本研究与既往研究基本相当,治疗策略安全性可以得到保证,中位随访34月,总体10年生存率为44%,接受HIPEC治疗的患者10年生存率显著优于未接受HIPEC治疗的患者(P < 0.001),且同时接受术中及术后HIPEC治疗的患者远期生存更优(P=0.004)。从手术根治程度而言,CC-2的10年生存显著优于CC-3的患者(P=0.003);从减瘤后肿瘤负荷而言,减瘤后PCI < 30的患者亦能获得更佳的远期生存率(P=0.002),但该显著性在多因素分析中消失,仅接受术中HIPEC治疗和血清CA125水平为影响非根治性阑尾来源低级别PMP远期生存的独立危险因素。似乎非根治性手术对PMP生存影响不大,生存预后和疾病本身进程相关,手术可能改善生活质量[22-24],但无法延长患者远期生存。有研究[12, 17]试图证实减瘤术在无法根治的PMP中的应用价值,但缺少临床对照且样本量较小,其临床意义仍不甚明确,本研究结果亦未能证实。既往尚无文献评价HIPEC在非根治性PMP的临床价值,但从本研究随访结果可以看出,对于无法接受CCRS治疗的低级别阑尾源性PMP患者而言,HIPEC可显著改善其远期生存,且为独立危险因素,远期死亡风险降低47%。
虽然对无法得到根治切除的低级别阑尾源性PMP而言,本研究结果显示HIPEC可以带来明显生存优势,但仍不建议未经任何减瘤手术即进行HIPEC操作。对于该部分PMP患者而言,腹腔内肿瘤负荷偏大(中位PCI=31),且均伴有大量黏液状腹水,部分患者因肿瘤压迫产生不全性肠梗阻表现,手术治疗可明显改善该部分患者生活质量,且能为HIPEC治疗提供循环空间,在手术松解粘连后腹腔内肿瘤可充分暴露获得灌注时最大接触面积,提高灌注效率,可能是改善预后的原因之一。如果在其他有经验的诊疗中心手术探查后认为无法达到完全减瘤的患者,本中心亦不推荐进行过大范围的减瘤,而应以患者最主要症状为治疗方向,在解决临床症状的同时,保证手术安全的前提下适当减瘤,手术切除范围可包括全部大网膜、右半结肠及盆腔腹膜或联合部分直肠切除,女性患者建议同时切除子宫+双侧附件,上述操作的主要目的为降低后期发生梗阻的风险。
作为回顾性研究,本研究仍存在较大局限性,首先,术后HIPEC并非国际公认的标准治疗手段,虽然国内应用相对较多,但方式各异且尚无高质量研究证实其治疗价值。在本中心接受术后HIPEC治疗的灌注方式同术中,灌注前给予适当止疼药物,均耐受良好可顺利完成灌注治疗(部分因管路循环不畅而终止治疗),但生活质量评价等数据缺失是本研究较大不足,且在多因素分析中术后HIPEC未能体现出独立的治疗价值。其次,部分资料例如生活质量评分(QOL)、PSS、术前静脉化疗情况等数据缺失,以及无可避免的在治疗选择上产生部分偏倚,可能对最终研究结果产生一定的影响。本研究样本量大,且所有患者均定期复查,最大限度地避免了失访偏倚,结论尚期待更高质量的前瞻性研究证实。
综上,对于无法达到根治的低级别阑尾源性PMP患者,术中HIPEC可显著改善远期预后,术后HIPEC治疗可能有益于延长生存期,可在有治疗经验的中心开展。但本研究仅限于单中心的回顾性分析,存在一定的选择偏倚,HIPEC远期综合价值仍需要进行更深入的研究及多中心、大样本研究来探索和证实。
作者贡献
史冠军:收集资料、数据分析、论文撰写
夏奥:统计分析及论文修改
安鲁彪、翟喜超、马瑞卿:数据整理、论文修改
卢一艳、庞少军、蔡莺、王冰、陈峰:病例数据收集
许洪斌:论文终审
| [1] |
Carr NJ, Cecil TD, Mohamed F, et al. A Consensus for Classification and Pathologic Reporting of Pseudomyxoma Peritonei and Associated Appendiceal Neoplasia: The Results of the Peritoneal Surface Oncology Group International (PSOGI) Modified Delphi Process[J]. Am J Surg Pathol, 2016, 40(1): 14-26. DOI:10.1097/PAS.0000000000000535 |
| [2] |
Baratti D, Kusamura S, Milione M, et al. Pseudomyxoma Peritonei of Extra-Appendiceal Origin: A Comparative Study[J]. Ann Surg Oncol, 2016, 23(13): 4222-4230. DOI:10.1245/s10434-016-5350-9 |
| [3] |
Rizvi SA, Syed W, Shergill R. Approach to pseudomyxoma peritonei[J]. World J Gastrointest Surg, 2018, 10(5): 49-56. DOI:10.4240/wjgs.v10.i5.49 |
| [4] |
Sinukumar S, Mehta S, As R, et al. Analysis of clinical outcomes of pseudomyxoma peritonei from appendicular origin following cytoreductive surgery and hyperthermic intraperitoneal chemotherapy-a retrospective study from INDEPSO[J]. Indian J Surg Oncol, 2019, 10(Suppl 1): 65-70. |
| [5] |
Morera-Ocon FJ, Navarro-Campoy C. History of pseudomyxoma peritonei from its origin to the first decades of the twenty-first century[J]. World J Gastrointest Surg, 2019, 11(9): 358-364. DOI:10.4240/wjgs.v11.i9.358 |
| [6] |
Chua TC, Moran BJ, Sugarbaker PH, et al. Early- and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy[J]. J Clin Oncol, 2012, 30(20): 2449-2456. DOI:10.1200/JCO.2011.39.7166 |
| [7] |
Youssef H, Newman C, Chandrakumaran K, et al. Operative findings, early complications, and long-term survival in 456 patients with pseudomyxoma peritonei syndrome of appendiceal origin[J]. Dis Colon Rectum, 2011, 54(3): 293-299. DOI:10.1007/DCR.0b013e318202f026 |
| [8] |
Sugarbaker PH. Peritoneal Metastases, a Frontier for Progress[J]. Surg Oncol Clin N Am, 2018, 27(3): 413-424. DOI:10.1016/j.soc.2018.02.001 |
| [9] |
Sugarbaker PH. Prevention and Treatment of Peritoneal Metastases: a Comprehensive Review[J]. Indian J Surg Oncol, 2019, 10(1): 3-23. DOI:10.1007/s13193-018-0856-1 |
| [10] |
Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey[J]. Ann Surg, 2004, 240(2): 205-213. DOI:10.1097/01.sla.0000133083.54934.ae |
| [11] |
Miner TJ, Shia J, Jaques DP, et al. Long-term survival following treatment of pseudomyxoma peritonei: an analysis of surgical therapy[J]. Ann Surg, 2005, 241(2): 300-308. DOI:10.1097/01.sla.0000152015.76731.1f |
| [12] |
Ansari N, Chandrakumaran K, Dayal S, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in 1000 patients with perforated appendiceal epithelial tumours[J]. Eur J Surg Oncol, 2016, 42(7): 1035-1041. DOI:10.1016/j.ejso.2016.03.017 |
| [13] |
Benhaim L, Faron M, Gelli M, et al. Survival after complete cytoreductive surgery and HIPEC for extensive pseudomyxoma peritonei[J]. Surg Oncol, 2019, 29: 78-83. DOI:10.1016/j.suronc.2019.03.004 |
| [14] |
Fish R, Renehan AG, Punnett G, et al. Referral and treatment pathways for pseudomyxoma peritonei of appendiceal origin within a national treatment programme[J]. Colorectal Dis, 2018, 20(10): 888-896. DOI:10.1111/codi.14310 |
| [15] |
Narasimhan V, Wilson K, Britto M, et al. Outcomes Following Cytoreduction and HIPEC for Pseudomyxoma Peritonei: 10-Year Experience[J]. J Gastrointest Surg, 2019.[Epub ahead of print]
|
| [16] |
Glehen O, Mohamed F, Sugarbaker PH. Incomplete cytoreduction in 174 patients with peritoneal carcinomatosis from appendiceal malignancy[J]. Ann Surg, 2004, 240(2): 278-285. DOI:10.1097/01.sla.0000133183.15705.71 |
| [17] |
Dayal S, Taflampas P, Riss S, et al. Complete cytoreduction for pseudomyxoma peritonei is optimal but maximal tumor debulking may be beneficial in patients in whom complete tumor removal cannot be achieved[J]. Dis Colon Rectum, 2013, 56(12): 1366-1372. DOI:10.1097/DCR.0b013e3182a62b0d |
| [18] |
Delhorme JB, Elias D, Varatharajah S, et al. Can a Benefit be Expected from Surgical Debulking of Unresectable Pseudomyxoma Peritonei?[J]. Ann Surg Oncol, 2016, 23(5): 1618-1624. DOI:10.1245/s10434-015-5019-9 |
| [19] |
Järvinen P, Ristimäki A, Kantonen J, et al. Comparison of serial debulking and cytoreductive surgery with hyperthermic intraperitoneal chemotherapy in pseudomyxoma peritonei of appendiceal origin[J]. Int J Colorectal Dis, 2014, 29(8): 999-1007. DOI:10.1007/s00384-014-1933-8 |
| [20] |
Hasovits C, Clarke S. Pharmacokinetics and pharmacodynamics of intraperitoneal cancer chemotherapeutics[J]. Clin Pharmacokinet, 2012, 51(4): 203-224. DOI:10.2165/11598890-000000000-00000 |
| [21] |
Li XB, Ma R, Ji ZH, et al. Perioperative safety after cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy for pseudomyxoma peritonei from appendiceal origin: Experience on 254 patients from a single center[J]. Eur J Surg Oncol, 2020, 46(4 Pt A): 600-606. |
| [22] |
Alves S, Mohamed F, Yadegarfar G, et al. Prospective longitudinal study of quality of life following cytoreductive surgery and intraperitoneal chemotherapy for pseudomyxoma peritonei[J]. Eur J Surg Oncol, 2010, 36(12): 1156-1161. DOI:10.1016/j.ejso.2010.09.004 |
| [23] |
Stearns AT, Malcomson L, Punnett G, et al. Long-term Quality of Life After Cytoreductive Surgery and Heated Intraperitoneal Chemotherapy for Pseudomyxoma Peritonei: A Prospective Longitudinal Study[J]. Ann Surg Oncol, 2018, 25(4): 965-973. DOI:10.1245/s10434-017-6326-0 |
| [24] |
Funder JA, Jepsen KV, Stribolt K, et al. Palliative Surgery for Pseudomyxoma Peritonei[J]. Scand J Surg, 2016, 105(2): 84-89. DOI:10.1177/1457496915598759 |
 2020, Vol. 47
2020, Vol. 47


