文章信息
- 术前纤维蛋白原联合血小板与淋巴细胞比值对膀胱癌根治术后患者的预后预测价值
- Prognostive Value of Preoperative Fibrinogen Combined with Platelet-lymphocyte Ratio on Prognosis of Patients Undergoing Radical Cystectomy
- 肿瘤防治研究, 2020, 47(11): 834-838
- Cancer Research on Prevention and Treatment, 2020, 47(11): 834-838
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1631
- 收稿日期: 2020-03-21
- 修回日期: 2020-08-17
膀胱癌是一种异质性疾病,其最佳治疗以准确的分期为指导,然而临床分期往往不准确。既往研究表明,膀胱肿瘤电切不能准确识别所有肌层浸润患者[1],而膀胱肿瘤根治患者的临床分期往往上移[2]。因此,确定新的风险因素对于早期识别高危患者,并给予更积极的辅助治疗及密切的随访监测至关重要[3]。
研究表明,肿瘤患者机体处于高凝状态,凝血物质增多。纤维蛋白原(fibrinogen, FIB)可促进肿瘤新生血管形成和支持肿瘤细胞的持续黏附[4]。此外,全身炎性反应与免疫应答通过肿瘤微环境参与肿瘤的发生发展[5],血小板与淋巴细胞比值(platelet-lymphocyte ratio, PLR)与胃癌、结直肠癌、宫颈癌和鼻咽癌等肿瘤的不良预后相关[6-9]。然而,术前纤维蛋白原、血小板与淋巴细胞比值对膀胱癌预后意义的研究甚少。
本研究旨在将术前纤维蛋白原和血小板与淋巴细胞计数比值纳入组合评分的评分中,然后研究组合评分与膀胱癌根治术后患者临床资料及病理特征的关系,探讨组合评分对膀胱癌患者预后的预测价值。
1 资料与方法 1.1 研究对象选取2011年1月至2015年12月间就诊于兰州大学第二医院泌尿外科进行根治性膀胱全切并且组织病理学证实为尿路上皮癌的膀胱癌患者病历资料,利用回顾性队列研究的方法,除外临床病理信息不全或失访的患者,最终纳入141例患者。排除标准:(1)共存上尿路肿瘤或任何其他恶性肿瘤;(2)合并严重心肾肺等器官疾病者, 如器官衰竭等; (3)合并血栓性疾病及凝血功能疾病;(4)入院前短期内使用激素或应用抗凝、止血药物;(5)术前明确感染。
1.2 研究方法对入选的141例膀胱癌根治术后患者入院时的基本临床资料进行回顾性分析。分析患者术前的FIB血清浓度及PLR,应用ROC曲线将约登指数的最大值作为cut-off值。将纤维蛋白原、PLR小于等于临界值作为低水平组,高于临界值作为高水平组。将一种指标为高水平组或二种指标均为高水平组定义为组合评分1(S1),二者均为低水平定义为组合评分0(S0)。随访截止时间为2018年12月,随访内容包括肾功能、泌尿系B型超声或CT,研究的主要研究终点为总生存期(overall survival, OS)。总生存期定义为从手术之日至随访终止日期或患者死亡日期。通过分析膀胱癌根治术后患者的病理特征及临床资料,比较不同水平的FIB、PLR及其组合评分的总生存期状况,从而确定组合评分对膀胱癌根治术后患者预后的评估价值。
1.3 统计学方法采用SPSS24.0统计软件对采集的数据进行统计学分析。使用ROC曲线确定术前FIB、PLR最佳临界值。计数资料组间比较采用χ2检验。非参数检验(Mann Whitney U和Kruskal-Wallis H)分析组间的差异。单因素生存分析采用Kaplan-Meier法,组间比较采用Log rank检验。选择在单因素分析中有意义的因素纳入Cox回归模型中行多因素生存分析。P < 0.05为差异有统计学意义。
2 结果 2.1 不同水平FIB和PLR的膀胱癌根治性切除患者临床资料对比共纳入141例患者,男性121例、女性20例,男女比例6:1。60岁及以下55例(39%)、60岁以上86例(61%),诊断时平均年龄62.3岁(37~84岁)。通过ROC曲线分析结果提示,纤维蛋白原最佳临界值3.43,PLR最佳临界值110.54。其中高纤维蛋白原水平患者50例(35.5%);高PLR水平患者87例(61.7%)。死亡患者48例,其中S1组患者37例、S0组患者11例,二者OS差异有统计学意义(P=0.001),见图 1。
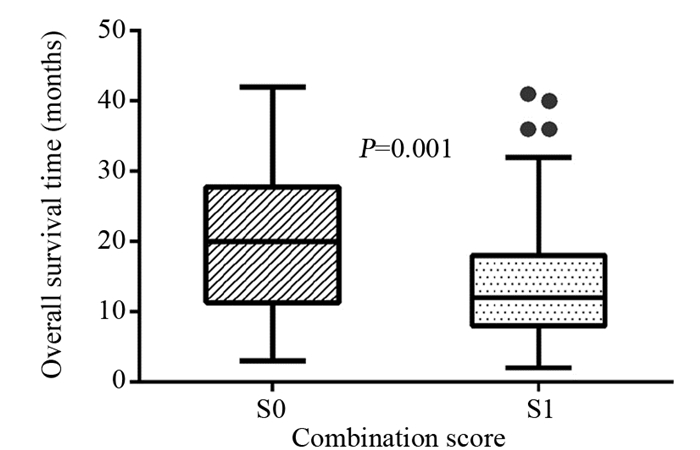
|
| 图 1 H检验S0组与S1组总生存时间的差异 Figure 1 H test for difference of overall survival between S0 group and S1 group |
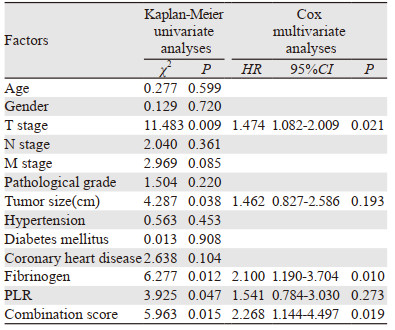
不同水平的纤维蛋白原和PLR患者的临床病理特征见表 1。纤维蛋白原水平在肿瘤T分期(P=0.035)、病理分级(P=0.032)、肿瘤大小(P=0.008)中差异有统计学意义。PLR水平在病理分级(P=0.016)、肿瘤大小(P=0.029)中差异有统计学意义。不同水平的纤维蛋白原和PLR与性别、年龄、N分期、M分期、既往史(高血压、糖尿病和冠心病)无显著相关性(P > 0.05)。
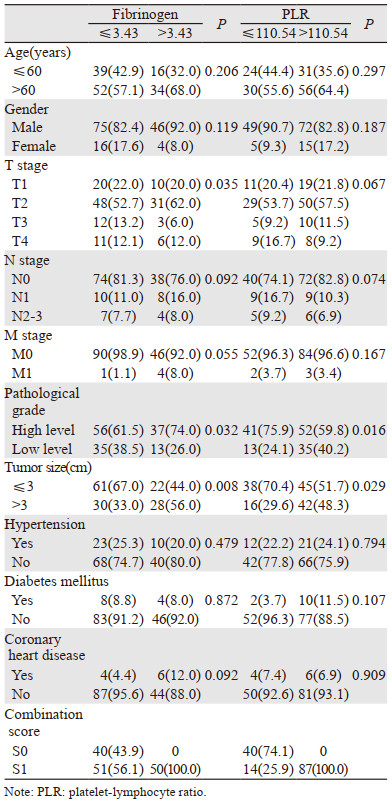
|
根据组合评分定义,141例患者分为两组:S0组40例、S1组101例。术前组合评分与T分期(P=0.041)、N分期(P=0.047)、病理分级(P =0.039)、肿瘤大小(P=0.005)密切相关,而与性别、年龄、M分期、高血压、糖尿病、冠心病无显著相关性(P > 0.05),见表 2。
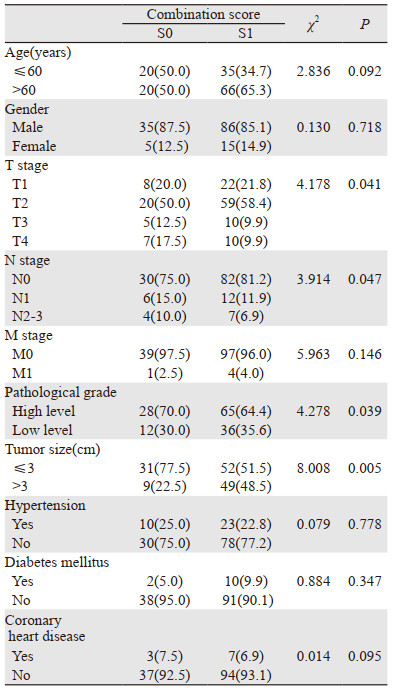
|
单因素分析结果表明,组合评分(χ2=5.963, P=0.015)、纤维蛋白原水平(χ2=6.277, P=0.012)、PLR(χ2=3.925, P=0.047)、T分期(χ2=11.483, P=0.009)、肿瘤大小(χ2=4.287, P=0.031)是影响膀胱癌根治术后患者预后的危险因素;而年龄、性别、N分期、M分期、病理分级、高血压、糖尿病、冠心病与患者预后无显著相关性(P > 0.05),见图 2、表 3。
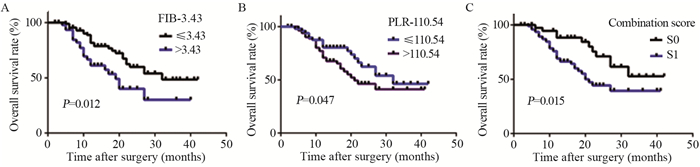
|
| 图 2 术前不同纤维蛋白原水平(A)、PLR水平(B)及组合评分(C)对膀胱癌根治术患者Kaplan-Meier生存率的影响 Figure 2 Kaplan-Meier survival rate of patients undergoing radical cystectomy with different preoperative fibrinogen levels(A), PLR levels(B) and combination scores(C) |
|
排除相关变量后,将单因素分析中具有统计学意义的因素:T分期、肿瘤大小、纤维蛋白原水平、PLR及组合评分纳入Cox比例风险模型进行多因素分析。分析结果显示,T分期(P=0.021)、纤维蛋白原水平(P=0.010)及组合评分(P=0.019)是影响患者预后的独立危险因素,见表 3。
3 讨论目前膀胱癌患者预后风险评估仍依赖于传统的临床病理学预后因素,包括肿瘤分期、肿瘤分级、肿瘤转移、核基质蛋白22(NMP22)等[10]。尽管这些因素能在一定程度上反映膀胱癌患者的预后,但由于膀胱癌患者的复发率和死亡率很高,因此需要研究寻找更多合适的生物标志物用于早期发现高危患者。本研究将术前纤维蛋白原和PLR联合构建新的组合评分,探讨组合评分与临床病理特征及预后的关系。
本研究发现,术前FIB与膀胱癌的T分期、病理分级以及肿瘤大小具有相关性。有研究报道,FIB水平与较高的肿瘤分期与分级有关[11]。此外,本研究结果显示术前FIB升高与患者的不良预后显著相关,并且FIB是膀胱癌根治患者预后的独立危险因素。一项上尿路上皮癌患者的回顾性研究表明,高FIB患者的5年生存率明显低于低FIB组[4]。也有研究显示,较高水平的FIB预后差可能基于FIB与肿瘤相互作用的生物学机制。FIB通过促进肿瘤新生血管的形成和支持肿瘤细胞的持续黏附而促进肿瘤的侵袭迁移[12-14]。以上研究结果表明,纤维蛋白原在膀胱癌的发生、发展中扮演着重要的角色,高水平的FIB可以促进肿瘤进展。
本研究发现,PLR与肿瘤大小及病理分级具有相关性,单因素分析显示PLR升高与膀胱癌患者的不良预后相关,这与PLR作为公认的系统炎性反应指标,与多种肿瘤患者的预后相关一致[15-18]。淋巴细胞在肿瘤机体的免疫监视中具有重要作用,能够抑制肿瘤细胞的生长繁殖和新陈代谢[19]。PLR增高反映了淋巴细胞的相对减少,导致免疫细胞的抗肿瘤免疫反应相对减弱,从而促进肿瘤的进展,这可能是患者预后较差的原因[20-21]。血液高凝状态可以直接或间接影响肿瘤细胞的增殖、侵袭和转移,血小板介导的炎性反应能促进肿瘤细胞的生长分化、侵袭、转移和血管的生成[22-23]。血小板的升高可引起多种生长因子(如血小板源生长因子、血管内皮生长因子)和炎性反应介质的合成,从而促进肿瘤进展[24]。PLR通过炎性反应免疫介导促进肿瘤的进展,这与本研究高PLR水平的膀胱癌患者预后较差一致。然而,在多变量分析中,PLR不是膀胱癌患者的独立预后因素。
本研究用FIB联合PLR来预测膀胱癌根治术患者的预后,这在国内外尚未报道。研究结果表明,组合评分与T分期、N分期、病理分级、肿瘤大小密切相关,说明组合评分与肿瘤的恶性程度相关,参与了肿瘤的进展。同时,单因素生存分析显示,组合评分与膀胱癌患者的预后显著相关,多因素分析结果表明组合评分是膀胱癌患者OS的独立预测因子。因此,组合评分可作为预测膀胱癌患者生存和进展的新指标,这可为早期识别膀胱癌高危患者及预测临床预后提供方便又快捷的检测方法。
本研究结果表明,组合评分是导致膀胱癌患者预后较差的独立危险因素,其也作为对临床TNM分期、肿瘤分级、血尿标志物的一个有益补充,可有效评估膀胱癌患者预后进展的风险。但作为一项回顾性研究,本研究为单中心研究,样本量相对较小,而膀胱肿瘤的危险因素比较混杂,且由于影响FIB和PLR水平变化的因素较多,因此需要大样本、多中心的研究来进一步证实。
作者贡献
姚志强:课题设计、数据收集与整理、论文撰写
张向向、陈朝虎:数据收集与整理
曹金龙:统计学分析指导
汉大黎、李攀:数据收集
董治春:论文修订
田俊强:论文指导
| [1] |
Dutta SC, Smith Jr JA, Shappell SB, et al. Clinical under staging of high risk nonmuscle invasive urothelial carcinoma treated with radical cystectomy[J]. J Urol, 2001, 166(2): 490-493. DOI:10.1016/S0022-5347(05)65969-1 |
| [2] |
Ark JT, Keegan KA, Barocas DA, et al. Incidence and predictors of understaging in patients with clinical T1 urothelial carcinoma undergoing radical cystectomy[J]. BJU Int, 2014, 113(6): 894-899. DOI:10.1111/bju.12245 |
| [3] |
Huang J, Yuan Y, Wang Y, et al. Prognostic value of preoperative plasma fibrinogen level and platelet-to-lymphocyte ratio (F-PLR) in patients with localized upper tract urothelial carcinoma[J]. Oncotarget, 2017, 8(22): 36761-36771. DOI:10.18632/oncotarget.13611 |
| [4] |
Tanaka N, Kikuchi E, Matsumoto K, et al. Prognostic value of plasma fibrinogen levels in patients with localized upper tract urothelial carcinoma[J]. BJU Int, 2013, 111(6): 857-864. DOI:10.1111/j.1464-410X.2012.11353.x |
| [5] |
Shinko D, Diakos CI, Clarke SJ, et al. Cancer-Related Systemic Inflammation: The Challenges and Therapeutic Opportunities for Personalized Medicine[J]. Clin Pharmacol Ther, 2017, 102(4): 599-610. DOI:10.1002/cpt.789 |
| [6] |
Lalosevic MS, Markovic PA, Stankovic S, et al. Combined Diagnostic Efficacy of Neutrophil-to-Lymphocyte Ratio (NLR), Platelet-to-Lymphocyte Ratio (PLR), and Mean Platelet Volume (MPV) as Biomarkers of Systemic Inflammation in the Diagnosis of Colorectal Cancer[J]. Dis Markers, 2019, 2019: 6036979. |
| [7] |
Wu Y, Jiang M, Qin Y, et al. Single and combined use of neutrophil-lymphocyte ratio, platelet-lymphocyte ratio and carcinoembryonic antigen in diagnosing gastric cancer[J]. Clin Chim Acta, 2018, 481: 20-24. DOI:10.1016/j.cca.2018.02.027 |
| [8] |
Ma JY, Ke LC, Liu Q. The pretreatment platelet-to-lymphocyte ratio predicts clinical outcomes in patients with cervical cancer: A meta-analysis[J]. Med, 2018, 97(43): e12897. DOI:10.1097/MD.0000000000012897 |
| [9] |
唐红, 吴伟莉, 金凤, 等. 外周血中性粒细胞及血小板与淋巴细胞的比值与局部晚期鼻咽癌预后及疗效的相关性[J]. 肿瘤防治研究, 2019, 46(1): 32-36. [Tang H, Wu WL, Jin F, et al. Relationship of peripheral blood neutrophil/lymphocyte ration and platelet/lymphocyte ration with curative effect and prognosis of patients with locally advanced nasopharyneal carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(1): 32-36.] |
| [10] |
Kluth LA, Black PC, Bochner BH, et al. Prognostic and Prediction Tools in Bladder Cancer: A Comprehensive Review of the Literature[J]. Eur Urol, 2015, 68(2): 238-253. DOI:10.1016/j.eururo.2015.01.032 |
| [11] |
Alevizopoulos A, Tyritzis S, Leotsakos I, et al. Role of coagulation factors in urological malignancy: A prospective, controlled study on prostate, renal and bladder cancer[J]. Int J Urol, 2017, 24(2): 130-136. DOI:10.1111/iju.13271 |
| [12] |
Liu J, Li D, Cao L, et al. Elevated preoperative plasma fibrinogen level is an independent predictor of malignancy and advanced stage disease in patients with bladder urothelial tumors[J]. Int J Surg, 2016, 36(Pt A): 249-254. |
| [13] |
Sørensen B, Larsen OH, Rea CJ, et al. Fibrinogen as a hemostatic agent[J]. Semin Thromb Hemost, 2012, 38(3): 268-273. DOI:10.1055/s-0032-1309287 |
| [14] |
Roche Y, Pasquier D, Rambeaud JJ, et al. Fibrinogen mediates bladder cancer cell migration in an ICAM-1-dependent pathway[J]. Thromb Haemost, 2003, 89(6): 1089-1097. DOI:10.1055/s-0037-1613412 |
| [15] |
Bagante F, Tran TB, Postlewait LM, et al. Neutrophil-lymphocyte and platelet-lymphocyte ratio as predictors of disease specific survival after resection of adrenocortical carcinoma[J]. J Surg Oncol, 2015, 112(2): 164-172. DOI:10.1002/jso.23982 |
| [16] |
Song W, Tian C, Wang K, et al. Preoperative platelet lymphocyte ratio as independent predictors of prognosis in pancreatic cancer: A systematic review and meta-analysis[J]. PLoS One, 2017, 12(6): e0178762. DOI:10.1371/journal.pone.0178762 |
| [17] |
Zhang GM, Zhu Y, Luo L, et al. Preoperative lymphocyte-monocyte and platelet-lymphocyte ratios as predictors of overall survival in patients with bladder cancer undergoing radical cystectomy[J]. Tumour Biol, 2015, 36(11): 8537-8543. DOI:10.1007/s13277-015-3613-x |
| [18] |
Zheng J, Cai J, Li H, et al. Neutrophil to Lymphocyte Ratio and Platelet to Lymphocyte Ratio as Prognostic Predictors for Hepatocellular Carcinoma Patients with Various Treatments: a Meta-Analysis and Systematic Review[J]. Cell Physiol biochem, 2017, 44(3): 967-981. DOI:10.1159/000485396 |
| [19] |
Tran E, Robbins PF, Rosenberg SA. 'Final common pathway' of human cancer immunotherapy: targeting random somatic mutations[J]. Nat Immunol, 2017, 18(3): 255-262. |
| [20] |
Zhou X, Du Y, Huang Z, et al. Prognostic value of PLR in various cancers: a meta-analysis[J]. PLoS One, 2014, 9(6): e101119. DOI:10.1371/journal.pone.0101119 |
| [21] |
Singh R, Mishra MK, Aggarwal H. Inflammation, Immunity, and Cancer[J]. Mediators Inflamm, 2017, 2017: 6027305. |
| [22] |
Wagner DD. New links between inflammation and thrombosis[J]. Arterioscler Thromb Vasc Biol, 2005, 25(7): 1321-1324. DOI:10.1161/01.ATV.0000166521.90532.44 |
| [23] |
Jain S, Harris J, Ware J. Platelets: linking hemostasis and cancer[J]. Arterioscler Thromb Vasc Biol, 2010, 30(12): 2362-2367. DOI:10.1161/ATVBAHA.110.207514 |
| [24] |
Palumbo JS, Talmage KE, Massari JV, et al. Platelets and fibrin(ogen) increase metastatic potential by impeding natural killer cell-mediated elimination of tumor cells[J]. Blood, 2005, 105(1): 178-185. DOI:10.1182/blood-2004-06-2272 |
 2020, Vol. 47
2020, Vol. 47


