文章信息
- 20例晚期肿瘤患者免疫检查点抑制剂不良反应临床观察并文献复习
- Clinical Observation of Adverse Events of Immune Checkpoint Inhibitors in 20 Advanced Tumor Patients and Literature Reviews
- 肿瘤防治研究, 2020, 47(6): 427-431
- Cancer Research on Prevention and Treatment, 2020, 47(6): 427-431
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1554
- 收稿日期: 2019-12-16
- 修回日期: 2020-04-21
2. 100021 北京,国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院内科
2. Department of Medical Oncology, National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China
免疫检查点是人类免疫系统控制免疫反应的关键环节。免疫检查点抑制剂(immune checkpoint inhibitor, ICPi)可阻断免疫检查点相关蛋白活性,增强T细胞的免疫应答,从而抑制肿瘤细胞的免疫逃逸,来消除肿瘤。目前,临床上应用的免疫检查点抑制剂主要作用于细胞毒性T细胞相关抗原-4(CTLA-4)、程序性细胞死亡蛋白(PD-1)及程序性细胞死亡蛋白配体(PD-L1)。
日益增多的临床研究证实了ICPi在肿瘤治疗中的显著疗效,但同时随着PD-1/PD-L1抑制剂在国内外临床试验和应用的逐步推广,越来越多的不良反应也引起了临床医生和患者的关注。ICPi阻断T细胞负性调控信号解除免疫抑制,增强T细胞抗肿瘤效应的同时,也可能异常增强自身的免疫反应,导致免疫调节失衡,使正常组织表现出自身免疫样的炎性反应,即免疫相关不良反应(immune-related adverse events, irAEs),可累及皮肤、消化道、肝脏、内分泌、肺等多系统及脏器。当发生免疫相关不良反应时,若不予以积极有效的临床干预,可能会进一步恶化,甚至危及生命,故irAEs的早发现、早诊断及早治疗至关重要,但现阶段国内针对免疫治疗相关不良反应的临床治疗经验不足,尤其是严重不良反应的识别和处理,急需提高认识和总结经验。
目前,临床最常用的PD-1/PD-L1抑制剂有帕博利珠单抗(Pembrolizumab)、纳武单抗(Nivolumab)及阿特珠单抗(Atezolizumab),回顾性分析我科近几年收治的使用以上三种免疫治疗药物病例的相关不良反应,进一步深化认识PD-1/PD-L1抑制剂的不良反应及处理。
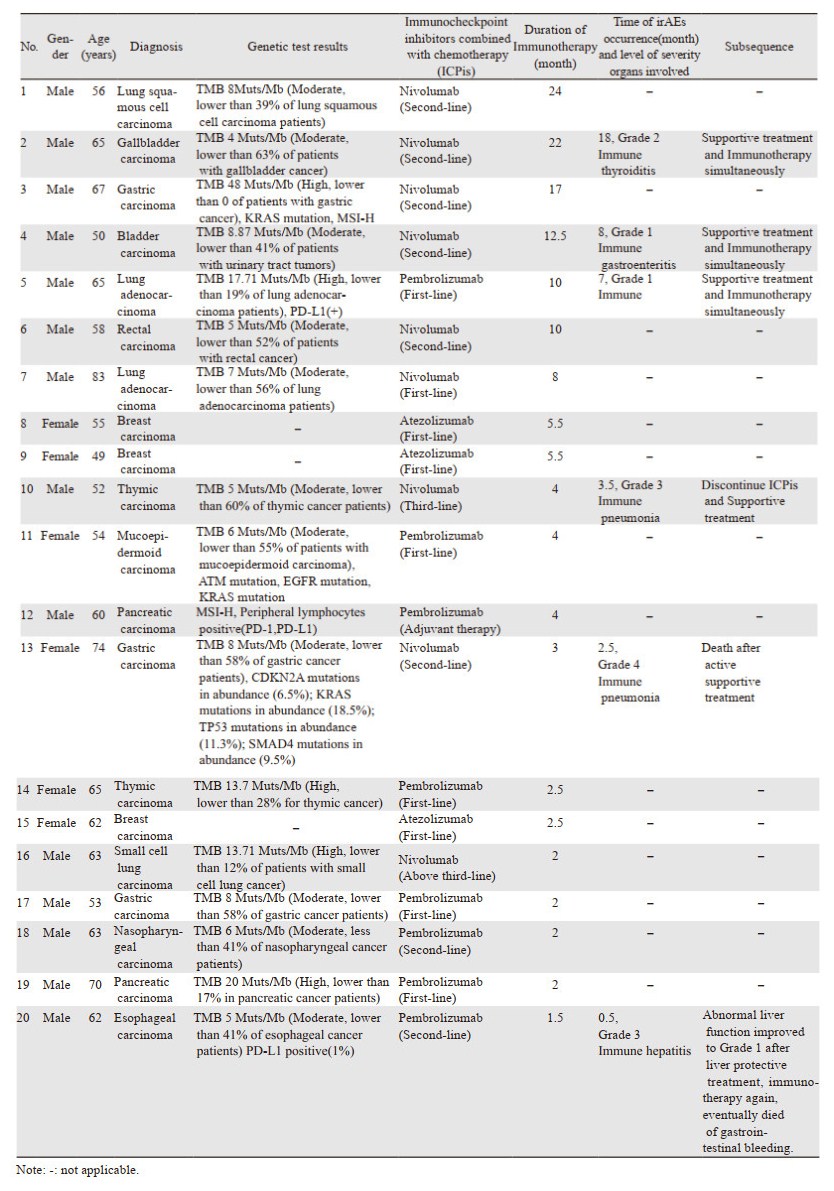
1 资料与方法 1.1 临床资料收集2017年3月—2019年8月中国医学科学院肿瘤医院进行免疫治疗的20例患者,肺癌4例(其中1例小细胞肺癌、1例肺鳞癌及2例肺腺癌)、乳腺癌3例、胃癌3例、胸腺癌2例、食管癌1例、胰腺癌2例、胆囊癌1例、直肠癌1例、膀胱癌1例、鼻咽癌1例及颌下黏液表皮样癌1例,所有患者均为肿瘤晚期(均有远处转移),且既往经过至少一线化疗,ECOG评分0~2分,均无自身免疫性疾病史。
1.2 方法由于该20例患者为不同肿瘤患者,故本研究不对患者疗效进行分析,仅针对免疫治疗的安全性以总结,不良反应分级采用CTCAE评价标准。
20例患者中除3例乳腺癌患者使用阿特珠单抗前未行相关检测外,其他患者均行肿瘤突变负荷(TMB)、错配修复(MMR)基因检测或PD-L1表达检测中的一种或多种,其中TMB高的患者5例,TMB低的患者11例,PD-L1阳性3例,MMR基因缺失1例。10例患者接受纳武单抗治疗,7例接受帕博利珠单抗治疗,3例接受阿特珠单抗。药物用法用量为纳武单抗3 mg/kg每2周1次静脉滴注,帕博利珠单抗2 m/kg每3周1次静脉滴注,阿特珠单抗1 200 mg每3周1次静脉滴注。(患者对药物的选择受药物费用、购药途径及国内药物上市时间限制,故部分国内未上市免疫治疗药物,患者自行购买及输注,治疗期间密切随访)。
2 结果全组患者接受免疫治疗持续的中位时间为4.0月(1.5月,24月),其中多数患者免疫治疗与化疗联合应用,结合临床检查及既往治疗经验,排除了化疗药物及靶向药物引起的不良反应后,诊断免疫相关不良反应的患者共6例。发生irAEs的6例患者,从免疫治疗至诊断irAEs的中位时间为5.3月(0.5月,18月),其中发生irAEs的例数、级别及累及器官的情况分别为:1例Ⅰ级免疫性胃肠炎、1例Ⅰ级免疫性皮炎、1例Ⅱ级免疫性甲状腺炎、1例Ⅲ级免疫性肝炎、1例Ⅲ级免疫性肺炎及1例Ⅳ级免疫性肺炎。这6例患者发生的irAEs中,免疫性肝炎出现最早,于免疫治疗后半月即出现,主要表现为转氨酶升高,而免疫性甲状腺炎发生较晚,为免疫治疗后1年半左右,表现为甲状腺功能减退。对发生Ⅰ、Ⅱ级免疫不良反应的3例患者,我们予以对症支持治疗的同时,继续免疫治疗,患者均耐受性良好。针对1例发生Ⅲ级免疫性肝炎患者,我们停用了免疫治疗,并积极护肝及激素治疗,患者症状逐渐缓解后再次接受了免疫治疗,该例患者原发肿瘤为食管癌,之后因消化道大出血而死亡。另外1例发生Ⅲ级免疫性肺炎患者,尽管予以了积极对症治疗,但肺炎控制不佳,因此后续永久性停用了免疫治疗药物。最严重的1例Ⅳ级免疫性肺炎患者,于院外经积极治疗后肺炎未控,最终死亡,见表 1。
我科收治的20例肿瘤患者经免疫检查点抑制剂治疗,出现较明确irAEs的患者6例,占总患者的30%,低于既往报道的54%~76%[1],这可能是因为该20例患者多为化疗联合免疫治疗,部分irAEs与化疗药物不良反应很难鉴别,而我们将这部分难以鉴别的不良反应未纳入统计中,因此我们统计的irAEs比例低于以往的文献报道。在免疫检查点抑制剂单药治疗的研究中,抗PD-1和抗PD-L1治疗后乏力发生率分别为16%~37%和12%~24%[2]。其他irAEs可见于任何系统器官,累及皮肤、消化道、内分泌、呼吸系统及肌肉骨骼系统的相对多见,心脏、造血系统、泌尿、神经及眼部累及的发生率相对较低。大多数irAEs为轻至中度,但仍有严重irAEs发生,irAEs相关性死亡率约为2%[3-4],因此,尽早识别及正确干预irAEs至关重要。
irAEs累及器官与原发肿瘤的部位和类型暂无明确相关性。该20例免疫治疗患者irAEs发生部位与原发肿瘤均位于不同组织器官。文献报道,经ICPis治疗的非小细胞肺癌(NSCLC)和黑色素瘤患者,免疫相关性肺炎在NSCLC中的发生率高于黑色素瘤患者[5],但其他研究显示,肿瘤类型与发生irAEs部位无关[6-7],而不同患者自身的生物学特征与irAEs发生部位及严重程度有一定相关性,例如患者肠道微生物差异导致免疫性肠炎发生率不同[8-9]。临床试验及实践中,ICPis治疗前常排除可能出现irAEs的高危人群,例如存在自身免疫性疾病或器官移植的患者。然而,既往研究显示,这些高危人群接受免疫治疗的安全性相对良好[10-11]。一项汇总分析发现,存在自身免疫性疾病的患者经ICPis治疗后未发生irAEs或未出现自身免疫性病急性发作的比率为40%[12]。
我科20例免疫治疗患者诊断irAEs的中位时间为5.3月,而理论上irAEs的发生一般在免疫治疗后数周至3月内。目前病理组织活检在irAEs诊断中的价值尚不确切,临床中只有当发生较严重的脏器不良反应时,为了明确病因,医生才会选择组织活检来明确病变性质。现阶段irAEs的诊断主要基于临床症状、化验及影像学检查,因此,临床上诊断irAEs具有滞后性,且诊断时不良反应级别多为Ⅱ级以上,目前仍缺乏简单有效的irAEs的早期诊断标准。
irAEs的发生与免疫治疗疗效是否相关目前仍不明确。从文中20例免疫治疗患者可以发现,免疫治疗时间越长,预示着有效时间越长,且发生irAEs的可能性越大。既往研究证实,在基线特征相似人群中(包括PD-L1表达状态),经纳武单抗治疗后出现irAEs的患者客观缓解率(ORR)更高,且获益最大的患者同时出现了多种irAEs,而ORR与irAEs的严重程度无关[13]。
irAEs的治疗应及时有效,一般Ⅱ级以上的需要暂停ICPi,并予以临床药物干预,Ⅲ级以上irAEs应考虑永久性停ICPi并积极对症处理[14]。目前,针对irAEs最有效的治疗药物主要是糖皮质激素,不同部位及程度的irAEs所给予的激素剂量及时机不同,且予以激素治疗前应充分考虑可能引起的不良反应,例如短期中高剂量的激素可能引起机会性感染、睡眠障碍、胃肠炎及高血压等,长期或大剂量激素治疗会引发糖尿病及骨质疏松等,故在糖皮质激素治疗同时可补充钙、维生素D,及抑酸护胃治疗,部分患者可预防性使用抗生素治疗[15]。我科收治的1例食管癌患者,免疫治疗后2周即出现Ⅲ度免疫性肝炎,行激素治疗后irAEs得到控制,但在后续治疗中因消化道大出血死亡(通过CT检查已排除食管肿瘤进展导致),其大出血的原因考虑为激素诱发的消化道溃疡所致,故治疗irAEs同时应充分认识激素的不良反应,并尽早积极预防相关并发症。此外,糖皮质激素等是否会降低免疫抑制剂治疗疗效,一些回顾性分析显示,用激素治疗irAEs的患者免疫治疗效果并未劣于未用激素的患者[16-17]。
irAEs经积极治疗后缓解的患者,是否可继续免疫治疗仍存在争议。目前,最佳的免疫治疗持续时间尚未确定,早年的临床试验ICPi治疗时间规定为1年,而后的临床研究均使用ICPi治疗2年,直至疾病进展或患者不耐受其不良反应。近期的证据显示,因irAEs停药的患者与未停药的患者预后相似[18]。一项荟萃分析发现,予以纳武单抗联合伊匹单抗(Ipilimumab)治疗黑色素瘤的患者中,因不良反应停用ICPi的患者客观缓解率与未停药患者的缓解率分别为60%和50%[18],同时有文献显示,患者免疫治疗后的肿瘤缓解情况是决定可否重新使用ICPi的重要因素,当患者肿瘤明显缓解时,考虑免疫治疗仍持续发挥作用,故停用免疫治疗也是合理的选择,但当肿瘤缓解不明显时,待irAEs得到有效控制后建议重新使用ICPi治疗[19]。
综上所述,免疫检查点抑制剂适应证的逐步扩大,更多的免疫相关不良反应逐渐显现,在关注其显著疗效的同时,不良反应的诊断及处理在肿瘤治疗中同样占据重要地位,临床中只有妥善管理好irAEs,才能实现肿瘤免疫治疗模式的顺利转变。
作者贡献
王雪:论文构思与撰写
袁芃:论文指导
岳健、司怡然、胡南林、郑方超、姜培娣:病例管理及临床资料收集
| [1] |
Xu C, Chen YP, Du XJ, et al. Comparartive safety of immune checkpoint inhibitors in cancer: systematic review and network meta-analysis[J]. BMJ, 2018, 363: k4226. DOI:10.1136/bmj.k4226 |
| [2] |
Haanen JBAG, Carbonnel F, Robert C, et al. Managment of toxicities from immunotherapy: ESMO Clinical Practive Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2017, 28(Suppl_4): iv119-iv142. |
| [3] |
Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer[J]. N Engl J Med, 2012, 366(26): 2443-2454. DOI:10.1056/NEJMoa1200690 |
| [4] |
Kwon ED, Drake CG, Scher HI, et al. Ipilimumab versus placebo after radiotherapy in patients with metastatic castration-resistant prostate cancer that had progressed after docetaxel chemotherapy (CA184-043): a multicentre, randomised, double-blind, phase 3 trial[J]. Lancet Oncol, 2014, 15(7): 700-712. DOI:10.1016/S1470-2045(14)70189-5 |
| [5] |
Nishino M, Giobbie-Hurder A, Hatabu H, et al. Incidence of programmed cell death 1 inhibitor related pneumonitis in patients with advanced cancer: A systematic review and meta-analysis[J]. JAMA Oncol, 2016, 2(12): 1607-1616. DOI:10.1001/jamaoncol.2016.2453 |
| [6] |
Abdel-Rahman O, Fouad M. Risk of pneumonitis in cancer patients treated with immune checkpoint inhibitors: A meta-analysis[J]. Ther Adv Respir Dis, 2016, 10(3): 183-193. DOI:10.1177/1753465816636557 |
| [7] |
Zhang S, Liang F, Zhu J, et al. Risk of pneumonitis associated with programmed cell death 1 inhibitors in cancer patients: A meta-analysis[J]. Mol Cancer Ther, 2017, 16(8): 1588-1595. |
| [8] |
Chaput N, Lepage P, Coutzac C, et al. Baseline gut microbiota predicts clinical response and colitis in metastatic melanoma patients treated with ipilimumab[J]. Ann Oncol, 2017, 28(6): 1368-1379. DOI:10.1093/annonc/mdx108 |
| [9] |
Dubin K, Callahan MK, Ren B, et al. Intestinal microbiome analyses identify melanoma patients at risk for checkpoint-blockade-induced colitis[J]. Nat Commun, 2016, 7: 10391. DOI:10.1038/ncomms10391 |
| [10] |
Menzies AM, Johnson DB, Ramanujam S, et al. Anti-PD-1 therapy in patients with advanced melanoma and preexisting autoimmune disorders or major toxicity with ipilimumab[J]. Ann Oncol, 2017, 28(2): 368-376. DOI:10.1093/annonc/mdw443 |
| [11] |
Johnson DB, Sullivan RJ, Ott PA, et al. Ipilimumab therapy in patients with advanced melanoma and preexisting autoimmune conditions[J]. JAMA Oncol, 2016, 2(2): 234-240. DOI:10.1001/jamaoncol.2015.4368 |
| [12] |
Abdel-Wahab N, Shah M, Lopez-Olivo MA, et al. Use of immune checkpoint inhibitors in the treatment of patients with cancer and preexisting autoimmune diseases: A systematic review[J]. Ann Intern Med, 2018, 168(2): 121-130. DOI:10.7326/M17-2073 |
| [13] |
Weber JS, Hodi FS, Wolchok JD, et al. Safety profile of nivolumab monotherapy: A pooled analysis of patients with advanced melanoma[J]. J Clin Oncol, 2017, 35(7): 785-792. DOI:10.1200/JCO.2015.66.1389 |
| [14] |
Brahmer JR, Lacchetti C, Schneider BJ, et al. Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: American Society of Clinical Oncology Clinical Practice Guideline[J]. J Clin Oncol, 2018, 36(17): 1714-1768. DOI:10.1200/JCO.2017.77.6385 |
| [15] |
Spain L, Diem S, Larkin J. Management of toxicities of immune checkpoint inhibitors[J]. Cancer Treat Rev, 2016, 44: 51-60. DOI:10.1016/j.ctrv.2016.02.001 |
| [16] |
Weber JS, Hodi FS, Wolchok JD, et al. Safety profile of Nivolumab monotherapy: a pooled analysis of patients with advanced melanoma[J]. J Clin Oncol, 2017, 35(7): 785-792. DOI:10.1200/JCO.2015.66.1389 |
| [17] |
Horvat TZ, Adel NG, Dang TO, et al. Immune-related adverse events, need for systemic immunosuppression, and effects on survival and time to treatment failure in patients with melanoma treated with Ipilimumab at memorial Sloan Kettering cancer center[J]. J Clin Oncol, 2015, 33(28): 3193-3198. |
| [18] |
Schadendorf D, Wolchok JD, Hodi FS, et al. Effificacy and safety outcomes in patients with advanced melanoma who discontinued treatment with nivolumab and ipilimumab because of adverse events: A pooled analysis of randomized phase Ⅱ and Ⅲ trials[J]. J Clin Oncol, 2017, 35(34): 3807-3814. DOI:10.1200/JCO.2017.73.2289 |
| [19] |
Santini FC, Rizvi H, Plodkowski AJ, et al. Safety and Effificacy of Re-treating with Immunotherapy after Immune-Related Adverse Events in Patients with NSCLC[J]. Cancer Immunol Res, 2018, 6(9): 1093-1099. DOI:10.1158/2326-6066.CIR-17-0755 |
 2020, Vol. 47
2020, Vol. 47