文章信息
- 低糖与甘露糖协同抑制胰腺肿瘤生长
- Low Glucose and Mannose Synergistically Inhibit Growth of Pancreatic Tumor
- 肿瘤防治研究, 2020, 47(5): 319-323
- Cancer Research on Prevention and Treatment, 2020, 47(5): 319-323
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1550
- 收稿日期: 2019-12-16
- 修回日期: 2020-04-03
2. 100038 北京,首都医科大学附属北京世纪坛医院胃肠外科/临床营养科;
3. 200433 上海,第二军医大学基础医学部生物化学与分子生物学教研室;
4. 475001 开封,河南大学第一附属医院营养科;
5. 325000 温州,温州医科大学附属第一医院肝胆外科
2. Department of Clinical Nutrition/Gastrointestinal Surgery, Beijing Shijitan Hospital, Capital Medical University, Beijing 100038, China;
3. Department of Biochemistry and Molecular Biology, The College of Basic Medical Sciences, The Second Military Medical University, Shanghai 200433, China;
4. Department of Clinical Nutrition, The First Affiliated Hospital of He'nan University, Kaifeng 475001, China;
5. Department of Hepatobiliary Surgery, The First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, China
随着肿瘤营养学的兴起,通过特殊饮食抗肿瘤的营养疗法越来越受到关注[1]。有研究发现,甘露糖能够抑制肿瘤的生长,增强化疗药物的效果,不同肿瘤敏感度的差异与甘露糖-6-磷酸异构酶(mannose-6-phosphate isomerase, PMI)的表达有关[2]。
肿瘤细胞以有氧糖酵解为主要能量来源,糖酵解速度远高于正常组织,称为Warburg效应[3]。降低血糖,减少葡萄糖供应,理论上可以特异性阻断肿瘤细胞的能量来源,从而抑制肿瘤细胞的生长。禁食及能量限制的饮食方式均能够降低机体葡萄糖水平,从而起到抗肿瘤的效果[1]。同时,低糖环境可能会增强如二甲双胍等药物的抗肿瘤作用[4-5],甘露糖的抗肿瘤作用与糖代谢密切相关,降低培养基的葡萄糖浓度可能增强肿瘤细胞对甘露糖的敏感度。
本研究通过体内与体外实验,观察不同葡萄糖浓度处理下的胰腺肿瘤细胞的增殖与PMI蛋白表达的变化,在荷瘤鼠模型中选择高脂低糖的生酮饮食来降低裸鼠血糖水平,探讨生酮饮食(ketogenic diet, KD)与甘露糖联合应用的抗肿瘤疗效。
1 材料与方法 1.1 细胞培养人胰腺癌细胞AsPC-1、BxPC-3、PANC-1、SW1990均购自中国科学院上海细胞库,用DMEM培养基(含10%胎牛血清和100 u/ml的青霉素、100 μg/ml链霉素,美国Gibco公司,C11995500BT)培养于5%CO2、37℃培养箱中,隔天换培养液,胰蛋白酶消化传代。
1.2 细胞增殖检测将2×103个AsPC-1、BxPC-3、PANC-1、SW1990胰腺癌细胞分别接种于不同的96孔板中,细胞贴壁后,更换不同浓度葡萄糖(25、10、2.5 mmol/L)的培养基并加入浓度梯度的甘露糖(Sigma-Aldrich, M2069),每组重复3次,培养4天(每2天更换培养基)后加入10 μl CCK-8溶液(同仁,CK04),并于培养箱中孵育2 h后以酶标仪测定450 nm处的吸光度。
1.3 蛋白印迹实验(Western blot)以RIPA蛋白裂解液(上海碧云天,P0013)提取总蛋白,BCA蛋白定量试剂盒检测蛋白浓度,4:1加入蛋白上样缓冲液沸水浴变性5 min,印迹到PVDF膜(美国Millipore, IPVH00010)上。使用PMI的特异性抗体(美国Proteintech, 14234-1-AP)和β-actin(上海雅酶生物,LF202)4℃孵育过夜后,兔二抗(上海雅酶生物,LF102)常温2 h,ECL化学发光法曝光条带。
1.4 细胞存活率检测将2×104个细胞接种于12孔板中,各孔板含不同葡萄糖浓度的培养基,实验组含有25 mmol/L甘露糖,继续培养48 h后,按锥虫蓝染色细胞存活率检测试剂盒(上海碧云天,C0011)说明书操作,并用细胞计数仪(Nexcelom Cellometer Auto 2000)测各组细胞存活率。
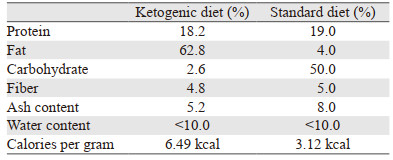
1.5 裸鼠皮下移植瘤模型建立及干预32只裸鼠适应性喂养1周后,取对数生长期的胰腺癌细胞BxPc-3,用无血清培养基调整细胞浓度为2×106个/200微升[6],将细胞悬液200 μl接种于裸小鼠的右后支背部皮下。当肿瘤体积约100 mm3时,用游标卡尺测量肿瘤直径,用公式V=ab2π/6(a为最长直径,b为最短直径)计算肿瘤体积,并随机分成四组:正常饮食(standard diet, SD)组、SD+甘露糖(mannose, Man)组、KD(深圳奇酮公司)组以及KD+Man组,其中Man组与KD+Man组分别以饮用水配制20%和10%甘露糖水溶液的方式喂养。根据前期预实验结果,KD组用量为125 g/kg,SD组不限量,小鼠每日摄取的总能量相近,SD与KD组具体营养配比见表 1。实验过程中使用雅培血糖仪尾静脉取血检测血糖、血酮水平。
采用SPSS23.0和Graphpad Prism 8.2软件进行统计学分析。计量资料数据用(x±s)表示,配对样本t检验比较瘤重和血糖血酮水平。P < 0.05为差异有统计学意义。
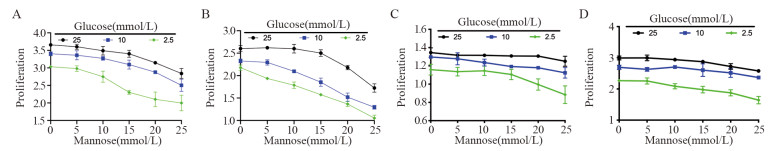
2 结果 2.1 低糖增强甘露糖对胰腺癌细胞的抑制作用葡萄糖浓度为2.5 mmol/L时,较低浓度的甘露糖显著抑制胰腺癌细胞增殖,而葡萄糖浓度为25与10 mmol/L时细胞增殖被显著抑制所需的甘露糖浓度更高,见图 1A~B。25和10 mmol/L葡萄糖浓度时,PANC-1与SW1990细胞对甘露糖敏感度较低,而在2.5 mmol/L葡萄糖浓度时,细胞增殖抑制效果明显(与加入25 mmol/L甘露糖时的抑制率比较,C: P25=0.095, P10=0.029, P2.5=0.014; D: P25=0.008, P10=0.003, P2.5=0.001),见图 1C~D。
|
| A: AsPC-1; B: BxPC-3; C: PANC-1; D: SW1990. 图 1 低糖增加甘露糖对胰腺癌细胞的抑制作用 Figure 1 Low glucose increased inhibitory effect of mannose on pancreatic cancer cells |
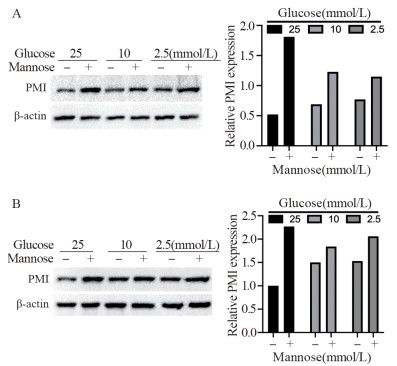
Western blot实验结果显示,不同葡萄糖浓度的培养基培养48 h后,AsPC-1细胞系的PMI酶基础表达量无明显差异。甘露糖能诱导AsPC-1细胞系PMI酶的表达,而且在25 mmol/L葡萄糖浓度时的诱导效果明显强于10、2.5 mmol/L葡萄糖浓度,见图 2A。葡萄糖浓度较低时,BxPc-3细胞系PMI酶的基础表达上调,甘露糖对酶的诱导效果在高糖时更显著,见图 2B。
|
| A: AsPC-1; B: BxPC-3. 图 2 不同葡萄糖浓度作用下PMI蛋白表达的变化 Figure 2 Changes of PMI expression under different concentrations of glucose |
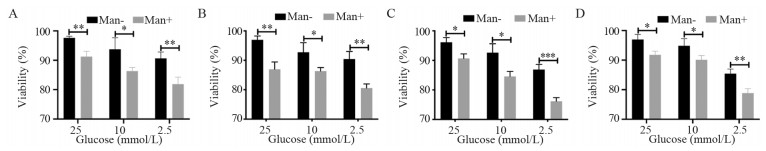
加入25 mmol/L甘露糖后,胰腺癌细胞在不同葡萄糖培浓度养基中铺板的存活率均有所降低,且低糖下细胞存活率明显低于高糖下的存活率,见图 3(A: P25=0.004, P10=0.036, P2.5=0.009; B: P25=0.003, P10=0.03, P2.5=0.004; C: P25=0.013, P10=0.015, P2.5=0.0009; D: P25=0.013, P10=0.042, P2.5=0.006)。
|
| A: PANC-1; B: AsPC-1; C: BxPC-3; D: SW1990; *: P < 0.05; **: P < 0.01; ***: P < 0.001; Man: mannose. 图 3 低糖联合甘露糖降低胰腺癌细胞存活率 Figure 3 Mannose combined with low glucose reduced viability of pancreatic cancer cells |
生酮饮食显著降低裸鼠的血糖(使血糖维持在2~3 mmol/L),升高血酮水平,(使血酮维持在1.5~2.5 mmol/L),而正常血糖与血酮水平分别在6 mmol/L左右与1 mmol/L以下,见图 4A~B。甘露糖则对血糖与血酮水平无明显作用(预实验证明甘露糖不干扰血糖检测)。干预18 d后,因KD+Man组裸鼠体重较低停止实验,KD组几乎无抑瘤效果(P=0.44),Man组肿瘤明显较小(P=0.0247),而KD+Man组肿瘤显著小于其他三组(PSD < 0.0001, PKD < 0.0001, PMan=0.0061),见图 4C~E。
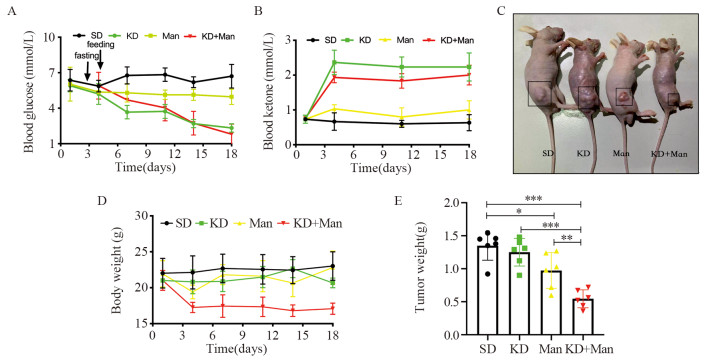
|
| *: P < 0.05; **: P < 0.01; ***: P < 0.001. 图 4 生酮饮食与甘露糖协同抑制移植瘤生长 Figure 4 Ketogenic diet and mannose synergistically inhibited growth of xenografts |
肿瘤的营养代谢疗法是一种新兴的癌症治疗方法,利用肿瘤细胞不同于体细胞的代谢特点,采取能量限制等方式干扰肿瘤的代谢,从而达到抑制肿瘤生长或提高抗肿瘤一线疗法效果的目的[7]。
甘露糖是一种广泛存在于自然界中的单糖,也是葡萄糖、半乳糖C-2位羟基的差向异构体,与葡萄糖具有相同的转运体[8],在人体代谢中具有重要作用,一些先天性糖基化障碍与甘露糖代谢相关酶的突变有关[9]。PMI的缺失会促进人肝星状细胞激活纤维化反应,调节甘露糖代谢途径可以减少人肝星状细胞活化并改善肝纤维化的预后[10]。D-甘露糖补充剂还能够改善小鼠模型自身免疫性糖尿病和气道炎性反应,并增加Foxp3+调节性T细胞的比例[11],且有助于预防复发性尿路感染[12]。有研究发现甘露糖还具有抑制肿瘤、提高化疗药物疗效的作用。甘露糖通过葡萄糖转运载体进入细胞内,然后被己糖激酶(HK)磷酸化为甘露糖-6-磷酸(M-6-P),并通过PMI催化与果糖-6-磷酸相互转化。细胞将已糖作为一个整体来调节,在PMI活性较低的肿瘤细胞中,M-6-P的积累会负反馈抑制葡萄糖代谢关键的三种酶活性:HK、磷酸葡萄糖异构酶和葡萄糖-6-磷酸脱氢酶,从而影响肿瘤细胞葡萄糖代谢(见图 5)抑制肿瘤生长[13-15]。也有研究表明,甘露糖受体参与肿瘤相关巨噬细胞(TAM)的活化,而TAM具有抑制肿瘤的生长、转移及杀伤肿瘤细胞的功能[16-17]。同时,有研究发现甘露糖能够调控调节性T细胞的活性,在免疫平衡调节过程发挥重要的作用,其抗肿瘤的机制也可能与增强免疫系统识别并杀死肿瘤细胞的能力有关[18]。
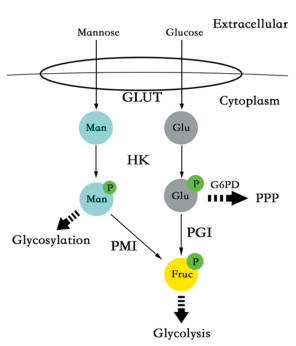
|
| Man: mannose; Glu: glucose; GLUT: glucose transporter; HK: hexokinase; PMI: mannose-6-phosphate isomerase; PGI: glucose-6-phosphate isomerase; Fruc: fructose; G6PD: glucose-6-phosphate dehydrogenase; PPP: pentose phosphate pathway. 图 5 葡萄糖和甘露糖代谢途径 Figure 5 Metabolism pathways of glucose and mannose |
人体正常血糖浓度为3.9~6.1 mmol/L,远低于通常细胞培养的25 mmol/L,因为甘露糖通过生成M-6-P负反馈抑制葡萄糖磷酸化的进行,高糖环境不仅为肿瘤提供了更佳的生存环境,更多葡萄糖底物的存在也可能减弱了甘露糖的效应,使肿瘤细胞表现为对甘露糖不敏感。高脂低糖的生酮饮食本身即具有一定的抗肿瘤疗效,且进一步降低了机体的血糖值,可能与甘露糖具有协同效果。
本研究发现,低糖与甘露糖具有协同作用,联合应用增强了甘露糖抗肿瘤的效果。甘露糖抑制肿瘤的敏感度与PMI酶的表达密切相关,在PMI酶高表达的肿瘤中甘露糖的作用有限。细胞实验中,正常高糖培养条件下加入甘露糖能够明显诱导细胞PMI酶的表达,随着培养基葡萄糖浓度的降低,甘露糖底物对PMI酶的诱导作用减弱,从而增强了甘露糖对肿瘤细胞的抑制效果。体内实验中,生酮饮食加10%甘露糖联合应用组能抑制荷瘤鼠肿瘤生长,且效果优于20%甘露糖或者生酮饮食的单独应用。然而联合应用组荷瘤鼠的平均体重明显降低,我们猜想可能是体细胞PMI酶的诱导表达也同时被抑制,M-6-P在体细胞中堆积,影响了机体正常葡萄糖的利用,也有可能摄入甘露糖影响了体细胞对酮体的利用。同时,体内实验中荷瘤鼠血糖降低水平远不如细胞实验,其中可能还存在其他的机制发挥作用。我们新的实验结果表明酮体本身对PMI酶的表达起到一定抑制作用,可能与βHB作为信号分子的作用有关[19-20]。进一步的实验证据正在探索当中。接下来的实验中我们将研究酮体与PMI酶、甘露糖与酮体酶表达之间的相互作用关系,摸索甘露糖水溶液与生酮饮食联合应用的最适浓度,同时观察联合喂养对小鼠进食、消化能力与肠道代谢物的影响,为该方法的肿瘤临床治疗提供更多的依据。
作者贡献
陈哲文:实验操作、文章撰写
石汉平:实验方案设计
缪明永:实验指导
余亚英:实验咨询
张启瑜:实验思路提出与设计
| [1] |
Vergati M, Krasniqi E, Monte GD, et al. Ketogenic Diet and Other Dietary Intervention Strategies in the Treatment of Cancer[J]. Curr Med Chem, 2017, 24(12): 1170-1185. |
| [2] |
Gonzalez PS, O'Prey J, Cardaci S, et al. Mannose impairs tumour growth and enhances chemotherapy[J]. Nature, 2018, 563(7733): 719-723. |
| [3] |
Hsu PP, Sabatini DM. Cancer cell metabolism: Warburg and beyond[J]. Cell, 2008, 134(5): 703-707. |
| [4] |
Elgendy M, Cirò M, Hosseini A, et al. Combination of Hypoglycemia and Metformin Impairs Tumor Metabolic Plasticity and Growth by Modulating the PP2A-GSK3beta-MCL-1 Axis[J]. Cancer Cell, 2019, 35(5): 798-815. DOI:10.1016/j.ccell.2019.03.007 |
| [5] |
张杰, 丛明华, 高云, 等. 低糖增强肿瘤对二甲双胍的敏感度[J]. 肿瘤防治研究, 2018, 45(3): 125-130. [Zhang J, Cong MH, Gao Y, et al. Low glucose enhances sensitivity of cance to metformin[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(3): 125-130.] |
| [6] |
Chen G, Shi Y, Zhang Y, et al. CircRNA_100782 regulates pancreatic carcinoma proliferation through the IL6-STAT3 pathway[J]. Onco Targets Ther, 2017, 10: 5783-5794. DOI:10.2147/OTT.S150678 |
| [7] |
De Lorenzo MS, Baljinnyam E, Vatner DE, et al. Caloric restriction reduces growth of mammary tumors and metastases[J]. Carcinogenesis, 2011, 32(9): 1381-1387. |
| [8] |
Thorens B, Mueckler M. Glucose transporters in the 21st Century[J]. Am J Physiol Endocrinol Metab, 2010, 298(2): E141-145. |
| [9] |
Sharma V, Ichikawa M, Freeze HH. Mannose metabolism: more than meets the eye[J]. Biochem Biophys Res Commun, 2014, 453(2): 220-228. |
| [10] |
DeRossi C, Bambino K, Morrison J, et al. Mannose Phosphate Isomerase and Mannose Regulate Hepatic Stellate Cell Activation and Fibrosis in Zebrafish and Humans[J]. Hepatology, 2019, 70(6): 2107-2122. DOI:10.1002/hep.30677 |
| [11] |
Zhang D, Chia C, Jiao X, et al. D-mannose induces regulatory T cells and suppresses immunopathology[J]. Nat Med, 2017, 23(9): 1036-1045. |
| [12] |
Kranjčec B, Papeš D, Altarac S. D-mannose powder for prophylaxis of recurrent urinary tract infections in women: a randomized clinical trial[J]. World J Urol, 2014, 32(1): 79-84. |
| [13] |
Zhang M, Zhuo X, Wang J, et al. Phosphomannose isomerase affects the key enzymes of glycolysis and sucrose metabolism in transgenic sugarcane overexpressing the manA gene[J]. Mol Breed, 2015, 35(3): 100. |
| [14] |
Shtraizent N, DeRossi C, Nayar S, et al. MPI depletion enhances O-GlcNAcylation of p53 and suppresses the Warburg effect[J]. Elife, 2017, 6: e22477. |
| [15] |
宋蒙蒙, 陈哲文, 李晔, 等. 甘露糖抗肿瘤作用的研究进展[J]. 肿瘤代谢与营养电子杂志, 2019, 6(3): 283-286. [Song MM, Chen ZW, Li Y, et al. Research Progress of Anti-tumor Effect of Mannose[J]. Zhong Liu Dai Xie Yu Ying Yang Dian Zi Za Zhi, 2019, 6(3): 283-286.] |
| [16] |
Binnemars-Postma K, Bansal R, Storm G, et al. Targeting the Stat6 pathway in tumor-associated macrophages reduces tumor growth and metastatic niche formation in breast cancer[J]. FASEB J, 2018, 32(2): 969-978. |
| [17] |
Alaeddine M, Prat M, Poinsot V, et al. IL13-Mediated Dectin-1 and Mannose Receptor Overexpression Promotes Macrophage Antitumor Activities through Recognition of Sialylated Tumor Cells[J]. Cancer Immunol Res, 2019, 7(2): 321-334. |
| [18] |
Zhang D, Chia C, Jiao X, et al. D-mannose induces regulatory T cells and suppresses immunopathology[J]. Nat Med, 2017, 23(9): 1036-1045. |
| [19] |
Newman JC, Verdin E. Ketone bodies as signaling metabolites[J]. Trends Endocrinol Metab, 2014, 25(1): 42-52. |
| [20] |
Rojas-Morales P, Tapia E, Pedraza-Chaverri J. β-Hydroxybutyrate: A signaling metabolite in starvation response?[J]. Cell Signal, 2016, 28(8): 917-923. |
 2020, Vol. 47
2020, Vol. 47