文章信息
- 环氧木香内酯通过NF-κB信号通路下调MMP-2/9抑制胶质瘤细胞U251侵袭和迁移
- Epoxymicheliolide Suppresses Invasion and Migration of U251 Cells by Downregulating MMP-2/9 via NF-κB Signaling Pathway
- 肿瘤防治研究, 2020, 47(6): 416-420
- Cancer Research on Prevention and Treatment, 2020, 47(6): 416-420
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1530
- 收稿日期: 2019-12-11
- 修回日期: 2020-02-07
2. 443000 宜昌,三峡大学附属仁和医院消化内科
2. Department of Gastroenterology, The Affiliated Renhe Hospital of China Three Gorges University, Yichang 443000, China
胶质瘤是最常见的恶性原发性脑肿瘤,具有高发病率和高死亡率的特点[1]。2018年全世界新增约30万胶质瘤患者并有24万左右的患者死亡[2]。目前临床上治疗胶质瘤主要采用手术后辅以放疗和化疗等综合疗法,但患者的中位生存期仅15月[3]。胶质瘤患者预后差的主要原因是其高侵袭性的特点导致手术时无法完全切除,而残留的肿瘤细胞对放化疗等治疗手段不敏感[4]。环氧木香内酯(Epoxymicheliolide, EMCL)是银胶菊内酯(Parthenolide, PTL)的结构类似物,能够有效抑制肾癌的增殖、侵袭和迁移[5]。但是,EMCL是否能够抑制胶质瘤的增殖、侵袭和迁移以及其机制尚未见报道。本研究旨在观察EMCL能否抑制胶质瘤细胞侵袭和迁移,并探讨其作用机制,为EMCL治疗胶质瘤提供理论依据。
1 材料与方法 1.1 主要药物、试剂与仪器EMCL(纯度 > 98%,购自南京春秋生物工程有限公司)溶解于DMSO中,储备液浓度1 000 mmol/L。CCK-8检测试剂购自日本同仁化学研究所;MMP-2、MMP-9、p-p65、p65和β-actin抗体购自美国Cell Signaling Technology公司。超净工作台购自苏州安泰空气技术有限公司;高速低温离心机、台式常温离心机购自美国Eppendorf公司;Western blot仪器购自美国伯乐公司;CO2培养箱购自美国Thermo公司。
1.2 细胞系和细胞培养人胶质瘤U251细胞株购自美国模式培养物集存库(American Typeculture Collection, ATCC)。细胞培养于37℃、5%CO2的培养箱中。于含10%胎牛血清及100 u/ml青霉素和100 μg/ml链霉素的DMEM培养基中进行细胞培养,待贴壁生长至90%时使用胰蛋白酶消化传代。
1.3 CCK-8实验检测U251细胞存活率取对数生长期U251细胞,按3×103/100 μl密度接种于96孔培养板内,每孔100 μl,同时以不含细胞的培养液作为调零孔。37℃、5%CO2条件下培养24 h后,实验组中分别加入含不同浓度环氧木香内酯培养液(终浓度为2.5、5、10、20、40 μmol/L),对照组中加入不含任何干预剂的培养液,每组设3个复孔。培养48 h后,弃上清液,加入新鲜的含10%CCK-8的培养液。继续培养1 h后,于酶标仪450 nm波长处检测各孔的吸光度(A)值,计算细胞的存活率,细胞的存活率(%)=(实验组平均A值/对照组平均A值)×100%。
1.4 药物剂量、细胞分组及细胞形态观察根据CCK-8实验结果,不同浓度EMCL处理U251细胞48 h后,计算IC50,并选择接近0.5、1和1.5倍IC50作为后续EMCL的实验浓度。实验设U251细胞对照组(DMSO处理)、环氧木香内酯低剂量组、环氧木香内酯中剂量组、环氧木香内酯高剂量组。用配有数码相机的Leica DM 14000 B显微镜观察各组细胞形态并拍照。
1.5 划痕实验检测U251细胞迁移能力U251细胞接种于6孔培养板中,待其生长至完全融合,用不含血清的培养基培养6 h后,用无菌的10 μl移液管尖刮去融合的细胞单层,并用含有不同浓度环氧木香内酯(10、20和30 μmol/L)的10%胎牛血清的培养基培养细胞,并保存在CO2培养箱中。48 h后,用PBS缓冲液代替培养基,观察伤口间隙,并使用配有数码相机的Leica DM 14 000B显微镜拍照。
1.6 Transwell实验检测U251细胞侵袭能力取对数生长期U251细胞,细胞以5×104/100 μl的密度接种到Transwell上室中。上室内含有不同浓度环氧木香内酯(10、20和30 μmol/L)的无胎牛血清的培养基,下室内含有不同浓度环氧木香内酯(10、20和30 μmol/L)的10%胎牛血清的培养基。48 h后用棉签擦掉小室内细胞,95%乙醇固定,0.1%结晶紫染色,洗净风干后显微镜200倍视野下拍照计数。
1.7 Western blot检测蛋白表达不同浓度环氧木香内酯(10、20和30 μmol/L)处理U251细胞48 h后,收集U251细胞,用RIPA裂解液裂解细胞蛋白,BCA蛋白定量试剂盒测定蛋白浓度。SDS-PAGE电泳后,将蛋白转至PVDF膜,5%脱脂奶粉TBS封闭2 h,加入MMP-2抗体(1:500)、MMP-9抗体(1:500)、p-p65抗体(1:500)、p65抗体(1:1 000)和β-actin(1:1 000),4℃孵育过夜,次日洗涤后,加入二抗(1:5 000),室温孵育1 h,ECL发光液显色检测。
1.8 统计学方法应用SPSS19.0统计软件进行统计分析,数据以均数±标准差(x±s)表示,组间比较用单因素方差分析(ANOVA)。P < 0.05为差异有统计学意义。
2 结果 2.1 环氧木香内酯对U251细胞存活率和细胞形态的影响与对照组相比,2.5和5 μmol/L环氧木香内酯组对U251细胞活力的影响并不显著,差异无统计学意义(P=0.179和P=0.076);10 μmol/L(P=0.039)、20 μmol/L(P=0.001)、40 μmol/L(P=0.000)的环氧木香内酯明显抑制U251细胞活力,且呈浓度依赖性,见图 1。环氧木香内酯作用于U251细胞48 h后的IC50为(21.825±1.332)μmol/L。
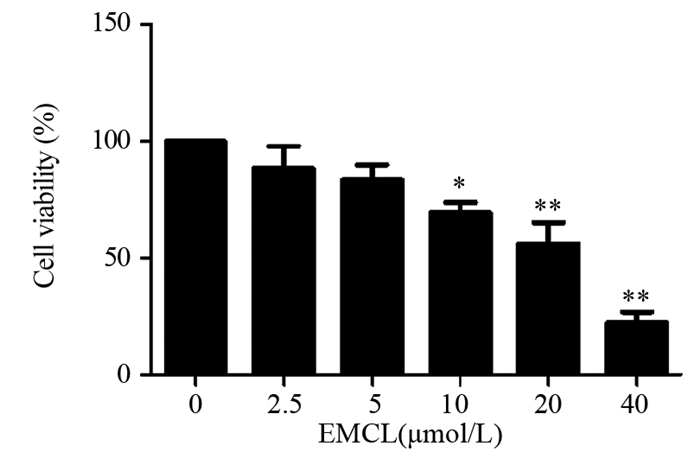
|
| EMCL: Epoxymicheliolide; *: P < 0.05, **: P < 0.01, compared with 0μmol/L EMCL group. 图 1 环氧木香内酯作用48h后U251细胞的存活率 Figure 1 Survival rate of U251 cells after epoxymicheliolide treatment for 48h |
同时,与对照组相比,环氧木香内酯能够明显改变U251细胞的形态,表现为细胞数目显著减少,细胞形态变圆、变小,细胞与细胞间的接触、丝状伪足均显著减少,见图 2。
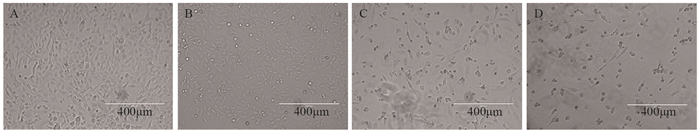
|
| A: 0μmol/L EMCL; B: 10μmol/L EMCL; C: 20μmol/L EMCL; D: 30μmol/L EMCL. 图 2 环氧木香内酯对U251细胞形态的影响(×100) Figure 2 Effect of epoxymicheliolide on morphology of U251 cells (×100) |
与对照组相比,10 μmol/L环氧木香内酯对U251细胞迁移能力的影响并不显著,差异无统计学意义(P=0.087);20(P=0.026)和30 μmol/L(P=0.001)的环氧木香内酯可明显抑制U251细胞迁移能力,且呈浓度依赖性,见图 3。
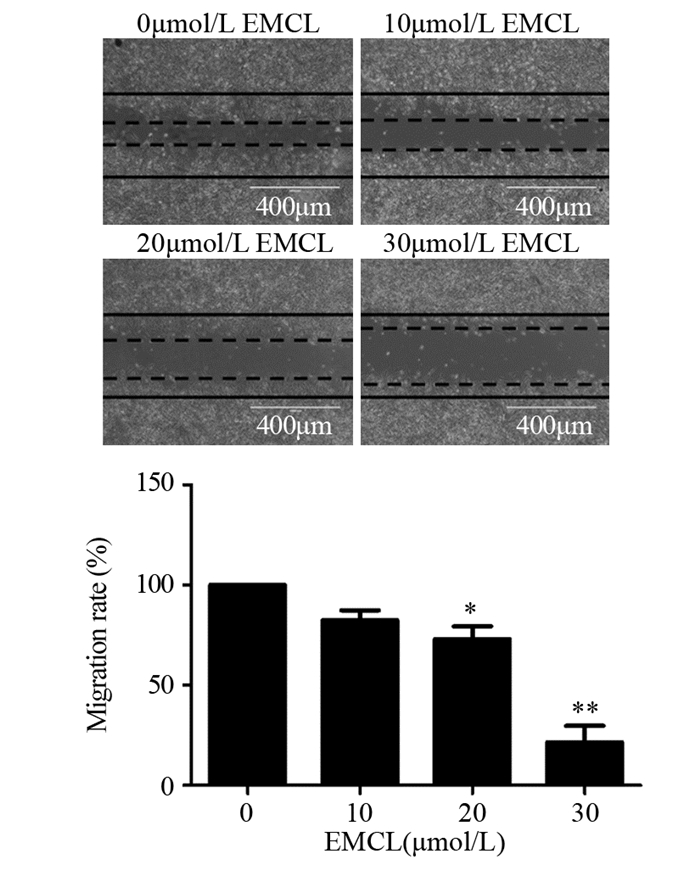
|
| *: P < 0.05, P < 0.01, compared with 0μmol/L EMCL group. 图 3 环氧木香内酯作用48h后U251细胞的迁移能力(×100) Figure 3 Migration ability of U251 cells after epoxymicheliolide treatment for 48 h (×100) |
与对照组相比,10(P=0.006)、20(P=0.001)和30 μmol/L(P=0.000)的环氧木香内酯均能明显抑制U251细胞侵袭能力,且呈浓度依赖性,见图 4。
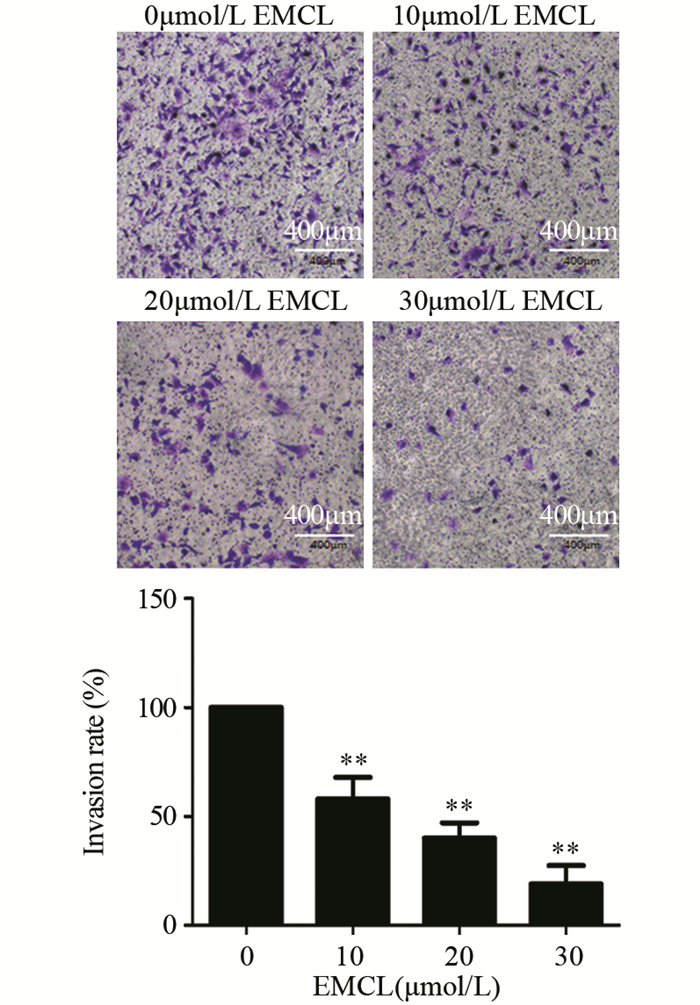
|
| *: P < 0.05, **: P < 0.01, compared with 0μmol/L EMCL group. 图 4 环氧木香内酯作用48h后U251细胞的侵袭能力(×200) Figure 4 Invasion ability of U251 cells after epoxymicheliolide treatment for 48 h (×200) |
与对照组相比,10(P=0.009)、20(P=0.002)和30 μmol/L(P=0.001)的环氧木香内酯能明显抑制U251细胞MMP-2蛋白的表达,且呈浓度依赖性;10 μmol/L环氧木香内酯并未显著影响U251细胞MMP-9蛋白的表达,差异无统计学意义(P=0.456);20(P=0.032)和30 μmol/L(P=0.016)的环氧木香内酯能明显抑制U251细胞MMP-9蛋白的表达,且呈浓度依赖性,见图 5。
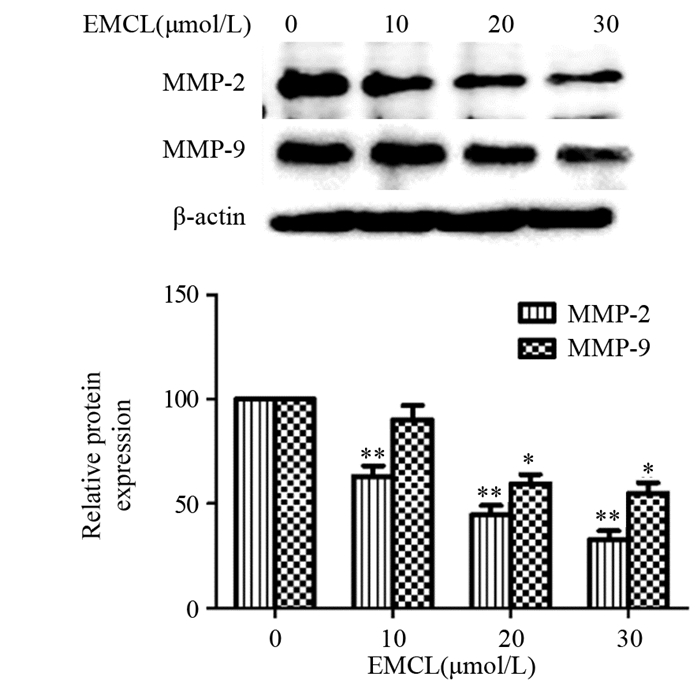
|
| *: P < 0.05, **: P < 0.01, compared with 0μmol/L EMCL group. 图 5 环氧木香内酯对U251细胞侵袭和相关蛋白表达的影响 Figure 5 Effect of epoxymicheliolide on invasion and related proteins expression in U251 cells detected by Western blot |
由于NF-κB信号通路参与了肿瘤细胞MMP-2和MMP-9蛋白表达的调控[6],推测环氧木香内酯可能通过NF-κB信号通路调节U251细胞侵袭和迁移。通过检查NF-κB信号通路相关蛋白发现,10 μmol/L环氧木香内酯并未显著影响U251细胞p-p65/p65的表达,与对照组比较,差异无统计学意义(P=0.167);20(P=0.009)和30 μmol/L(P=0.003)的环氧木香内酯能明显抑制U251细胞p-p65/p65的表达,且呈浓度依赖性,见图 6。
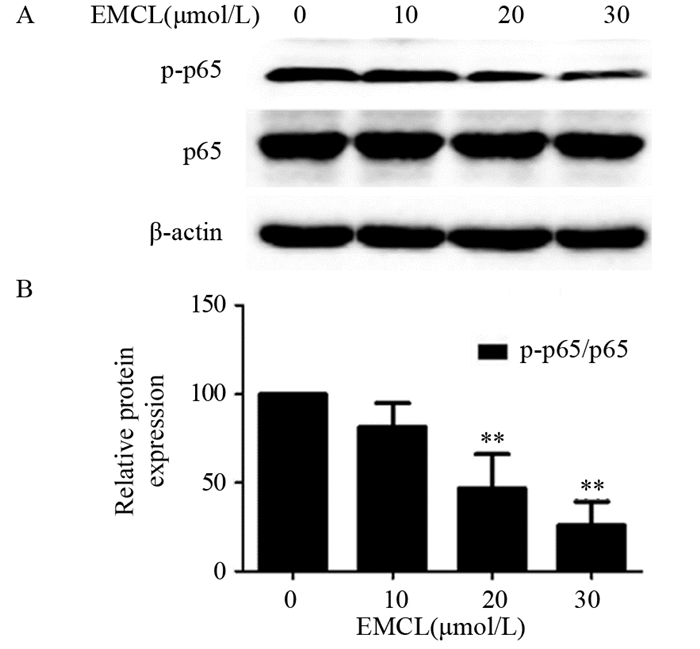
|
| *: P < 0.05, **: P < 0.01, compared with 0μmol/L EMCL group. 图 6 环氧木香内酯对U251细胞中与NF-κB信号通路相关蛋白表达的影响 Figure 6 Effect of epoxymicheliolide on NF-κB signaling pathway-related proteins expression in U251 cells detected by Western blot |
银胶菊内酯是一种从艾菊属植物中提取的倍半萜类化合物,具有抗炎活性,主要用于治疗偏头痛和类风湿性关节炎[7]。体内外研究表明银胶菊内酯能够通过抑制NF-κB信号通路从而抑制多种促炎细胞因子的表达[8-9]。近年来,银胶菊内酯的抗肿瘤活性受到越来越多的关注与研究。银胶菊内酯能够有效抑制多种肿瘤的增殖、侵袭和转移,并诱导肿瘤细胞凋亡,例如大肠癌[10]、甲状腺癌[11]、白血病[12]、胶质瘤[13]等。但是,银胶菊内酯在酸性和碱性条件下极不稳定[14]。目前已经开发出了一系列与银胶菊内酯结构相关化合物,这些化合物在酸性和碱性条件下更稳定,包括环氧木香内酯,见图 7。环氧木香内酯能够有效抑制肾癌的增殖、侵袭和迁移,并诱导肾癌细胞的凋亡[5]。但是,环氧木香内酯在胶质瘤中的作用以及机制未见报道。因此,本研究旨在探索环氧木香内酯在胶质瘤中的作用及其机制,以期发现新的治疗胶质瘤的药物。
|
| 图 7 银胶菊内酯和环氧木香内酯的化学结构 Figure 7 Chemical structures of parthenolide and epoxymicheliolide |
本研究发现环氧木香内酯呈浓度依赖性的抑制U251细胞增殖。同时,进一步研究发现环氧木香内酯能够有效抑制U251细胞侵袭和迁移能力。
肿瘤细胞转移是癌症进展的关键标志[15],涉及许多因素,包括细胞程序性死亡缺陷、细胞外基质降解和肿瘤血管生成[16]。细胞外基质是血管生成促进剂的来源并通过异质大分子为细胞和组织提供结构支持。细胞外基质的降解或分解会导致细胞间基质的分离从而促进细胞迁移,这是肿瘤侵袭和迁移的关键步骤[17]。基质金属蛋白酶(Matrix metalloproteinases, MMPs)是结构相关的锌依赖性内切肽酶家族,基本上能降解所有细胞外基质成分,包括胶原蛋白、明胶和蛋白聚糖[18]。在MMPs中,MMP-2和MMP-9在癌症的侵袭和转移中起重要作用[19-20]。MMP-2和MMP-9能够催化降解大部分细胞外基质和基底膜成分,并促进肿瘤血管生成,从而增强肿瘤的侵袭和迁移能力[21-23]。本研究结果发现,环氧木香内酯呈浓度依赖性的抑制U251细胞中MMP-2和MMP-9蛋白的表达。
NF-κB是一类重要的转录因子,通过调节下游靶基因表达产生广泛的生物学效应,包括增殖、侵袭和迁移[5, 24-25]。NF-κB信号通路在肿瘤中处于中心协调者地位[26]。肿瘤组织内部或外部各种因素过度激活了NF-κB活性,从而增强了肿瘤的增殖、侵袭和迁移能力[27]。研究显示可以通过抑制NF-κB信号通路的活化来治疗胶质瘤[24-25]。另有研究表明,NF-κB信号通路能够调节MMP-2和MMP-9的表达[28-29]。本研究结果发现,环氧木香内酯呈浓度依赖性地抑制U251细胞中p-p65/p65的表达。
综上所述,环氧木香内酯呈浓度依赖性的抑制U251细胞增殖、侵袭和迁移,初步证实环氧木香内酯在治疗胶质瘤中的潜能。环氧木香内酯通过抑制NF-κB信号通路下调MMP-2和MMP-9的表达抑制U251细胞侵袭和迁移,为胶质瘤的治疗提供新的潜在药物。本研究在体外证明了环氧木香内酯对胶质瘤的作用效果,但是缺少动物实验进一步验证其体内效果。同时,NF-κB信号通路在环氧木香内酯抑制胶质瘤侵袭和迁移中是否处于决定性地位以及环氧木香内酯在治疗胶质瘤时的副作用都有待进一步研究。
作者贡献
孙欢、朱佳斌:主要实验的实施及论文撰写
赵晓瑾:蛋白提取和数据处理
尚发军:指导实验,并提供实验平台及资金支持
| [1] |
Pereira S, Pinto A, Alves V, et al. Brain Tumor Segmentation Using Convolutional Neural Networks in MRI Images[J]. IEEE Trans Med Imaging, 2016, 35(5): 1240-1251. DOI:10.1109/TMI.2016.2538465 |
| [2] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [3] |
Brown TJ, Brennan MC, Li M, et al. Association of the Extent of Resection With Survival in Glioblastoma: A Systematic Review and Meta-analysis[J]. JAMA Oncol, 2016, 2(11): 1460-1469. DOI:10.1001/jamaoncol.2016.1373 |
| [4] |
Reifenberger G, Wirsching HG, Knobbe-Thomsen CB, et al. Advances in the molecular genetics of gliomas-implications for classification and therapy[J]. Nat Rev Clin Oncol, 2017, 14(7): 434-452. DOI:10.1038/nrclinonc.2016.204 |
| [5] |
Zhu J, Zhao J, Yu Z, et al. Epoxymicheliolide, a novelguaiane-type sesquiterpene lactone, inhibits NF-κB/COX2 signaling pathways by targeting leucine 281 and leucine 25 in IKKβ in renal cell carcinoma[J]. Int J Oncol, 2018, 53(3): 987-1000. DOI:10.3892/ijo.2018.4460 |
| [6] |
Hsu FT, Chiang IT, Kuo YC, et al. Amentoflavone Effectively Blocked the Tumor Progression of Glioblastoma via Suppression of ERK/NF-κB Signaling Pathway[J]. Am J Chin Med, 2019, 47(4): 913-931. |
| [7] |
Freund RRA, Gobrecht P, Fischer D, et al. Advances in chemistry and bioactivity of parthenolide[J]. Nat Prod Rep, 2019.[Epub ahead of print]
|
| [8] |
Liao K, Xia B, Zhuang QY, et al. Parthenolide inhibits cancer stem-like side population of nasopharyngeal carcinoma cells via suppression of the NF-κB/COX-2 pathway[J]. Theranostics, 2015, 5(3): 302-321. DOI:10.7150/thno.8387 |
| [9] |
Khare P, Datusalia AK, Sharma SS. Parthenolide, an NF-κB Inhibitor Ameliorates Diabetes-Induced Behavioural Deficit, Neurotransmitter Imbalance and Neuroinflammation in Type 2 Diabetes Rat Model[J]. Neuromolecular Med, 2017, 19(1): 101-112. DOI:10.1007/s12017-016-8434-6 |
| [10] |
Zhu SM, Park YR, Seo SY, et al. Parthenolide inhibits transforming growth factorβ1-induced epithelial-mesenchymal transition in colorectal cancer cells[J]. Intest Res, 2019, 17(4): 527-536. DOI:10.5217/ir.2019.00031 |
| [11] |
Li C, Zhou Y, Cai Y, et al. Parthenolide Inhibits the Proliferation of MDA-T32 Papillary Thyroid Carcinoma Cells in Vitro and in Mouse Tumor Xenografts and Activates Autophagy and Apoptosis by Downregulation of the Mammalian Target of Rapamycin (mTOR)/PI3K/AKT Signaling Pathway[J]. Med Sci Monit, 2019, 25: 5054-5061. DOI:10.12659/MSM.915387 |
| [12] |
Saosathan S, Khounvong J, Rungrojsakul M, et al. Costunolide and parthenolide from Champi Sirindhorn (Magnolia sirindhorniae) inhibit leukemic cell proliferation in K562 and molt-4 cell lines[J]. Nat Prod Res, 2019, 1-5. |
| [13] |
Nakabayashi H, Shimizu K. Involvement of Akt/NF-κB pathway in antitumor effects of parthenolide on glioblastoma cells in vitro and in vivo[J]. BMC Cancer, 2012, 12: 453. DOI:10.1186/1471-2407-12-453 |
| [14] |
Jin P, Madieh S, Augsburger LL. The solution and solid state stability and excipient compatibility of parthenolide in feverfew[J]. AAPS PharmSciTech, 2007, 8(4): E105. |
| [15] |
Valastyan S, Weinberg RA. Tumor metastasis: molecular insights and evolving paradigms[J]. Cell, 2011, 147(2): 275-292. DOI:10.1016/j.cell.2011.09.024 |
| [16] |
Su Z, Yang Z, Xu Y, et al. Apoptosis, autophagy, necroptosis, and cancer metastasis[J]. Mol Cancer, 2015, 14: 48. |
| [17] |
Elgundi Z, Papanicolaou M, Major G, et al. Cancer Metastasis: The Role of the Extracellular Matrix and the Heparan Sulfate Proteoglycan Perlecan[J]. Front Oncol, 2019, 9: 1482. |
| [18] |
Drake PM, Franz-Odendaal TA. A Potential Role for MMPs during the Formation of Non-Neurogenic Placodes[J]. J Dev Biol, 2018, 6(3): pii: E20. DOI:10.3390/jdb6030020 |
| [19] |
Yang R, Xu J, Hua X, et al. Overexpressed miR-200a promotes bladder cancer invasion through direct regulating Dicer/miR-16/JNK2/MMP-2 axis[J]. Oncogene, 2019.[Epub ahead of print]
|
| [20] |
Muscella A, Vetrugno C, Cossa LG, et al. TGF-β1 activates RSC96 Schwann cells migration and invasion through MMP-2 and MMP-9 activities[J]. J Neurochem, 2019.[Epub ahead of print]
|
| [21] |
Lyu Y, Xiao Q, Yin L, et al. Potent delivery of an MMP inhibitor to the tumor microenvironment with thermosensitive liposomes for the suppression of metastasis and angiogenesis[J]. Signal Transduct Target Ther, 2019, 4: 26. DOI:10.1038/s41392-019-0054-9 |
| [22] |
Mapoung S, Suzuki S, Fuji S, et al. Cyclohexanone curcumin analogs inhibit the progression of castration-resistant prostate cancer in vitro and in vivo[J]. Cancer Sci, 2019, 110(2): 596-607. DOI:10.1111/cas.13897 |
| [23] |
Webb AH, Gao BT, Goldsmith ZK, et al. Inhibition of MMP-2 and MMP-9 decreases cellular migration, and angiogenesis in in vitro models of retinoblastoma[J]. BMC Cancer, 2017, 17(1): 434. DOI:10.1186/s12885-017-3418-y |
| [24] |
Lei Q, Gu H, Li L, et al. TNIP1-mediated TNF-alpha/NF-κB signalling cascade sustains glioma cell proliferation[J]. J Cell Mol Med, 2019, 24(1): 530-538. DOI:10.1111/jcmm.14760 |
| [25] |
Yuan Y, Li SL, Cao YL, et al. LKB1 suppresses glioma cell invasion via NF-κB/Snail signaling repression[J]. Onco Targets Ther, 2019, 12: 2451-2463. DOI:10.2147/OTT.S193736 |
| [26] |
Karin M. Nuclear factor-kappaB in cancer development and progression[J]. Nature, 2006, 441(7092): 431-436. DOI:10.1038/nature04870 |
| [27] |
Taniguchi K, Karin M. NF-κB, inflammation, immunity and cancer: coming of age[J]. Nat Rev Immunol, 2018, 18(5): 309-324. DOI:10.1038/nri.2017.142 |
| [28] |
Wang X, Li X, Li C, et al. Aurora-A modulates MMP-2 expression via AKT/NF-κB pathway in esophageal squamous cell carcinoma cells[J]. Acta Biochim Biophys Sin(Shanghai), 2016, 48(6): 520-527. |
| [29] |
Liu D, Zhang R, Wu J, et al. Interleukin-17A promotes esophageal adenocarcinoma cell invasiveness through ROS-dependent, NF-κB-mediated MMP-2/9 activation[J]. Oncol Rep, 2017, 37(3): 1779-1785. DOI:10.3892/or.2017.5426 |
 2020, Vol. 47
2020, Vol. 47


