文章信息
- 长链非编码RNA HOXA11-AS在肝癌组织中的表达及临床意义
- Expression and Clinical Significance of lnc RNA HOXA11-AS in Hepatocellular Carcinoma
- 肿瘤防治研究, 2020, 47(8): 607-610
- Cancer Research on Prevention and Treatment, 2020, 47(8): 607-610
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1503
- 收稿日期: 2019-12-10
- 修回日期: 2020-04-03
肝癌为临床高发恶性肿瘤,其发病率及死亡率逐年升高,由于患者早期症状不明显,多数患者就诊时处于中晚期,往往错过根治性手术最佳时机[1-2]。尽管肝癌的临床诊疗手段日趋成熟,但患者术后五年生存率仍较低[3]。因此,寻找肝癌生物学标志物对患者的早期诊疗及预后评估具有重要意义。长链非编码RNA是近年来发现的一类可参与肿瘤细胞增殖、迁移和凋亡等多个层面调控的不编码蛋白质的RNA[4]。本研究组前期通过芯片技术发现,长链非编码RNA HOXA11-AS的表达量随肝癌的发生发展进程变化明显,因此,我们采用实时定量反转录聚合酶链反应(qRT-PCR)进一步验证其在肝癌组织中的表达,并分析了其与患者临床病理特征及预后的相关性。
1 资料与方法 1.1 一般资料选取2016年10月—2018年10月中南大学湘雅医学院附属海口医院收治的106例原发性肝癌患者,均经手术病理证实为肝细胞癌,且术前均未接受化学药物及放射治疗。其中,男57例,女49例;年龄38~73岁,平均年龄57.42±3.69岁;按AJCC第八版分期标准分为:Ⅰ期23例,Ⅱ期55例,Ⅲ期17例,Ⅳ期11例;淋巴结转移11例;肿瘤直径1.2~9.7 cm;乙型肝炎73例(判定标准:患者血液标本中可检测到乙肝病毒DNA)。本研究经医院伦理学委员会审批通过,入组对象均知情同意。
1.2 方法 1.2.1 组织样本术中切取肝癌及癌旁正常组织(距肿瘤组织边缘≥2 cm,经病理证实无癌细胞)作为检测样本,置于-80℃的冰箱中保存待检。
1.2.2 试剂与仪器TRIzol试剂购于美国Invitrogen公司,反转录试剂盒及qRT-PCR试剂盒均购于美国ABI公司,7500型qRT-PCR仪及Veriti 96孔热循环仪购于美国ABI公司,分光光度计购于美国Bio-Rad公司。
1.2.3 总RNA提取取4 mm3样本组织超声匀浆,按照TRIzol试剂盒说明书提取样本中总RNA,经DEPC水溶解,应用分光光度计测定RNA的浓度和纯度。另取1 µl RNA经1%琼脂糖凝胶电泳检测其完整性,将电泳条带清晰者用于qRT-PCR检测。
1.2.4 反转录反应按照反转录试剂盒说明书操作,采用热循环仪将长链非编码RNA HOXA11-AS反转录为cDNA,反应体系为20 µl:RNA样品2 µl、引物1 µl、5×RT buffer 4 µl、dNTP Mixture(10 mmol/L)1 µl、U6 Reverse primer 1 µl、Reverse Transcriptase 1 µl、RNase Inhibitor 0.5 µl、RNase Free H2O 9.5 µl。反应条件:65℃ 5 min,37℃ 2 min,5℃ 5 min,37℃ 10 min,65℃ 10 min。
1.2.5 实时定量反转录聚合酶链反应qRT-PCR应用Primer premier 6.0软件设计引物,并委托上海生工生物工程有限公司进行合成。长链非编码RNA HOXA11-AS:上游引物序列为:5’-GCCACAUGCACCCGCCUCAGUGGUUCACAAUGGCAUCCGCUGAA-3’,下游引物序列为:5’-CAUCAGACACAGUCCACUAUGCG-3’;内参U6引物序列为:5’-CTCGTGCAGCACAGCTC-3’(正义),5’-AGCTACAACGTATCTGTCTG-3’(反义);长链非编码RNA HOXA11-AS反转录引物序列为:5’-UCGUGAUCUGUCACUUCAAGCGAGAGAGCACUUAUGGCCCGCAUGCAGUGCAA-3’;内参U6反转录引物序列为:5’-AATCTGGTATCCGTGCCTCTAGT-3’。按照qRT-PCR试剂盒说明书操作,采用7500型qRT-PCR仪进行实时荧光定量PCR,反应体系为25 µl:已稀释的cDNA 2 µl、引物2 µl、SYBR 12.5 µl、ddH2O 8.5 µl。反应条件:95℃ 10 min,95℃ 15 s,60℃ 30 s,72℃ 10 s,共40个循环。采用2-ΔΔCt方法计算长链非编码RNA HOXA11-AS的相对表达量,以U6为内参,∆Ct=Ct长链非编码RNA HOXA11-AS-CtU6。
1.3 术后随访随访截至2019年10月,平均随访时间为(25.42±2.61)月,无失访病例。随访方式主要为门诊随访和电话随访,术后第一年每3月随访一次,第二年开始每半年随访一次,随访期内出现复发和(或)转移为病情恶化,患者死亡为随访终止事件。
1.4 统计学方法采用SPSS19.0统计软件进行操作,计量资料以(x±s)表示,组间比较采用t检验;计数资料以百分数表示,组间比较采用χ2检验。采用Kaplan-Meier法进行生存分析,采用Life-Table法计算患者术后生存率。P < 0.05为差异有统计学意义。
2 结果 2.1 长链非编码RNA HOXA11-AS在肝癌及癌旁正常组织中的表达检测结果显示,长链非编码RNA HOXA11-AS在肝癌组织中的表达明显高于癌旁正常组织(2.97±0.81 vs. 0.83±0.22, t=26.249, P < 0.001),见图 1。
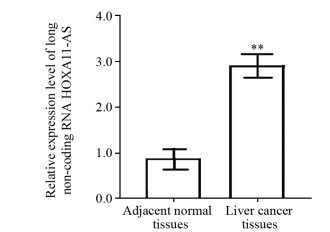
|
| **: P < 0.001, compared with adjacent normal tissues. 图 1 长链非编码RNA HOXA11-AS在组织样本中的相对表达量 Figure 1 Relative expression of lncRNA HOXA11-AS in tissue samples |
长链非编码RNA HOXA11-AS在不同AJCC分期及是否发生淋巴结转移的肝癌组织中的表达量比较差异有统计学意义(P < 0.001),见表 1。
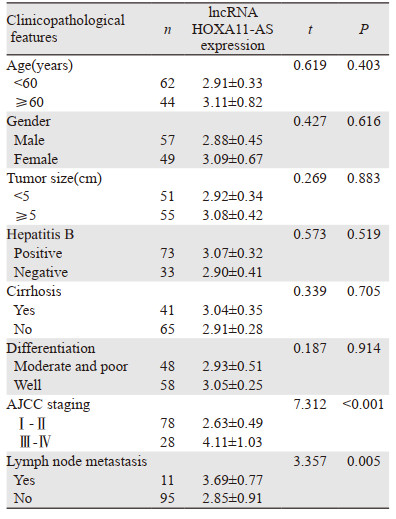
|
随访期内,106例原发性肝癌患者中51例患者病情发生恶化,其中,长链非编码RNA HOXA11-AS高表达(≥2.97)36例,低表达(< 2.97)15例。Kaplan-Meier分析结果提示,长链非编码RNA HOXA11-AS高表达组1年、2年、3年生存率均明显低于低表达组(1年:39.72% vs. 62.71%, χ2=11.715, P < 0.001; 2年:30.56% vs. 53.33%, χ2=6.029, P < 0.001; 3年:22.22% vs. 53.33%, χ2=4.760, P=0.029),见图 2。为进一步探究长链非编码RNA HOXA11-AS是否为预测原发性肝癌患者预后的独立危险因素,我们进行了单因素和多因素Cox回归分析,结果提示,长链非编码RNA HOXA11-AS高表达、AJCC分期增高是影响原发性肝癌患者预后的独立危险因素(95%CI: 1.315~4.083/0.876~3.845, P=0.017/0.022)。
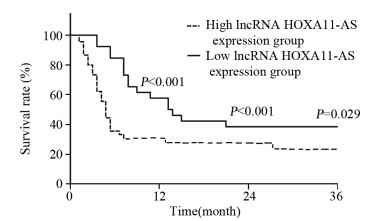
|
| 图 2 长链非编码RNA HOXA11-AS的表达与肝癌患者生存期的关系 Figure 2 Relation between lncRNA HOXA11-AS expression and survival of liver cancer patients |
肝癌为常见的恶性肿瘤,临床死亡率较高,由于早期症状较为隐匿,临床检出率较低[5]。因此,寻找肝癌早期诊断标志物成为临床关注的焦点。长链非编码RNA为不编码蛋白质的RNA,在发现初期并未获得足够重视,随着临床研究的深入,有研究发现长链非编码RNA可在表观遗传学、基因组转录及转录后等层面上调控基因的表达[6]。最近有研究显示,长链非编码RNA在肿瘤细胞增殖、迁移、凋亡等过程中发挥调控作用[7-8]。尽管目前在肝癌组织中发现了多种长链非编码RNA,但临床对于长链非编码RNA与肝癌的关系尚不明确。本研究组前期通过芯片技术发现,长链非编码RNA HOXA11-AS的表达量随肝癌的发生发展进程变化明显。因此,我们猜想长链非编码RNA HOXA11-AS有可能成为临床肝癌诊疗的新靶点。
本研究发现,长链非编码RNA HOXA11-AS在肝癌组织中高表达,且在肝癌组织中的表达明显高于癌旁正常组织。通过分析长链非编码RNA HOXA11-AS的表达与肝癌患者临床病理特征,发现其在不同AJCC分期及是否发生淋巴结转移的肝癌组织中的表达量间差异有统计学意义,结果提示,长链非编码RNA HOXA11-AS的表达与肝癌的发生及转移有关,其可能在肝癌中发挥促癌作用。张莉等[9]对24例头颈部鳞状细胞癌患者进行研究,发现长链非编码RNA HOXA11-AS在头颈部鳞状细胞癌组织中表达上调,可促进癌细胞的迁移,可能成为头颈部鳞状细胞癌治疗的新靶点。张鸿程等[10]对13例骨肉瘤患者研究发现,长链非编码RNA HOXA11-AS在骨肉瘤细胞表达下调,且长链非编码RNA HOXA11-AS的过表达可抑制骨肉瘤的发生发展,可能成为骨肉瘤治疗潜在的分子靶标。由此可见,长链非编码RNA HOXA11-AS在恶性肿瘤组织中表达异常,但其表达量在不同肿瘤中存在差异,推测这可能与肿瘤的异质性有关[11]。
本研究进一步分析了长链非编码RNA HOXA11-AS与肝癌患者预后的关系,发现长链非编码RNA HOXA11-AS高表达组3年生存率明显低于低表达组,结果提示,其高表达可能与肝癌患者预后不良有关。进一步采用单因素和多因素Cox分析发现,长链非编码RNA HOXA11-AS高表达、AJCC分期增高是影响原发性肝癌患者预后的独立危险因素,提示长链非编码RNA HOXA11-AS可作为肝癌患者预后的评价指标。
综上,肝癌组织中长链非编码RNA HOXA11-AS表达上调,其可能参与肝癌的发生发展,可成为肝癌患者预后评估的新指标。
作者贡献
李菠:论文撰写
吕明:术者及肝癌标本收集
周帅:患者信息、临床数据收集及处理
| [1] |
邢燕来, 王晓磊. 射频消融技术联合TACE诱导肝癌细胞凋亡的机制[J]. 肝脏, 2019, 24(5): 525-527. [Xing YL, Wang XL. Mechanism of radiofrequency ablation combined with TACE inducing apoptosis of liver cancer cells[J]. Gan Zang, 2019, 24(5): 525-527.] |
| [2] |
丁帅, 高延征, 张广泉, 等. 长链非编码RNA肝癌高表达转录本对骨肉瘤细胞放射敏感性的影响[J]. 中华放射医学与防护杂志, 2019, 39(7): 487-492. [Ding S, Gao YZ, Zhang GQ, et al. Effects of overexpressing transcripts of lncRNA on liver radiosensitivity of osteosarcoma cells[J]. Zhonghua Fang She Yi Xue Yu Fang Hu Za Zhi, 2019, 39(7): 487-492.] |
| [3] |
张国强, 刘顺, 曾小云, 等. LINC00598在肝细胞肝癌组织中的表达及其临床意义[J]. 广西医科大学学报, 2018, 35(6): 804-809. [Zhang GQ, Liu S, Zeng XY, et al. Expression of LINC00598 in hepatocellular carcinoma and its clinical significance[J]. Guangxi Yi Ke Da Xue Xue Bao, 2018, 35(6): 804-809.] |
| [4] |
段艺菲, 赵清喜, 荆雪. 长链非编码RNA对原发性肝癌中糖酵解途径的影响机制[J]. 临床肝胆病杂志, 2019, 35(6): 1374-1376. [Duan YF, Zhao QX, Jing X. Effect of long non-coding RNA on glycolytic pathway in primary liver cancer[J]. Lin Chuang Gan Dan Bing Za Zhi, 2019, 35(6): 1374-1376.] |
| [5] |
管文彩, 张凌云, 林群博, 等. 长链非编码RNA在肝癌化疗耐药中的研究进展[J]. 肝脏, 2018, 23(6): 543-545. [Guan WC, Zhang LY, Lin QB, et al. Research progress on lncRNA in chemotherapy resistance of liver cancer[J]. Gan Zang, 2018, 23(6): 543-545.] |
| [6] |
罗娇, 杜梅, 骆文龙. 长链非编码RNA在头颈肿瘤转移中的研究进展[J]. 国际耳鼻咽喉头颈外科杂志, 2019, 43(1): 10-13. [Luo J, Du M, Luo WL. Research progress on lncRNA in head and neck tumor metastasis[J]. Guo Ji Er Bi Yan Hou Tou Jing Wai Ke Za Zhi, 2019, 43(1): 10-13.] |
| [7] |
汤利, 郭永连, 陈琳, 等. 长链非编码RNA HOXA末端转录本反义RNA在膀胱癌中的表达及其对膀胱癌细胞增殖、迁移与侵袭的影响[J]. 中华实验外科杂志, 2019, 36(4): 682-684. [Tang L, Guo YL, Chen L, et al. Expression of lncRNA HOXA terminal transcript antisense RNA in bladder cancer and its effect on bladder cancer cell proliferation, migration and invasion[J]. Zhonghua Shi Yan Wai Ke Za Zhi, 2019, 36(4): 682-684.] |
| [8] |
Zhang Y, Yuan Y, Li Y, et al. An inverse interaction between HOXA11 and HOXA11-AS is associated with cisplatin resistance in lung adenocarcinoma[J]. Epigenetics, 2019, 14(10): 949-960. DOI:10.1080/15592294.2019.1625673 |
| [9] |
张莉, 伍靖, 李晓宇. 长链非编码RNA HOXA11-AS表达对头颈部鳞状细胞癌细胞迁移和患者预后的影响[J]. 新乡医学院学报, 2018, 35(4): 310-313. [Zhang Li, Wu J, Li XY. Effect of lncRNA HOXA11-AS expression on head and neck squamous cell carcinoma cell migration and patient prognosis[J]. Xinxiang Yi Xue Yuan Xue Bao, 2018, 35(4): 310-313.] |
| [10] |
张鸿程, 宋广元, 谈伟健, 等. LncRNAHOXA11-AS对骨肉瘤细胞增殖、迁移和侵袭能力的影响[J]. 中国肿瘤生物治疗杂志, 2017, 24(5): 497-502. [Zhang HC, Song GY, Tan WJ, et al. Effects of lncRNAHOXA11-AS on the proliferation, migration and invasion of osteosarcoma cells[J]. Zhongguo Zhong Liu Sheng Wu Zhi Liao Za Zhi, 2017, 24(5): 497-502.] |
| [11] |
Qu L, Jin M, Yang L, et al. Expression of long non-coding RNA HOXA11-AS is correlated with progression of laryngeal squamous cell carcinoma[J]. Am J Transl Res, 2018, 10(2): 573-580. |
 2020, Vol. 47
2020, Vol. 47
