文章信息
- 长链非编码RNA FOXD2-AS1对胃癌细胞增殖、侵袭和转移的影响及其机制
- Effect and Mechanism of lncRNA FOXD2-AS1 on Proliferation, Invasion and Metastasis of Gastric Cancer Cells
- 肿瘤防治研究, 2020, 47(8): 583-589
- Cancer Research on Prevention and Treatment, 2020, 47(8): 583-589
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1502
- 收稿日期: 2019-12-10
- 修回日期: 2020-02-13
胃癌是世界上最常见的恶性肿瘤之一,Bray等[1]对全球185个国家36种癌症进行统计分析显示:胃癌每年新发病例约100多万,约占癌症新发病例6%,居恶性肿瘤中第六位。中国是胃癌高发国家,每年新发病例数约40万,占全世界40%左右[2]。目前胃癌在全球范围内呈高发趋势,主要集中于中国、日本、韩国等东亚国家,已经严重威胁到了人类的健康[3],探究促进胃癌发生发展的新机制,探索胃癌治疗的新方法意义重大。
长链非编码RNA(long-chain non-coding RNA, lncRNA)是长度在200~100 000 nt之间的RNA分子,近年来越来越多的研究发现其在染色体沉默、染色质表观遗传学修饰、基因转录、蛋白翻译及定位等各方面发挥了重要的作用[4]。据文献报道:lncRNA FOXD2-AS1在结直肠癌[5]、食管癌[6]、肺癌[7]、肝癌[8]等多种癌症中高表达,并参与肿瘤的发生、增殖、迁移、侵袭及化疗抵抗等生物学过程。本研究通过临床组织标本验证lncRNA FOXD2-AS1的表达情况与患者临床病理资料的关系,并在体外实验中研究其在促进胃癌发展的作用及可能的机制。
1 材料与方法 1.1 实验材料人正常胃癌上皮细胞系GES-1、人胃癌细胞系BGC-823、AGS、MGC-803、MKN45、MKN-74由湖南省中医药大学基础医学院实验室馈赠,E-Cadherin(Cat: 10204-MM08)及N-cadherin(Cat: 11039-R020)抗体购自义翘神州有限公司、Vimentin抗体购自美国CST公司(#5741)、β-catenin(ab32572)及Cyclin-D1(ab16663)抗体购自美国Abcam公司,GAPDH(Cat: 10494-1-AP)一抗购自美国Proteintech公司,鼠二抗及兔二抗均购自上海优宁维生物公司,RPMI1640及胎牛血清(FBS)均购自于以色列BI公司,RNA提取试剂盒、反转录试剂盒及qRT-PCR试剂盒均购自北京全式金生物技术有限公司,RNA保护液及转染试剂Lipofectamine3000 Transfection Reagent购自美国赛默飞公司,lncRNA FOXD2-AS1小干扰RNA序列及对照序列均由苏州吉玛基因股份有限公司合成,GAPDH及lncRNA FOXD2-AS1引物由湖南擎科生物技术有限公司合成。
1.2 实验方法 1.2.1 大数据应用在GEPIA在线数据库中(http://gepia.cancer-pku.cn)分析LncRNA FOXD2-AS1在胃癌中的表达情况;从TCGA数据库中下载胃癌患者资料,分析lncRNA FOXD2-AS1的表达情况、在K-M在线分析数据库(http://kmplot.com)分析lncRNA FOXD2-AS1的表达情况及与患者肿瘤分期关系。
1.2.2 胃癌组织RNA提取选取2018年9月—2019年3月30例在湖南中医药大学第一附属医院行胃癌根治术患者新鲜标本,患者均知情同意,并获得医学伦理委员会批准。在标本离体30 min内将标本收取并剪成1 mm3小块置于RNA保护液中,放入液氮保存,提取RNA前将组织从液氮中取出,放入液氮预冷的研钵中研碎,参照RNA提取试剂盒说明书提取组织RNA,并测定浓度,选取OD260/OD280值在1.9~2.1之间的RNA进行后续实验,保证RNA的完整性,参照反转录试剂盒将RNA合成cDNA,细胞样本RNA提取方法同上。
1.2.3 细胞培养及分组人胃癌细胞系BGC-823培养于含10%的胎牛血清、1% 100 μg/ml青霉素及100 μg/ml链霉素的RPMI 1640完全培养基中,置于37℃、5%CO2培养箱中培养。将人胃癌细胞系BGC-823分别转染siRNA-A、siRNA-B以及siRNA-NC,分为siRNA-A组、siRNA-B组及siRNA-NC组。lncRNA FOXD2-AS1 siRNA-A序列正义链:5'-GCGAAGAGUACGUUGCUAUTT-3';反义链:5'-AUAGCAACGUACUCUUCGCTT-3';lncRNA FOXD2-AS1 siRNA-B序列正义链:5'-GUUCGAGAGUGAAUUUACATT-3';反义链:5'-UGUAAAUUCACUCCUCGAACTT-3';阴性对照序列正义链:5'-UUCUCCGAACGUGUCACGUTT-3';反义链:5'-ACGUGACACGUUCGGAGAATT-3'。转染方法参照Lipofectamine3000 Transfection Reagent说明书及干扰序列说明书进行。
1.2.4 qRT-PCR实验提取组织及细胞样本RNA,将RNA反转录成cDNA,参照qRT-PCR试剂盒说明书采用qPCR三步法进行实验,实验条件:在94℃预变性30 s,94℃ 5 s,60℃ 15 s,72℃ 10 s,进行40个循环扩增,利用GAPDH作为内参,定量采用2-ΔΔCt法,计算胃癌各细胞系、癌组织与癌旁组织以及siRNA-A组、siRNA-B组及阴性对照组中lncRNA FOXD2-AS1相对表达量。GAPDH引物序列:上游引物:5'-GAGTCAACGGATTTGGTCGT-3';下游引物:5'-GACAAGCTTCCCGTTCTCAG-3';lncRNA FOXD2-AS1引物序列:上游引物:5'-CCGCGTAAGCCTCATAGAAG-3';下游引物:5'-GGGAGTAGGGTGAGGAAAGG-3'。
1.2.5 细胞增殖能力检测采用CCK8比色法测定lncRNA FOXD2-AS1 siRNA-A组、siRNA-B组及阴性对照组细胞增殖能力。将三组细胞以3 000个/孔种植于96孔板中,分别于培养0、24、48、72和96 h后,吸尽培养基,每孔加入含10%CCK8试剂的RPMI 1640溶液100 μl,2 h后在450 nm波长下,利用酶标仪测定吸光度,实验重复三次,取平均值并绘制增殖曲线。采用平板克隆形成实验检测细胞增殖及克隆形成能力。胰酶消化,充分打匀并计数,6孔板中加入2 ml完全培养基,每孔加入400个细胞,当培养皿中出现肉眼可见的克隆时终止培养,甲醇固定15 min,0.1%结晶紫溶液染色30 min后肉眼计数克隆数,克隆形成率=克隆数/接种细胞数×100%,实验重复三次,取平均值。
1.2.6 细胞迁移能力测定预先用记号笔在6孔板背后每隔0.5 cm划一道线。培养人胃癌BGC-823细胞株至对数期,并按5×105个/孔接种于6孔板,37℃细胞培养箱内培养过夜,第二天待细胞长满,用200 μl枪头垂直于画线进行划痕,并用PBS洗两次,分别加入含无血清培养基,并于显微镜下拍照,记录0 h划痕位置及宽度,培养箱内继续培养24 h后与0 h同一位置进行拍照,并计算划痕愈合率,愈合率=(0 h划痕宽度-24 h划痕宽度)/(0 h划痕宽度),实验重复3次,取平均值。
1.2.7 细胞侵袭能力测定采用Transwell实验检测细胞侵袭能力,将三组细胞消化吹打匀,并用不含血清的RPMI 1640培养基重悬,将细胞密度调整到1.5×104个/毫升,取200 μl细胞悬液接种于Transwell小室上室,下室加入含10%FBS的完全培养基,培养24 h后,PBS轻洗两遍,用甲醇固定细胞,用棉签擦拭掉上室细胞,将下室细胞采用0.1%结晶紫溶液染色,染色30 min后显微镜200倍视野下,分别取左上、左下、右上、右下以及中间五个视野,计算穿膜细胞数,实验重复三次,取平均值。
1.2.8 蛋白印迹(Western blot)实验提取lncRNA FOXD2-AS1 siRNA-A组、siRNA-B组及阴性对照组细胞总蛋白,裂解并变性,电泳条件:浓缩胶80 V至蛋白Marker分离后,加大电压至溴酚蓝跑至胶底;转膜条件:300 mA转80 min,脱脂奶粉室温封闭1 h,加入相应一抗,4℃过夜,二抗室温孵育1 h,ECL液显影,并计算灰度值,实验重复三次。
1.3 统计学方法数据用SPSS21.0统计分析软件处理,计量资料用均数±标准差(x±s)表示,组间两两比较经单因素方差分析,若符合方差齐性正态性分布采用t检验,若不符合则用秩和检验,组间重复测量数据分析采用重复测量设计的方差分析,率的比较或构成比比较采用四格表卡方检验,P < 0.05为差异有统计学意义。
2 结果 2.1 lncRNA FOXD2-AS1在胃癌组织中的表达及与临床病理因素的关系GEPIA数据库在线分析显示lncRNA FOXD2-AS1在胃癌组织中较癌旁组织中高表达(P=0.000),见图 1A;K-M(Kaplan-Meier Plotter(http://kmplot.com))数据库在线分析显示:lncRNA FOXD2-AS1的表达与患者的不良预后密切相关(P=0.000),见图 1B;取30例胃癌根治术患者标本提取RNA行qRT-PCR结果显示:lncRNA FOXD2-AS1在癌组织中表达较癌旁组织显著增高,差异具有统计学意义(P=0.000),见图 1C。
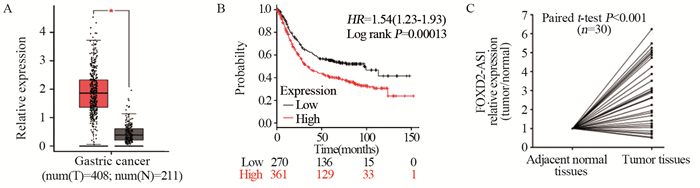
|
| A: lncRNA FOXD2-AS1 expression in gastric cancer tissues analyzed based on GEPIA database, *: P<0.01; B: the relation between lncRNA FOXD2-AS1 expression and the prognosis of patients analyzed based on K-M database; C: relative expression of lncRNA FOXD2-AS1 in gastric cancer and adjacent normal tissues. 图 1 IncRNA FOXD2-AS1在胃癌组织中的表达及与患者预后的关系 Figure 1 lncRNA FOXD2-AS1 expression in gastric cancer tissues and its relation with patients' prognosis |
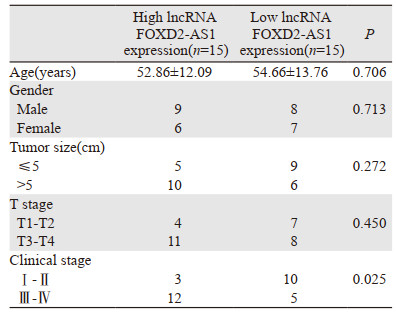
我们以lncRNA FOXD2-AS1中位表达量(2.883)为界,将患者分为lncRNA FOXD2-AS1高表达组及低表达组(每组各15例),并与患者临床一般资料及病理资料比较,结果显示lncRNA FOXD2-AS1的表达与肿瘤分期相关(P=0.025),与患者年龄、性别、肿瘤大小及浸润深度无关(均P > 0.05),见表 1。
|
qRT-PCR检测lncRNA FOXD2-AS1在各细胞系中表达情况,将GES-1细胞系相对表达量设为1,计算各胃癌细胞系较GES-1细胞系lncRNA FOXD2-AS1相对表达量,实验重复3次。qRT-PCR结果显示:胃癌细胞系AGS、BGC-823、MGC-803、MKN-45、MKN-74细胞系相对表达量分别为2.43±0.14(P=0.000)、4.38±0.18(P=0.000)、1.73±0.08(P=0.001)、1.87±0.11(P=0.0002)、2.07±0.14(P=0.0002),各胃癌细胞系中lncRNA FOXD2-AS1相对表达量均明显高于胃正常上皮细胞系GES-1(均P < 0.05),其中BGC-823细胞系lncRNA FOXD2-AS1相对表达量最高,见图 2。
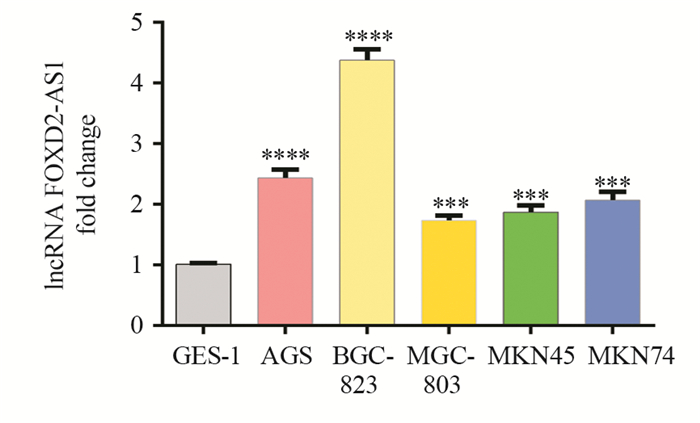
|
| ***: P<0.0001, ****: P<0.00001, compared with GES-1 cells. 图 2 lncRNA FOXD2-AS1在不同胃癌细胞系中的表达 Figure 2 lncRNA FOXD2-AS1 expression in different gastric cancer cell lines |
FOXD2-AS1的小干扰RNA(siRNA-A、siRNA-B)及阴性对照序列(siRNA-NC)后,qRT-PCR验证lncRNA FOXD2-AS1表达情况,结果显示:将阴性对照组lncRNA FOXD2-AS1相对表达量设为1,与阴性对照组相比,FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组lncRNA FOXD2-AS1相对表达量为0.37±0.05(P=0.000)、0.30±0.02(P=0.000),说明两组lncRNA FOXD2-AS1的沉默效率均大于60%,与阴性对照组相比显著下降(均P < 0.05),两组siRNA均可为后续实验所用,见图 3A。
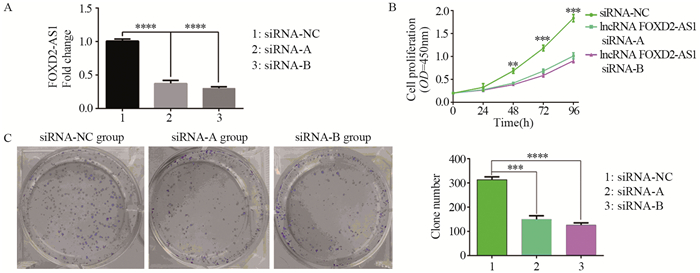
|
| **: P<0.001, ***: P<0.0001, ****: P<0.00001. 图 3 lncRNA FOXD2-AS1沉默效率验证(A)、CCK8增殖实验(B)及细胞平板克隆形成实验(C)结果 Figure 3 Results of lncRNA FOXD2-AS1 silencing efficiency verification(A), CCK8 proliferation experiment (B) and cell plate clone formation experiment(C) |
单因素方差分析显示,转染24 h内各组OD值差异无统计学意义(P=0.379),转染48、72和96 h后,各组细胞OD值差异具有统计学意义(均P=0.000),且siRNA-NC组增殖速度较FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组明显增快,见图 3B。
2.3.3 平板克隆形成实验结果siRNA-NC组、FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组克隆形成数目分别为313.3±12.01、149.6±14.7、126.3±8.7个,克隆形成率分别约78.2%、37.5%和31.5%,经单因素方差分析,差异具有统计学意义(P=0.000),且siRNA-NC组克隆形成率明显高于FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组,见图 3C。
2.4 lncRNA FOXD2-AS1基因沉默对胃癌细胞系BGC-823的迁移和侵袭能力的影响 2.4.1 划痕实验结果siRNA-NC组、FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组24 h划痕愈合率分别为(74.7±1.7)%、(49.7±2.2)%、(39.6±1.4)%,经单因素方差分析,差异具有统计学意义(P=0.000)。且FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组划痕愈合率明显低于阴性对照组,见图 4A。

|
| ***: P<0.0001, ****: P<0.00001. 图 4 划痕实验(A)和Transwell小室侵袭实验(B)结果 Figure 4 Results of wound healing assay(A) and Transwell test(B) |
siRNA-NC组、FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组穿透基质胶到达下室的细胞数分别为423.0±19.5、279.7±15.6、229.0±10.8,经单因素方差分析,差异具有统计学意义(P=0.000),FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组侵袭细胞数明显少于阴性对照组,见图 4B。
2.5 lncRNAFOXD2-AS1基因沉默对Wnt/β-catenin通路关键蛋白及下游蛋白的影响以及对EMT相关蛋白的影响
qRT-PCR及Western blot实验结果显示:FOXD2-AS1 siRNA-A组与FOXD2-AS1 siRNA-B组中E-cadherin的表达较阴性对照siRNA-NC组显著增高,差异具有统计学意义(P=0.000),而N-cadherin、Vimentin、β-catenin与Cyclin D1的表达量较阴性对照siRNA-NC组均显著降低,差异具有统计学意义(均P=0.000),见图 5。
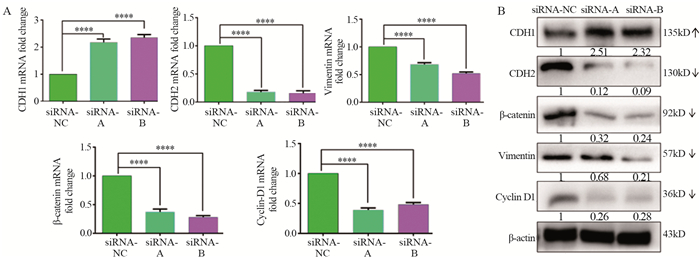
|
| ***: P<0.0001, ****: P<0.00001. 图 5 沉默lncRNA FOXD2-AS1对Wnt/β-catenin通路相关蛋白及EMT相关蛋白qRT-PCR实验(A)和Western blot实验(B)验证结果 Figure 5 Effect of lncRNA FOXD2-AS1 silencing on expression of Wnt/β-catenin pathway related proteins and EMT-related proteins detected by qRT-PCR(A) and Western blot(B) |
研究报道多种lncRNA与胃癌的发生发展密切相关。Xu等[9]报道lncRNA PVT1与FOXM1的正反馈调节调控胃癌的增殖及侵袭转移。Yan等[10]发现lncRNA SNHG6通过沉默P27蛋白的表达以及吸附miR-101-3p来调节ZEB1表达从而促进胃癌细胞的增殖及EMT,影响胃癌患者的临床预后。Zhang等[11]发现HNRNPKP2通过调控CXCR4的表达从而促进胃癌的肝转移;影响胃癌发生发展的lncRNA还包括lncRNA ZFPM2-AS1[12]、lncRNA ELIT-1[13]、lncRNA LINC00346[14]等,lncRNA在胃癌增殖、细胞周期调控、侵袭、转移及血管生成等方面都发挥了重要的调控作用。
lncRNA FOXD2-AS1在多种肿瘤中高表达,并与患者的病理分期及临床预后密切相关。在肝癌中,lncRNA FOXD2-AS1可以通过招募EZH2到p27基因的启动子上,调控p27基因表达,从而促进肝癌发展[15]。在神经胶质瘤中,lncRNA FOXD2-AS1可以吸附miRNA-185-5p,并通过PI3K/AKT通路促进肿瘤的增殖及侵袭转移[16]。lncRNA FOXD2-AS1作为一个重要的癌基因,在不同的癌症中其作用也不尽相同。本研究发现lncRNA FOXD2-AS1在胃癌组织中较癌旁组织中明显升高,数据挖掘结果显示其高表达与胃癌的预后相关,同样在我们的样本中发现其表达与胃癌的病理分期相关,这表明lncRNA FOXD2-AS1可能促进了胃癌的进展。进一步体外实验研究发现:在胃癌BGC-823细胞系中抑制lncRNA FOXD2-AS1的表达可显著抑制BGC-823细胞的增殖、克隆形成、迁移及侵袭能力。在进一步机制探索中我们发现,抑制lncRNA FOXD2-AS1的表达可以抑制N-cadherin与Vimentin的表达,促进E-cadherin的表达,同时抑制Wnt/β-catenin通路关键蛋白β-catenin以及下游蛋白Cyclin D1的表达,结果提示抑制lncRNA FOXD2-AS1可能通过抑制Wnt/β-catenin通路的激活,从而抑制胃癌细胞EMT的发生降低胃癌细胞的侵袭和转移能力,研究结果与Huang等研究发现EphA2通过Wnt/β-catenin通路促进胃癌侵袭转移相符[17]。
本实验尚存在一些不足之处:(1)在验证胃癌组织及癌旁组织表达情况与患者病理分期时只收集了30例患者的标本及信息,样本量较小,这也可能是导致lncRNA FOXD2-AS1的表达仅与临床分期相关,而与肿瘤大小及浸润深度无明显差异的原因之一,后续实验需进一步扩大样本量;(2)lncRNA FOXD2-AS1调控Wnt/β-catenin通路的确切机制仍不清楚,还需进一步机制研究。
综上所述,lncRNA FOXD2-AS1在胃癌组织及胃癌细胞系中高表达,与患者肿瘤临床分期和预后相关,抑制其表达可通过抑制Wnt/β-catenin通路的激活,抑制胃癌细胞EMT的发生,降低胃癌细胞的增殖及迁移侵袭能力,lncRNA FOXD2-AS1可作为胃癌潜在的治疗靶点及临床预后标志物。
作者贡献
袁正泰:研究设计、实施以及论文撰写
王永恒:研究设计以及论文修改
黄湘俊:研究设计、实施以及论文审核
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386. DOI:10.1002/ijc.29210 |
| [4] |
Akhade VS, Pal D, Kanduri C. Long Noncoding RNA: Genome Organization and Mechanism of Action[J]. Adv Exp Med Biol, 2017, 1008: 47-74. |
| [5] |
Zhu Y, Qiao L, Zhou Y, et al. Long non-coding RNA FOXD2-AS1 contributes to colorectal cancer proliferation through its interaction with microRNA-185-5p[J]. Cancer Sci, 2018, 10(9): 2235-2242. |
| [6] |
Bao J, Zhou C, Zhang J, et al. Upregulation of the long noncoding RNA FOXD2-AS1 predicts poor prognosis in esophageal squamous cell carcinoma[J]. Cancer Biomark, 2018, 21(3): 527-533. DOI:10.3233/CBM-170260 |
| [7] |
Rong L, Zhao R, Lu J. Highly expressed long non-coding RNA FOXD2-AS1 promotes non-small cell lung cancer progression via Wnt/β-catenin signaling[J]. Biochem Biophys Res Commun, 2017, 484(3): 586-591. |
| [8] |
Chang Y, Zhang J, Zhou C, et al. Long non-coding RNA FOXD2-AS1 plays an oncogenic role in hepatocellular carcinoma by targeting miR-206[J]. Oncol Rep, 2018, 40(6): 3625-3634. |
| [9] |
Xu MD, Wang Y, Weng W, et al. A Positive Feedback Loop of lncRNA-PVT1 and FOXM1 Facilitates Gastric Cancer Growth and Invasion[J]. Clin Cancer Res, 2017, 23(8): 2071-2080. DOI:10.1158/1078-0432.CCR-16-0742 |
| [10] |
Yan K, Tian J, Shi W, et al. LncRNA SNHG6 is Associated with Poor Prognosis of Gastric Cancer and Promotes Cell Proliferation and EMT through Epigenetically Silencing p27 and Sponging miR-101-3p[J]. Cell Physiol Biochem, 2017, 42(3): 999-1012. |
| [11] |
Zhang Y, Zhang Qi, Zhang M, et al. DC-SIGNR by influencing the lncRNA HNRNPKP2 upregulates the expression of CXCR4 in gastric cancer liver metastasis[J]. Mol Cancer, 2017, 16(1): 78. |
| [12] |
Kong F, Deng X, Kong X, et al. Correction: ZFPM2-AS1, a novel lncRNA, attenuates the p53 pathway and promotes gastric carcinogenesis by stabilizing MIF[J]. Oncogene, 2018, 37(45): 6010. DOI:10.1038/s41388-018-0412-z |
| [13] |
Sakai S, Ohhata T, Kitagawa K, et al. Long noncoding RNA ELIT-1 acts as a Smad3 cofactor to facilitate TGF-β/Smad signaling and promote epithelial-mesenchymal transition[J]. Cancer Res, 2019, 79(11): 2821-2838. DOI:10.1158/0008-5472.CAN-18-3210 |
| [14] |
Xu TP, Ma P, Wang WY, et al. KLF5 and MYC modulated LINC00346 contributes to gastric cancer progression through acting as a competing endogeous RNA and indicates poor outcome[J]. Cell Death Differ, 2019, 26(11): 2179-2193. DOI:10.1038/s41418-018-0236-y |
| [15] |
Xu K, Zhang Z, Qian J, et al. LncRNA FOXD2-AS1 plays an oncogenic role in hepatocellular carcinoma through epigenetically silencing CDKN1B(p27) via EZH2[J]. Exp Cell Res, 2019, 380(2): 198-204. DOI:10.1016/j.yexcr.2019.04.016 |
| [16] |
Ni W, Xia Y, Bi Y, et al. FoxD2-AS1 promotes glioma progression by regulating miR-185-5P/HMGA2 axis and PI3K/AKT signaling pathway[J]. Aging (Albany NY), 2019, 11(5): 1427-1439. |
| [17] |
Huang J, Xiao D, Li G, et al. EphA2 promotes epithelial-mesenchymal transition through the Wnt/β-catenin pathway in gastric cancer cells[J]. Oncogene, 2014, 33(21): 2737-2747. DOI:10.1038/onc.2013.238 |
 2020, Vol. 47
2020, Vol. 47


