文章信息
- 碳离子和质子治疗胰腺癌安全性和有效性的系统评价及Meta分析
- Safety and Efficacy of Carbon Ion and Proton Therapies for Pancreatic Cancer: A Systematic Review and Meta-analysis
- 肿瘤防治研究, 2020, 47(7): 504-510
- Cancer Research on Prevention and Treatment, 2020, 47(7): 504-510
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1482
- 收稿日期: 2019-11-28
- 修回日期: 2020-03-31
2. 730000 兰州,中国科学院近代物理研究所生物医学中心;
3. 730000 兰州,兰州重离子医院;
4. 730000 兰州,兰州大学基础医学院
2. Biomedical Center, Institute of Modern Physics, Chinese Academy of Science, Lanzhou 730000, China;
3. Lanzhou Heavy Ion Hospital, Lanzhou 730000, China;
4. School of Basic Medical Sciences, Lanzhou University, Lanzhou 730000, China
胰腺癌(pancreatic cancer, PaC)在美国和中国居民癌症致死率分别居第4和第6位[1-2]。近年来PaC发病率、死亡率上升趋势明显,预计至2030年其死亡率将居癌症死亡率第2位[3]。据美国癌症协会最新统计数据,PaC患者确诊后5年存活率仅7%;虽然Ⅰ期或局限性PaC生存率已提高至25%,但仅有9%的患者能在此阶段被确诊[4]。
虽然PaC的治疗已形成了手术、放化疗、精准治疗、免疫治疗等多元化选择方式,但其临床疗效并未取得进阶式改善。目前手术仍是治疗PaC的主要方法,但大多数初诊患者就诊时已属晚期,丧失了手术机会。即使早期、交界性或局部进展期PaC接受手术治疗后,其5年OS仍低于20%[5-6]。PaC放疗的临床效果显著,是国际公认的治疗方法[7],碳离子和质子作为新兴起的放疗技术已用于治疗PaC。质子是带正电的粒子,在射束路径上到达射程终末时能量全部释放(即Bragg峰)。相比于质子,碳离子不仅有Bragg峰[8],而且具有更好的放射生物学效应即直接破坏DNA,因此对肿瘤细胞杀灭能力更强[9]。与传统的光子放疗相比,碳离子和质子理论上在相同剂量/分次作用下对细胞的杀伤作用更强,对邻近组织放射性毒副作用更小。然而,碳离子和质子在PaC中的应用有限,目前国内尚缺少碳离子和质子治疗PaC的安全性和有效性评价。本文收集碳离子和质子治疗PaC的研究,以评价其安全性及有效性,旨在为PaC放疗提供参考及证据支持。
1 资料与方法 1.1 文献检索策略基于PRISMA方法,检索PubMed、The Cochrane Library、Web of Science、Embase、维普数据(VIP)、中国生物医学文献服务系统(SinoMed, CBM)、中国知网(CNKI)和万方数据资源系统等数据库,搜集碳离子和质子治疗PaC的研究,检索时间为自建库至2019年6月,并追溯纳入研究的参考文献,以全面获取文献。
中文检索词:胰腺癌、胰腺肿瘤、胰腺恶性肿瘤、碳离子治疗、碳离子放疗、质子治疗、质子放疗。英文检索词:pancreatic neoplasm、pancreas neoplasm*、pancreas cancer*、pancreatic cancer*、heavy ion、heavy ion radiotherapy、heavy ion radiotherapies、heavy ion therapy、heavy ion therapies、heavy ion radiation therapy、carbon ion radiotherapy、carbon ion therapy、carbon ion therapies、carbon ion radiation therapy、proton therapies、proton beam therapy、proton beam therapies、proton beam radiation therapy。以CBM为例,中文检索式为(胰腺癌OR胰腺肿瘤OR胰腺恶性肿瘤)AND(碳离子治疗OR碳离子放疗OR质子治疗OR质子放疗),并行主题词检索。
1.2 纳入、排除标准纳入标准:(1)PaC诊断符合世界卫生组织(WHO)诊断标准,语种、患者性别、年龄、种族等不限;(2)干预措施,所有类型碳离子和质子治疗,分级、技术或治疗设备等不限,但不包括手术干预。排除标准:(1)有腹部放疗史或并存第二原发肿瘤的患者;(2)样本量 < 10例的研究;(3)原文不规范或数据不全;(4)重复发表的研究,只选择样本量最大、最新发表或报告最全面数据的研究。
1.3 结局指标安全性结局指标包括不良反应发生率和不良事件发生率。不良反应根据常见不良反应术语评定标准(common terminology criteria for adverse events, CTCAE)4.0版/3.0版分为5级,本研究重点关注2级及以上放射性胃肠道溃疡、厌食症、放射性皮炎等不良反应。疗效结局指标包括总生存率(overall survival, OS)、局部控制率(local control, LC)、无局部进展率(freedom from local progression, FFLP)、局部复发率(local recurrence, LR)和第二原发性恶性肿瘤(SMN,指因放射治疗诱发的原发性恶性肿瘤)发生率。
1.4 文献筛选、资料提取及文献质量评价文献筛选、资料提取由两位评价员独立完成,结果由第三位评价员核对,如遇分歧,上述三位评价员经讨论后共同决定。资料提取内容:(1)纳入研究的基本信息:发表期刊、年份和国家,研究作者、研究类型和时间等;(2)研究对象的基本特征:研究的样本量,患者年龄、性别和疾病类型等;(3)干预措施:碳离子和质子治疗的总剂量和分次剂量等;(4)结局指标:安全性结局指标和疗效结局指标;(5)偏倚风险评价的关键要素。
两位评价员对纳入的研究进行质量评价,两者评分不一致的条目则由第三名评价员决定最终评分。非随机对照试验采用Cochrane DTA工作组标准(共9条)进行文献质量评价,0分:未报告,1分:报告了但不充分,2分:报告且充分,总分 < 9分为偏倚风险高。病例系列是涉及对多例患者同一种干预、疾病和(或)结局描述的无对照观察性研究,病例系列采用病例系列报告偏倚评价工具评定,以“是”、“否”和“不清楚”作答,满足7个及以上条目为偏倚风险低[10]。鉴于该评价工具的23条标准过于繁琐,本文精简为8条。
1.5 统计学方法采用STATA12.0和MetaAnalyst Beta3.13软件进行Meta分析,OS、LC、FFLP、不良反应发生率等率的效应量采用卡方检验分析统计学异质性,根据Cochrane系统评价指导手册,异质性显著性水平设定为P=0.1、I2=50%:当P > 0.1且I2≤50%时,各研究结果间的异质性可接受,此时采用固定效应模型进行合并;当P≤0.1和(或)I2 > 50%时,通过亚组分析和回归分析尽量找出异质性来源,若找不到异质性来源,则采用随机效应模型进行数据合并。
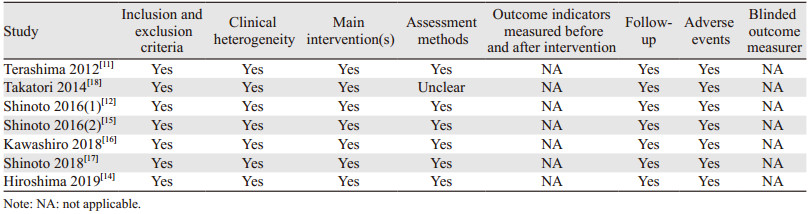
2 结果 2.1 文献筛选流程及结果初检共有721篇相关文献,最终纳入8篇文献(包含459例PaC患者),其中7项研究符合Meta分析需求,见图 1。

|
| 图 1 文献筛选流程及结果 Figure 1 Flow chart of literature screening |
纳入的8篇文献均为英文文献,最早发表于2012年,最近发表于2019年,提示此类研究起步较晚、数量较少、进展缓慢。据文献发表年中国科学院文献情报中心JCR期刊分区,8篇文献中仅1篇发表于医学分区3区杂志(Pancreatology, IF=2.58),其余7篇均发表于2区杂志(4.02 < IF < 5.58),其中4篇发表于该领域权威杂志Radiother Oncol,一定程度上反映出学术界对碳离子和质子治疗PaC科研价值的肯定。
纳入的8项研究共包含459例患者,男性245例(53.38%),女性214例(46.62%),平均样本量46例,最小样本量10例,最大样本量91例;4项研究采用回顾性设计,3项为前瞻性研究,1项为非随机对照临床试验,所有研究均无报告脱落,见表 1。
Maemura 2017[13]为非随机对照试验,Cochrane DTA工作组标准最后评分为12分,提示偏倚风险低。其余7项研究均为病例系列,病例系列报告偏倚评价工具评定结果显示,所有文献偏倚风险较低,见表 2。
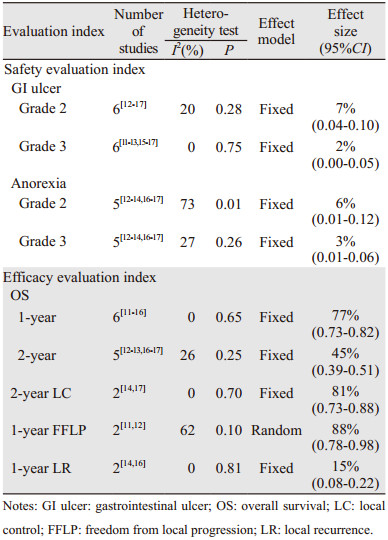
7篇文献[11-17]报道了2级及以上胃肠道溃疡发生情况,其中6篇文献[12-17]报道2级胃肠道溃疡发生率分别为10%(7/72)、10%(1/10)、2%(1/42)、16%(9/58)、4%(3/72)、6%(4/64),固定效应模型Meta分析显示,2级胃肠道溃疡发生率为7%(95%CI: 4%~10%)。6篇文献[11-13, 15-17]报道3级胃肠道溃疡发生率分别为8%(4/50)、1%(1/72)、10%(1/10)、2%(1/58)、1%(1/72)、3%(2/64),固定效应模型Meta分析显示,3级胃肠道溃疡发生率为2%(95%CI: 0~5%)。此外,Terashima[11]报道了1例在接受70.2GyE/26 Fx放疗后出现4级胃肠道溃疡的患者,8项研究均无5级胃肠道溃疡的报道。
5篇文献[12-14, 16-17]报道了2级及以上厌食症发生情况,其中2级厌食症发生率分别为17%(12/72)、0(0/10)、2%(1/42)、8%(6/72)、3%(2/64);3级厌食症发生率分别为8%(6/72)、0(0/10)、2(1/42)、3%(2/72)、2%(1/64),固定效应模型Meta分析显示,2级厌食症发生率为6%(95%CI: 1%~12%),3级厌食症发生率为3%(95%CI: 1%~6%);所有研究4级厌食症发生率均为0,见表 3。
|
2篇文献[16-17]报道了2级及以上放射性皮炎发生情况,其中2级及以上放射性皮炎发生率均为0,其他研究均未报道放射性皮炎的发生情况。
2.4.1.2 不良事件发生率Terashima[11]报道了1例(2%, 1/50)在胃部接受质子最大放射剂量(52 GyE)6月后因严重胃肠道溃疡出血死亡的患者。所有研究均无SMN的报道。
2.4.2 疗效评价6篇文献[11-16]报道1年OS分别为76.8%(95%CI: 64%~89%)、73%(95%CI: 61%~82%)、80%、77.8%、84%、73%(95%CI: 62%~84%);4篇文献[12-13, 16-17]报道2年OS分别为35%(95%CI: 25%~46%)、46%(95%CI: 31%~61%)、45%、53%(95%CI: 39%~66%);仅Shinoto[17]报道了3年OS为22.50%。固定效应模型Meta分析显示,1年、2年OS分别为77%(95%CI: 73%~82%)、45%(95%CI: 39%~51%)。
Shinoto[17]报道2年LC为82%(95%CI: 66%~91%),Hiroshima[14]报道1年、2年LC分别为83.3%、78.9%,固定效应模型Meta分析显示,2年LC为81%(95%CI: 73%~88%)。
Shinoto[12]报道1年、2年FFLP分别为92%(95%CI: 81%~96%)、83%(95%CI: 69%~92%),Terashima等[11]报道1年FFLP为81.7%(95%CI: 65%~99%)。两项研究1年FFLP存在异质性(I2 > 50%),随机效应模型Meta分析显示,1年FFLP为88%(95%CI: 78%~98%)。
Kawashiro和Hiroshima等[14, 16]研究报道的1年LR分别为16%和14.3%,固定效应模型Meta分析显示,1年LR为15%(95%CI: 8%~22%),见表 3。
2.4.3 碳离子和质子治疗在不良反应和OS方面的差异碳离子治疗PaC 2级、3级和2~3级胃肠道溃疡发生率分别为6.8%、1.5%、9.2%,质子治疗PaC 2级、3级和2~3级胃肠道溃疡发生率分别为3.5%、8.3%、6.1%,差异无统计学意义(均P > .05)。碳离子治疗PaC 1年、2年OS分别为77.1%、44.4%,质子治疗PaC 1年、2年OS分别为77.6%、49.7%,差异无统计学意义(均P > 0.05),见表 4。

|
检测发表偏倚时,如同一个结局指标的研究数量≥10篇,需采用“倒漏斗图”检测发表偏倚风险。考虑本文结局指标涉及的研究数量均较少,故未行倒漏斗图分析及亚组分析。
3 讨论在临床前研究支持下,目前更倾向于认为PaC是一种全身性疾病,5-氟尿嘧啶(5-Fluorouracil, 5Fu)类药物和吉西他滨为主的全身治疗方案有利于改善总体预后[5]。2018年一项国际、多中心、随机的Ⅲ期临床试验PRODIGE/UNICANCER研究[19]将转移性PaC一线治疗方案(FOLFIRINOX方案,5Fu+亚叶酸钙+伊立替康+奥沙利铂)用于经R0/R1切除、体能状况良好的患者,最终取得了史上最长OS,且3年无病生存率可达39.7%,给早期PaC化疗方案提供了证据,也为安全性可耐受范围内的患者提供了新选择[5]。2016年Katz等[20]将mFOLFIRINOX方案(无氟尿嘧啶推注)联合卡培他滨放化疗作为新辅助治疗方案,取得了良好的疗效。Janssen等[21]提供的循证证据显示,新辅助治疗改善了边缘可切除胰腺癌手术切除率、R0切除率、中位PFS和中位OS等。PRODIGEⅢ研究[22]和MPACT研究[23]发现,晚期PaC的标准治疗中FOLFIRINOX和AG(白蛋白紫杉醇联合吉西他滨)方案均给患者带来较大获益,高级别循证证据也表明两者分别作为一线方案下的PaC临床结局指标并无统计学差异[24]。相比于早期PaC,疾病晚期治疗方案有限,但精准治疗时代的来临为疾病晚期治疗的标准方案提供了新的选择:靶向治疗和免疫治疗。大型Ⅲ期临床研究POLO中,Golan等将BRCA基因突变的PARP抑制剂“奥拉帕利”用于PaC的维持治疗,结果发现试验组获得7.4月的中期PFS,并使PaC进展风险降低了47%(OR=0.53),相比于对照组,1年FFLP也显著提高(33.7% vs. 14.5%),虽然POLO研究以46%的成熟度尚未显示出OS获益,但最终69%成熟度下的OS获益值得期待[25]。
目前放疗在PaC中的治疗作用仍存在争议。20世纪80年代研究认为,PaC术后接受40 Gy放疗联合5-Fu化疗有利于改善预后[26];但随后有研究发现,术后放疗不仅与临床益处无关,而且可能增加预后不良风险[27]。2007年EORTC 40891研究[28]将40 Gy分段放疗联合5-Fu用于PaC治疗,最终OS的改善趋势并不明显。限于上述研究试验设计、放疗技术等缺陷,其结果需谨慎对待。
2009年约翰斯·霍普金斯大学一项快速尸检研究发现,约有1/3的PaC死于局部疾病[29],提示有效控制局部疾病或许能显著降低死亡率。LAP07研究[30]证实,局部晚期胰腺癌(LAPC)的放化疗中,单纯化疗没有改善OS的优势;但接受放化疗的患者在局部控制方面有显著改善。虽然LAP07研究中局部控制并没有转化为整体生存获益,但有证据表明,部分患者的局部控制可能转化为生存获益,提示放化疗可能改善局部控制和推迟重新接受治疗的时间[30]。由于LAP07研究采用了6周以上的常规分次化疗,一些患者可能在化疗期间发生了远处转移,且错过了全身治疗最佳的时机,因此LAP07研究结果可能受影响。2018年Ng等[31]研究表明,化疗联合放疗虽不能改善PaC患者的总体生存效益,但在局部控制方面表现出明显优势。因此,越来越多的学者探索其他放射治疗方案,特别是立体定向放射治疗(SBRT)、粒子(碳离子和质子)治疗,以期最大限度地对肿瘤进行局部控制,为患者赢得接受全身系统性治疗的时间[31]。
德国海德堡离子束治疗中心(HIT)对1998—2008年接受碳离子放疗的79例颅底软骨肉瘤和155例颅底脊索瘤分析显示,颅底软骨肉瘤5年OS为97.5%,显著高于光子治疗(87.8%),碳离子和光子治疗颅底软骨肉瘤的5年LC相似;碳离子治疗颅底脊索瘤5年LC为72%,显著高于光子(65.3%)[32-33]。对于非小细胞肺癌,碳离子和质子较传统光子治疗优势显著,Grutters等[34]发现,碳离子、质子治疗NSCLC的2年校正OS分别为61%、74%,显著高于光子(53%);5年校正OS分别为40%、42%,显著高于光子(20%)。对于前列腺癌,王小虎等[35]对碳离子治疗前列腺癌进行了系统评价,5年OS、LC和无生化复发率分别为91.8%、98.4%和86.3%,均显著高于光子(81%[36]),并且8年总死亡率、前列腺癌死亡率和并发症死亡率均小于7%。在放射性不良反应上,日本国立放射科学研究所(NIRS)对1997—2006年接受碳离子放疗的236例头颈部肿瘤患者研究发现,3级、4级急性不良反应发生率 < 10%,未出现3级及以上远期不良反应[37]。
尽管SBRT可向肿瘤靶标递送高度适形的辐射,但光子在照射路径上剂量释放会随进入的深度逐渐衰减,照射靶区前的器官、组织会接受比靶区更大的剂量[31]。相比于光子,碳离子和质子具有Bragg峰和相对更高的放射生物有效性[8-9],可增加靶区照射剂量,减少非靶区剂量,进而可增加肿瘤放疗效果,同时降低放疗急性和晚期不良反应。
碳离子和质子治疗PaC起步较晚,2013年Shinoto等[38]首次报道了碳离子治疗PaC的研究,在该Ⅰ期剂量递增试验中,26例患者于术前2周接受8次碳离子放疗(总剂量为30~36.8 GyE),最后21例行手术治疗,其中19例接受了R0切除,均无局部复发,5年OS为42%,仅1例发生4级晚期不良反应,结果发现递增方案耐受性良好,放疗总剂量≥45.6 GyE的患者局部疾病控制率和总体生存率均优于低剂量组。与调强放疗(IMRT)相比,质子在PaC被动散射放疗和铅笔束扫描能降低胃、十二指肠和小肠低剂量区的剂量,可平均降低肝脏50%和肾脏18%的放疗剂量[39],目前尚不能明确减少的剂量在PaC治疗中的确切意义,但值得肯定的是对剂量递增研究具有重要参考价值。
本文共纳入8项研究,Meta分析显示,碳离子和质子治疗PaC的2、3、5级胃肠道溃疡发生率分别为7%、2%、0;2、3、4级厌食症发生率分别为6%、3%、0;1、2年OS分别为77%、45%;2年LC为81%;1年FFLP为88%;1年LR为15%。碳离子治疗PaC的2、3和2~3级胃肠道溃疡发生率分别为6.8%、1.5%、9.2%,质子治疗PaC的2、3和2~3级胃肠道溃疡发生率分别为3.5%、8.3%、6.1%,差异无统计学意义(均P > .05)。碳离子治疗PaC的1、2年OS分别为77.1%、44.4%,质子治疗PaC的1、2年OS分别为77.6%、49.7%,差异无统计学意义(P均 > 0.05)。提示碳离子和质子治疗PaC在OS、LC、FFLP、LR改善上有一定的优势,且两者疗效相当。
碳离子和质子放疗常见的不良反应为胃肠道溃疡、厌食症、放射性皮炎:Terashima等[11]报道了1例(2%)患者在接受70.2 GyE/26 Fx放疗后出现4级胃肠道溃疡;Kawashiro等[16-17]报道的2级及以上放射性皮炎发生率为0;其余研究均未报道放射性皮炎的发生情况。纳入的8项研究均无发生5级胃肠道溃疡、SMN的报道。不良事件方面,Terashima等[11]报道了1例(2%)患者在接受质子治疗后6月因严重胃肠道溃疡出血而死亡。该病例在放疗的同时接受以吉西他滨(800 mg/m2)为基础的同步及维持性化疗,且胃体下部溃疡和糜烂发生于死亡前2周,因此推测其死亡原因可能与化疗相关。提示碳离子和质子治疗PaC不良反应少、相对安全。
本研究仍存在一定局限性:(1)未纳入灰色文献,可能存在发表偏倚;(2)纳入研究的放射剂量存在较大的异质性,无法对剂量进行亚组分析;(3)不能获得患者个体的年龄数据,无法比较不同年龄的患者接受碳离子和质子放疗的获益/风险比。
综上所述,碳离子和质子治疗PaC安全有效,在OS、LC、FFLP、LR方面具有一定的优势,不良反应发生率低(主要为2级胃肠道溃疡和2级厌食症),且两者的安全性和有效性相似,临床可考虑推广应用。限于本文纳入的原始研究的数量及质量,尚需高质量、大样本前瞻性随机对照试验验证。
作者贡献
廖亦然:文献检索与筛选、数据提取与分析、论文撰写
张秋宁:文献删改、修改论文
邵丽华、刘锐锋、罗宏涛:文献筛选、数据提取
王丽娜、冯双午:文献质量评价
杨克虎:论文指导
王小虎:全文统筹、研究构思与设计
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Rahib L, Smith BD, Aizenberg R, et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States[J]. Cancer Res, 2014, 74(11): 2913-2921. DOI:10.1158/0008-5472.CAN-14-0155 |
| [4] |
Chong HK, Wang T, Lu HM, et al. The validation and clinical implementation of BRCAplus: a comprehensive high-risk breast cancer diagnostic assay[J]. PLoS One, 2014, 9(5): e97408. DOI:10.1371/journal.pone.0097408 |
| [5] |
毛铁波, 崔玖洁, 王理伟. 胰腺癌综合治疗的进展与突破[J]. 循证医学, 2019, 19(5): 257-260. [Mao TB, Cui JJ, Wang LW. Progress and Breakthrough in The Comprehensive Treatment of Pancreatic Cancer[J]. Xun Zheng Yi Xue, 2019, 19(5): 257-260.] |
| [6] |
Janssen QP, Buettner S, Suker M, et al. Neoadjuvant FOLFIRINO X in patients with borderline resectable pancreatic cancer:A systematic review and patient-level meta-analysis[J]. J Natl Cancer Inst, 2019, 111(8): 782-794. DOI:10.1093/jnci/djz073 |
| [7] |
Ciabatti S, Cammelli S, Frakulli R, et al. Radiotherapy of pancreatic cancer in older patients: A systematic review[J]. J Geriatr Oncol, 2019, 10(4): 534-539. DOI:10.1016/j.jgo.2018.09.007 |
| [8] |
Sakurai H, Ishikawa H, Okumura T. Proton beam therapy in Japan: current and future status[J]. Jpn J Clin Oncol, 2016, 46(10): 885-892. DOI:10.1093/jjco/hyw102 |
| [9] |
Hong TS, Wo JY, Borger DR, et al. Phase Ⅱ Study of Proton-Based Stereotactic Body Radiation Therapy for Liver Metastases: Importance of Tumor Genotype[J]. J Natl Cancer Inst, 2017, 109(9). |
| [10] |
王小琴, 陈耀龙, 渠清源, 等. 病例系列研究方法学质量评价工具解读[J]. 中国循证儿科杂志, 2015, 10(5): 381-385. [Wang XQ, Chen YL, Qu QY, et al. Interpretation of methodological quality assessment tools for case series studies[J]. Zhongguo Xun Zheng Er Ke Za Zhi, 2015, 10(5): 381-385. DOI:10.3969/j.issn.1673-5501.2015.05.012] |
| [11] |
Terashima K, Demizu Y, Hashimoto N, et al. A phaseⅠ/Ⅱ study of gemcitabine-concurrent proton radiotherapy for locally advanced pancreatic cancer without distant metastasis[J]. Radiother Oncol, 2012, 103(1): 25-31. |
| [12] |
Shinoto M, Yamada S, Terashima K, et al. Carbon Ion Radiation Therapy With Concurrent Gemcitabine for Patients With Locally Advanced Pancreatic Cancer[J]. Int J Radiat Oncol Biol Phys, 2016, 95(1): 498-504. |
| [13] |
Maemura K, Mataki Y, Kurahara H, et al. Comparison of proton beam radiotherapy and hyper-fractionated accelerated chemoradiotherapy for locally advanced pancreatic cancer[J]. Pancreatology, 2017, 17(5): 833-838. DOI:10.1016/j.pan.2017.07.191 |
| [14] |
Hiroshima Y, Fukumitsu N, Saito T, et al. Concurrent chemoradiotherapy using proton beams for unresectable locally advanced pancreatic cancer[J]. Radiother Oncol, 2019, 136: 37-43. DOI:10.1016/j.radonc.2019.03.012 |
| [15] |
Shinoto M, Shioyama Y, Matsunobu A, et al. Dosimetric analysis of upper gastrointestinal ulcer after carbon-ion radiotherapy for pancreatic cancer[J]. Radiother Oncol, 2016, 120(1): 140-144. |
| [16] |
Kawashiro S, Yamada S, Okamoto M, et al. Multi-institutional Study of Carbon-ion Radiotherapy for Locally Advanced Pancreatic Cancer: Japan Carbon-ion Radiation Oncology Study Group (J-CROS) Study 1403 Pancreas[J]. Int J Radiat Oncol Biol Phys, 2018, 101(5): 1212-1221. DOI:10.1016/j.ijrobp.2018.04.057 |
| [17] |
Shinoto M, Terashima K, Suefuji H, et al. A single institutional experience of combined carbon-ion radiotherapy and chemotherapy for unresectable locally advanced pancreatic cancer[J]. Radiother Oncol, 2018, 129(2): 333-339. |
| [18] |
Takatori K, Terashima K, Yoshida R, et al. Upper gastrointestinal complications associated with gemcitabine-concurrent proton radiotherapy for inoperable pancreatic cancer[J]. J Gastroenterol, 2014, 49(6): 1074-1080. DOI:10.1007/s00535-013-0857-3 |
| [19] |
Conroy T, Hammel P, Hebbar M, et al. FOLFIRINOX or Gemcitabine as adjuvant therapy for pancreatic cancer[J]. N Engl J Med, 2018, 379(25): 2395-2406. DOI:10.1056/NEJMoa1809775 |
| [20] |
Katz MH, Shi Q, Ahmad SA, et al. Preoperative modified FOLFIRINOX treatment followed by Capecitabine-based chemoradiation for borderline resectable pancreatic cancer:Alliance for clinical trials in oncology trial A021101[J]. JAMA Surg, 2016, 151(8): e161137. DOI:10.1001/jamasurg.2016.1137 |
| [21] |
Janssen QP, Buettner S, Suker M, et al. Neoadjuvant FOLFIRINOX in patients with borderline resectable pancreatic cancer: A systematic review and patient-level meta-analysis[J]. J Natl Cancer Inst, 2019, 111(8): 782-794. DOI:10.1093/jnci/djz073 |
| [22] |
Conroy T, Desseigne F, Ychou M, et al. FOLFIRINOX versus Gemcitabine for metastatic pancreatic cancer[J]. N Engl J Med, 2011, 364(19): 1817-1825. DOI:10.1056/NEJMoa1011923 |
| [23] |
Von Hoff DD, Ramanathan RK, Borad MJ, et al. Gemcitabine plus nab-Paclitaxel is an active regimen in patients with advanced pancreatic cancer: A phase Ⅰ/Ⅱ trial[J]. J Clin Oncol, 2011, 29(34): 4548-4554. DOI:10.1200/JCO.2011.36.5742 |
| [24] |
Chiorean EG, Cheung WY, Giordano G, et al. Real-world comparative effectiveness of nab-Paclitaxel plus Gemcitabine versus FOLFIRINOX in advanced pancreatic cancer: A systematic review[J]. Ther Adv Med Oncol, 2019, 11: 1758835919850367. |
| [25] |
Golan T, Hammel P, Reni M, et al. Maintenance Olaparib for germline BRCA-mutated metastatic pancreatic cancer[J]. N Engl J Med, 2019, 381(4): 317-327. DOI:10.1056/NEJMoa1903387 |
| [26] |
Kalser MH, Ellenberg SS. Pancreatic cancer. Adjuvant combined radiation and chemotherapy following curative resection[J]. Arch Surg, 1985, 120(8): 899-903. DOI:10.1001/archsurg.1985.01390320023003 |
| [27] |
Fogel EL, Shahda S, Sandrasegaran K, et al. A multidisciplinary Approach to Pancereas Cancer in 2016: A Review[J]. Am J Gastroenterol, 2017, 112(4): 537-554. DOI:10.1038/ajg.2016.610 |
| [28] |
Smeenk HG, van Eijck CH, Hop WC, et al. Long-term survival and metastatic pattern of pancreatic and periampullary cancer after adjuvant chemoradiation or observation: long-term results of EORTC trial 40891[J]. Ann Surg, 2007, 246(5): 734-740. DOI:10.1097/SLA.0b013e318156eef3 |
| [29] |
Iacobuzio-Donahue CA, Fu B, Yachida S, et al. DPC4 gene status of the primary carcinoma correlates with patterns of failure in patients with pancreatic cancer[J]. J Clin Oncol, 2009, 27(11): 1806-1813. DOI:10.1200/JCO.2008.17.7188 |
| [30] |
Hammel P, Huguet F, van Laethem JL, et al. Effect of Chemoradiotherapy vs. Chemotherapy on Survival in Patients With Locally Advanced Pancreatic Cancer Controlled After 4 Months of Gemcitabine With or Without Erlotinib: The LAP07 Randomized Clinical Trial[J]. JAMA, 2016, 315(17): 1844-1853. DOI:10.1001/jama.2016.4324 |
| [31] |
Ng SP, Herman JM. Stereotactic Radiotherapy and Particle Therapy for Pancreatic Cancer[J]. Cancers (Basel), 2018, 10(3): 75. DOI:10.3390/cancers10030075 |
| [32] |
Uhl M, Mattke M, Welzel T, et al. High control rate in patients with chondrosarcoma of the skull base after carbon ion therapy: first report of long-term results[J]. Cancer, 2014, 120(10): 1579-1585. DOI:10.1002/cncr.28606 |
| [33] |
Sahgal A, Chan MW, Atenafu EG, et al. Image-guided, intensity-modulated radiation therapy (IG-IMRT) for skull base chordoma and chondrosarcoma: preliminary outcomes[J]. Neuro Oncol, 2015, 17(6): 889-894. DOI:10.1093/neuonc/nou347 |
| [34] |
Grutters JP, Kessels AG, Pijls-Johannesma M, et al. Comparison of the effectiveness of radiotherapy with photons, protons and carbon-ions for non-small cell lung cancer: a meta-analysis[J]. Radiother Oncol, 2010, 95(1): 32-40. |
| [35] |
王小虎, 田金徽, 张秋宁, 等. 碳离子治疗前列腺癌的Meta分析[J]. 中华放射医学与防护杂志, 2016, 36(8): 588-593. [Wang XH, Tian JH, Zhang QN, et al. A Meta-analysis of carbon ion radiotherapy for prostate cancer[J]. Zhonghua Fang She Yi Xue Yu Fang Hu Za Zhi, 2016, 36(8): 588-593. DOI:10.3760/cma.j.issn.0254-5098.2016.08.007] |
| [36] |
Jolnerovski M, Salleron J, Beckendorf V, et al. Intensity-modulated radiation therapy from 70Gy to 80Gy in prostate cancer: six-year outcomes and predictors of late toxicity[J]. Radiat Oncol, 2017, 12(1): 99. |
| [37] |
Mizoe JE, Hasegawa A, Jingu K, et al. Results of carbon ion radiotherapy for head and neck cancer[J]. Radiother Oncol, 2012, 103(1): 32-37. |
| [38] |
Shinoto M, Yamada S, Yasuda S, et al. Phase 1 trial of preoperative, short-course carbon-ion radiotherapy for patients with resectable pancreatic cancer[J]. Cancer, 2013, 119(1): 45-51. |
| [39] |
Thompson RF, Mayekar SU, Zhai H, et al. A dosimetric comparison of proton and photon therapy in unresectable cancers of the head of pancreas[J]. Med Phys, 2014, 41(8): 081711. |
 2020, Vol. 47
2020, Vol. 47