文章信息
- mXELIRI和mFOLFIRI方案联合西妥昔单抗一线治疗转移性左半结肠癌的临床观察
- Clinical Observation of mXELIRI and mFOLFIRI Combined with Cetuximab in First-line Treatment of Metastatic Left-side Colon Cancer
- 肿瘤防治研究, 2020, 47(7): 542-546
- Cancer Research on Prevention and Treatment, 2020, 47(7): 542-546
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1475
- 收稿日期: 2019-11-28
- 修回日期: 2020-03-05
目前针对不可切除的转移性结直肠癌的主要治疗药物有化疗、抗表皮生长因子受体(EGFR)抗体及抗血管内皮生长因子(VEGF)抗体的靶向治疗药物以及免疫检查点抑制剂。国内外指南均推荐转移性结直肠癌一线治疗以FOLFOX、CAPOX或mFOLFIRI方案基础上联合靶向治疗,但不推荐将伊立替康联合卡培他滨(CAPIRI或XELIRI)联合靶向治疗,原因是临床上对伊立替康联合卡培他滨方案的安全性、最佳给药方案(2周vs. 3周方案,伊立替康的最适合剂量)及疗效存在一定的争议[1-2],本研究基于国内外的研究结果,采用了改良的伊立替康联合卡培他滨方案(mXELIRI),并联合抗EGFR抗体——西妥昔单抗,与mFOLFIRI方案联合西妥昔单抗进行对比,观察其一线治疗转移性左半结肠癌的临床疗效及安全性。
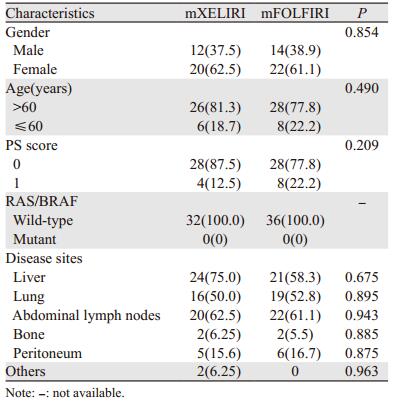
1 资料与方法 1.1 研究对象回顾性分析2016年6月—2019年6月间就诊于民航总医院消化肿瘤科68例接受西妥昔单抗联合mXELIRI与mFOLFIRI方案的转移性结直肠癌患者。所有入组患者详细的临床病例特点见表 1。入组标准:(1)年龄≥18岁;(2)ECOG行为状态评分≤1;(3)不能手术切除的组织学证实的左半转移性结直肠癌,未接受过针对转移性病变的化疗或靶向治疗;(4)RAS/BRAF基因检测均为野生型;(5)至少有一个可测量病灶(RECIST标准);(6)患者必须符合下列所有实验室检查结果:①中性粒细胞绝对计数(ANC) > 1.5×109/L,血小板计 > 100×109/L,血红蛋白 > 9 g/dl;②总胆红素 < 1.5倍正常值上限;ALST, ASAT < 2.0倍正常值上限,或在有肝转移的患者中 < 5倍正常值上限;③血肌酐 < 1.0倍正常上限,或肌酐清除率 > 80 ml/min。排除标准:(1)有未控的脑转移瘤;(2)有精神系统疾病;(3)治疗前6月内有严重的心血管疾病,如脑血管意外、心肌梗死、不稳定性心绞痛、Ⅱ级或Ⅱ级以上充血性心功能衰竭、需要药物治疗的严重心律失常、未控制的高血压;(4)吞咽困难;(5)消化系统溃疡性疾病;(6)胆汁淤积性疾病;(7)顽固性腹泻。
|
mXELIRI组:伊立替康150 mg/m2, d1, Q14d,静脉滴注;卡培他滨每天2 000 mg/m2, d1~10,Q14d,分两次口服;西妥昔单抗(爱必妥)500 mg/m2, d1, Q14d,静脉滴注。
mFOLFIRI组:伊立替康180 mg/m2, d1, Q14d,静脉滴注;醛氢叶酸(CF)300 mg/m2,d1,静脉滴注;5-Fu 400 mg/m2,d1,静脉注射;2 400 mg/m2, 持续静脉缓注44 h。西妥昔单抗500 mg/m2, d1, Q14d,静脉滴注。
1.3 客观疗效评价采用增强CT或核磁共振扫描,每3周期检查一次,依据实体瘤疗效评价标准(RECIST1.1)评价客观疗效,分为:完全缓解(complete response, CR),部分缓解(partial response, PR),疾病稳定(stable disease, SD),疾病进展(progressive disease, PD),CR为所有目标病灶完全消失并维持4周以上;PR为基线病灶长径总和缩小 > 30%,并维持4周以上;SD为基线病灶长径总和有缩小但未达PR或有增加但未达PD,维持4周以上;PD为基线病灶长径总和增加 > 20%或出现新病灶。客观缓解率为CR+PR的比例,疾病控制率为CR+PR+SD的比例[3]。
1.4 生存分析PFS指患者从接受治疗开始观察,到肿瘤进展或者发生任何原因导致死亡之间的时间。
1.5 安全性分析根据常见不良反应事件评价标准4.0版(CTCAE4.0)[4],不良事件的严重程度分为:1级:轻度;无症状或轻微;仅为临床或诊断所见;无需治疗。2级:中度;需要较小、局部或者非侵入性治疗;与年龄相当的工具性日常生活活动受限。3级:严重或者具重要医学意义但不会立即危及生命;导致住院或者延长住院时间;致残;个人日常生活活动受限。4级:危及生命;需要紧急治疗。5级:与AE相关的死亡。
1.6 统计学方法采用SPSS16.0软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制无进展生存曲线,生存相关数据的比较采用Log rank检验,P < 0.05为差异有统计学意义。
2 结果 2.1 客观疗效所有患者的客观缓解率为60.0%,其中mXELIRI组(32例):2例患者CR(6.2%),18例患者PR(56.3%),8例患者SD(25.0%),4例患者PD(12.5%),客观缓解率为62.5%,疾病控制率为87.5%;mFOLFIRI组(36例):1例患者CR(2.8%),20例患者PR(55.6%),11例患者SD(30.6%),4例患者PD(11.1%),客观缓解率为58.3%,疾病控制率为88.9%。两组之间客观缓解率、疾病控制率差异均无统计学意义(P=0.672, P=1.000)。
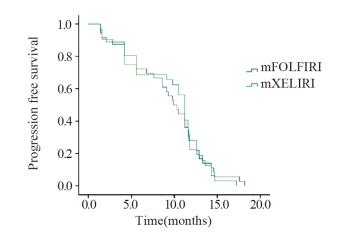
2.2 无疾病进展生存期(PFS)mXELIRI组:中位PFS为10.5月(95%CI: 9.206~11.794),mFOLFIRI组:中位PFS为9.9月(95%CI: 8.136~11.664),两组之间差异无统计学意义(P=0.858),生存曲线见图 1。
|
| 图 1 68例转移性左半结直肠癌患者两组方案的PFS曲线 Figure 1 PFS curves of 68 patients with metastatic leftside colorectal cancer treated with cetuximab combined with mXELIRI or mFOLFIRI |
根据CTCAE4.0版评估患者化疗过程中出现的不良反应。mXELIRI组手足综合征明显高于mFOLFIRI组(37.5% vs. 13.9%, P=0.025),两组患者3级以上的不良反应发生率不高,差异均无统计学意义,见表 2。

|
结直肠癌在我国发病率较高且逐年上升,化疗是转移性结直肠癌主要治疗手段,随着贝伐单抗及西妥昔单抗的引入,化疗联合靶向治疗成为转移性结直肠癌的标准治疗手段[5]。有研究表明西妥昔单抗无论是联合FOLFOX4还是FOLFIRI一线治疗的有效率以及无进展生存时间均明显优于单纯化疗组[6-7],另外也有研究表明在化疗的基础上加用贝伐单抗明显优于单纯化疗组[8-9]。随着研究的不断深入,依据转移性结直肠癌的原发部位不同,预后以及治疗方案也有所不同,目前对于左半结肠癌,尤其是RAS/BRAF野生型转移性左半结肠癌,FOLFOX4或FOLFIRI联合西妥昔单抗成为标准的一线治疗方案[10-11],但无论是FOLFOX4还是FOLFIRI方案都面临着患者住院时间长,且需放置及维护中心静脉置管,给患者带来诸多不便,因此,本研究关注更便捷的XELIRI方案联合西妥昔单抗与传统的FOLFIRI联合西妥昔单抗之间的有效性及安全性之间的差异。
早在2008年Fuchs等比较了XELIRI和FOLFIRI方案的有效性及安全性,发现XELIRI方案有效可靠,但不良反应略严重,尤其是腹泻的反应率较高[12]。鉴于XELIRI的不良反应,该方案一度因毒性较大未被引入指南,但随着近年来越来越多的研究将XELIRI方案中伊立替康剂量调整后,毒性可控,最终表明剂量和用法调整后的XELIRI方案在晚期肠癌中的疗效确切,安全性可控[13]。2014年来自法国的Ⅱ期随机对照研究(FNCLCC ACCORD 13/0503)表明3周方案的XELIRI+Bev和FOLFIRI+Bev均是用于一线治疗mCRC患者的有效方案,XELIRI+Bev组6月的PFS为82%,中位PFS和总生存期(OS)分别为9月和23月,最常见的不良反应是3、4级中性粒细胞减少症,发生率为18%,3级腹泻发生率12%,不良反应可控[14]。亚洲的一项大型RCT研究表明二线应用调整剂量后的XELIRI联合贝伐单抗,有效率较高,而且安全性可控[15]。从以上的研究可以看出,XELIRI方案的应用趋势为采用更低剂量的伊立替康和卡培他滨以获得更好的安全性,且不影响疗效。因此,目前多数临床指南将3周mXELIRI方案写入结肠癌的二线治疗方案中,比如CSCO肠癌指南。
无论是FOLFOX还是FOLFIRI均为两周方案,因此有部分学者开始研究两周XELIRI,同时调整方案中伊立替康的剂量。Rudek等研究了双周XELIRI+贝伐珠单抗+ABT-751在肠癌的二线治疗中具有良好的安全性和确切的疗效[16],且安全性良好,用药更方便,患者住院日更短。除此之外,还有不少两周XELIRI一线治疗转移性结直肠癌的研究,如2009年西班牙的一项研究证实两周XELIRI的有效性及安全性[17-18]。对于西妥昔单抗联合XELIRI方案也有很多研究,早在2008年Moosmann等总结了西妥昔单抗联合XELIRI或者XELOX的系列研究,阐述了西妥昔单抗联合XELIRI方案的可行性[19]。2011年德国一项多中心研究表明,西妥昔单抗联合XELIRI或者XELOX方案,有效率分别为52.6%和59.2%,该研究进一步表明KRAS野生型患者有效率及PFS、OS更佳[20]。随后的临床研究进一步证实对于KRAS野生型及BRAF未突变患者西妥昔单抗的疗效更佳,并且在多个结直肠癌的指南中更新。2014年德国的一项AIO KRK-0104多中心研究[21],比较了RAS及Braf基因野生型患者,给予一线应用西妥昔单抗联合XELOX方案及XELIRI方案的有效性,结果显示PFS及OS无明显差异,同时该研究结果显示原发肿瘤位于左侧的患者总生存期(OS)(P=0.016, HR=0.63)和无进展生存期(PFS)(P=0.02, HR=0.67)明显比右侧结肠癌患者更佳。目前,双周XELIRI方案联合西妥昔单抗对比mFOLFIRI联合西妥昔单抗一线治疗转移性结直肠癌的数据匮乏,本研究可为转移性结直肠癌的一线方案选择提供依据。
本研究结果提示西妥昔单抗联合mXELIRI方案的客观缓解率以及疾病控制率与西妥昔单抗联合mFOLFIRI组无明显差异,与其他的临床研究基本相似。进一步观察患者PFS情况,两组之间无明显差异,从该数据的有效率和无进展生存时间看,两种不同化疗方案一线治疗无明显差异,因此如果从近期疗效看,西妥昔单抗联合mXELIRI方案也可以作为转移性结直肠癌的一线方案备选。
进一步分析两种不同方案的安全性,从我们的数据看出,除了手足综合征之外(mXELIRI组为37.5%和mFOLFIRI组为13.9%),两组患者不良反应发生率相似,3级以上的不良反应发生率均不高,均在可控范围内,从整体安全性上来看,西妥昔单抗联合mXELIRI方案与mFOLFIRI方案基本相似。本中心将继续随访两种不同方案总生存时间的差别,本研究为非随机对照研究,必要时可进一步设计随机对照的前瞻性研究,为转移性结直肠癌患者一线治疗增加更多的选择。
作者贡献
程建平:方案制定、病例筛选和随访、论文撰写
赵晓琳、李珍、杨梦媛、曹世长:病例数据整理、病例管理
于久飞:选题、把握研究方向
| [1] |
Bajetta E, Bartolomeo MD, Mariani L, et al. Randomized multicenter Phase Ⅱ trial of two different schedules of irinotecan combined with capecitabine as first-line treatment in metastatic colorectal carcinoma[J]. Cancer, 2004, 100(2): 279-287. |
| [2] |
Fuchs CS, Moore MR, Harker G, et al. Phase Ⅲ Comparison of Two Irinotecan Dosing Regimens in Second-Line Therapy of Metastatic Colorectal Cancer[J]. J Clin Oncol, 2003, 21(5): 807-814. |
| [3] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1[J]. Eur J Cancer, 2009, 45(2): 228-247. |
| [4] |
Chen AP, Setser A, Anadkat MJ, et al. Grading dermatologic adverse events of cancer treatments: The Common Terminology Criteria for Adverse Events Version 4[J]. J Am Acad Dermatol, 2012, 67(5): 1025-1039. |
| [5] |
Venook AP, Niedzwiecki D, Lenz HJ, et al. Effect of first-line chemotherapy combined with cetuximab or bevacizumab on overall survival in patients with KRAS wild-type advanced or metastatic colorectal cancer a randomized clinical trial[J]. JAMA, 2017, 317(23): 2392-2401. DOI:10.1001/jama.2017.7105 |
| [6] |
Qin S, Li J, Wang L, et al. Efficacy and tolerability of first-line cetuximab plus leucovorin, fluorouracil, and oxaliplatin (FOLFOX-4) versus FOLFOX-4 in patients with RAS wild-type metastatic colorectal cancer: the open-label, randomized, Phase ⅢTAILOR trial[J]. J Clin Oncol, 2018, 36(30): 3031-3039. DOI:10.1200/JCO.2018.78.3183 |
| [7] |
Venook AP, Niedzwiecki D, Lenz HJ, et al. Effect of First-Line Chemotherapy Combined With Cetuximab or Bevacizumab on Overall Survival in Patients With KRAS Wild-Type Advanced or Metastatic Colorectal Cancer: A Randomized Clinical Trial[J]. JAMA, 2017, 317(23): 2392-2401. DOI:10.1001/jama.2017.7105 |
| [8] |
Heinemann V, von Weikersthal LF, Decker T, et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2014, 15(10): 1065-1075. DOI:10.1016/S1470-2045(14)70330-4 |
| [9] |
Kamran SC, Clark JW, Zheng H, et al. Primary tumor sidedness is an independent prognostic marker for survival in metastatic colorectal cancer: Results from a large retrospective cohort with mutational analysis[J]. Cancer Med, 2018, 7(7): 2934-2942. DOI:10.1002/cam4.1558 |
| [10] |
Signorelli C, Chilelli MG, Sperduti I, et al. Correlation of Tumor Location to Clinical Outcomes in Colorectal Cancer: A Single-institution Retrospective Analysis[J]. Anticancer Res, 2019, 39(9): 4917-4924. DOI:10.21873/anticanres.13679 |
| [11] |
Tejpar S, Stintzing S, Ciardiello F, et al. Prognostic and Predictive Relevance of Primary Tumor Location in Patients With RAS Wild-Type Metastatic Colorectal Cancer: Retrospective Analyses of the CRYSTAL and FIRE-3 Trials[J]. JAMA Oncol, 2017, 3(2): 194-201. DOI:10.1001/jamaoncol.2016.3797 |
| [12] |
Fuchs CS, Marshall J, Barrueco J, et al. Randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: updated results from the BICC-C study[J]. J Clin Oncol, 2008, 26(4): 689-690. DOI:10.1200/JCO.2007.15.5390 |
| [13] |
Cui C, Shu C, Yang Y, et al. XELIRI compared with FOLFIRI as a second-line treatment in patients with metastatic colorectal cancer[J]. Oncol Lett, 2014, 8(4): 1864-1872. DOI:10.3892/ol.2014.2335 |
| [14] |
Ducreux M, Adenis A, Pignon JP, et al. Efficacy and safety of bevacizumab-based combination regimens in patients with previously untreated metastatic colorectal cancer: Final results from a randomised phase ii study of bevacizumab plus 5-fluorouracil, leucovorin plus irinotecan versus bevacizumab plus capecitabine plus irinotecan (FNCLCC ACCORD 13/0503 study)[J]. Eur J Cancer, 2013, 49(6): 1236-1245. DOI:10.1016/j.ejca.2012.12.011 |
| [15] |
Xu RH, Muro K, Morita S, et al. Modified XELIRI (capecitabine plus irinotecan) versus FOLFIRI (leucovorin, fluorouracil, and irinotecan), both either with or without bevacizumab, as second-line therapy for metastatic colorectal cancer (AXEPT): a multicentre, open-label, randomised, non-inferiority, phase 3 trial[J]. Lancet Oncol, 2018, 19(5): 660-671. DOI:10.1016/S1470-2045(18)30140-2 |
| [16] |
Rudek MA, Dasari A, Laheru D, et al. Phase I Study of ABT-751 in Combination with CAPIRI (Capecitabine and Irinotecan) and Bevacizumab in Patients with Advanced Colorectal Cancer[J]. J Clin Pharmacol, 2016, 56(8): 966-973. DOI:10.1002/jcph.681 |
| [17] |
Garcia-Alfonso P, Muñoz-Martin A, Mendez-Ureña M, et al. Capecitabine in combination with irinotecan (XELIRI), administered as a 2-weekly schedule, as first-line chemotherapy for patients with metastatic colorectal cancer: a phase Ⅱ study of the Spanish GOTI group[J]. Br J Cancer, 2009, 101(7): 1039-1043. DOI:10.1038/sj.bjc.6605261 |
| [18] |
Nakayama G, Mitsuma A, Sunagawa Y, et al. Randomized Phase II Trial of CapOX plus Bevacizumab and CapIRI plus Bevacizumab as First-Line Treatment for Japanese Patients with Metastatic Colorectal Cancer (CCOG-1201 Study)[J]. Oncologist, 2018, 23(8): 919-927. DOI:10.1634/theoncologist.2017-0640 |
| [19] |
Moosmann N, Heinemann V. Cetuximab plus XELIRI or XELOX for first-line therapy of metastatic colorectal cancer[J]. Clin Colorectal Cancer, 2008, 7(2): 110-117. DOI:10.3816/CCC.2008.n.015 |
| [20] |
Moosmann N, von Weikersthal LF, Vehling-Kaiser U, et al. Cetuximab Plus Capecitabine and Irinotecan Compared With Cetuximab Plus Capecitabine and Oxaliplatin As First-Line Treatment for Patients With Metastatic Colorectal Cancer: AIO KRK-0104—A Randomized Trial of the German AIO CRC Study Group[J]. J Clin Oncol, 2011, 29(8): 1050-1058. DOI:10.1200/JCO.2010.31.1936 |
| [21] |
von Einem JC, Heinemann V, von Weikersthal LF, et al. Left-sided primary tumors are associated with favorable prognosis in patients with KRAS codon 12/13 wild-type metastatic colorectal cancer treated with cetuximab plus chemotherapy: an analysis of the AIO KRK-0104 trial[J]. J Cancer Res Clin Oncol, 2014, 140(9): 1607-1614. DOI:10.1007/s00432-014-1678-3 |
 2020, Vol. 47
2020, Vol. 47


