文章信息
- 氩氦刀冷冻治疗上颌窦癌的临床疗效
- Curative Effect of Argon-helium Cryoablation on Maxillary Sinus Cancer
- 肿瘤防治研究, 2020, 47(7): 536-541
- Cancer Research on Prevention and Treatment, 2020, 47(7): 536-541
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1460
- 收稿日期: 2019-11-25
- 修回日期: 2020-04-02
由于位置的隐匿性及周围组织的局限性,早期上颌窦癌症状少,不易被发现和确诊,因此成为头颈部较难控制的恶性肿瘤之一。现行治疗手段以手术和放疗结合为主。由于病情发现多为晚期,且多伴有鼻腔、眼眶等周围组织侵犯,治疗较为困难,且远期疗效较差,因此复发及转移仍成为当前临床治疗的难题[1-2]。冷冻外科是迅速发展起来的一门医学新技术,具有代表性的氩氦刀治疗,通过低温快速冷冻、解冻过程,达到破坏细胞膜、引起局部肿瘤细胞破坏的目的,已有该技术应用于肝癌等治疗的相关报道[3],目前国内在采用经皮穿刺氩氦刀冷冻治疗上颌窦癌方面已经取得了较好疗效[4]。本研究拟通过观察氩氦刀冷冻治疗上颌窦癌的治疗效果和并发症,对患者手术前后免疫功能的变化以及血清中白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、TNF-β、免疫干扰素-γ(INF-γ)进行分析,对氩氦刀治疗方式作出评价并指导临床应用。
1 资料与方法 1.1 临床资料收集河北医科大学第一医院肿瘤科2012年8月—2016年8月采用氩氦刀冷冻治疗上颌窦癌患者37例为观察组,选取同期采用传统手术+局部放射治疗的患者35例为对照组。纳入标准:(1)原发癌;(2)患者了解治疗手段,自愿选择治疗方式。排除标准:(1)心、肺、肾等疾病严重者,严重感染者;(2)不配合治疗者。术前行上颌窦及颈部增强CT扫描,明确肿瘤位置及与周围血管、神经关系,行头颅MRI、骨扫描及胸腹部CT、肝肾功能检查等,明确机体一般情况以及全身肿瘤负荷情况。患者均签署知情同意书,并通过本院伦理委员会批准。
1.2 手术方法对照组给予传统手术与放疗综合治疗,观察组给予氩氦刀冷冻治疗与放疗综合治疗,具体治疗方法如下:
1.2.1 Ⅰ期上颌窦癌患者治疗方法经皮经上颌骨开窗氩氦靶向冷冻治疗术。具体操作步骤:术前在CT下定位,确定穿刺点、靶点及深度,一般选择在上颌窦前壁开窗,穿刺点在眶下2.0~2.5 cm及中线外2 cm交界处。术中常规消毒铺巾,予以0.5%利多卡因局部及骨膜麻醉,在穿刺点处开窗打孔约3.5 mm×3.5 mm,选择3 mm冷刀,一般深度为4~5 cm,可达到翼腭裂前缘,如翼腭窝受侵,可增加深度将其包容,如眼球未受侵,注意保护眼球。启动氩氦制冷系统,按常规一周期完成两个冷冻循环。冷冻过程中可以应用温盐水冲洗面部冷刀周围,以达到保护皮肤的目的。术后放疗照射剂量为40~72 Gy。
1.2.2 Ⅱ、Ⅲ期上颌窦癌患者治疗方法除按上述常规步骤在上颌窦内行冷冻外,还应根据侵犯部位及周围组织情况,依次选择不同型号冷刀在不同部位进行冷冻,如肿瘤侵犯鼻道、筛窦、鼻咽、硬腭、软腭、咽腭弓等部位,可经鼻道或从口腔内直接插刀,注意软腭冷冻时范围不宜过大,肿瘤外缘包饶0.8 cm即可,以免破坏过多正常组织;如肿瘤侵犯内下壁,除从口腔进刀外,也可从颊龈沟进刀;如肿瘤侵犯眶底眶内壁及上颌窦后壁,则从上颌窦开窗或眶下穿刺,但术前要精确设计,冰球不但要将受侵犯的肿瘤组织尽量包括,同时还要考虑正常组织与需切除的肿瘤组织之间的关系。术后放疗照射剂量为40~72 Gy。
1.2.3 Ⅳ期上颌窦癌患者治疗方法可根据患者情况进行姑息治疗,以缓解症状。癌痛较明显者,局部冷冻后可达到止痛目的;区域淋巴结转移者,行颈部淋巴结清扫术+侧野照射,照射剂量为50~72 Gy,冷冻后组织可产生肿瘤抗原,提高其自身免疫力。术后辅以联合治疗,以提高患者生存质量。
1.3 疗效评估 1.3.1 疗效评价标准术前行增强CT和MRI扫描,氩氦刀术后1月及术后3月分别复查增强CT和MRI,根据实体瘤评价标准,以肿瘤体积减少程度评价疗效,无法直接测量的借助CT或MRI检测结果判定。完全缓解(CR):全部肿瘤消失,所有检查手段均未发现肿瘤,且至少维持4周,增强CT扫描显示肿瘤动脉期100%无强化;部分缓解(PR):病情稳定,肿瘤动脉期强化病灶的直径总和缩小 > 30%,且至少维持4周,期间无恶化或新病灶出现;疾病进展(PD):动脉期增强显影病灶的直径总和增加 > 20%或出现新病灶;病情稳定(SD):位于PR及PD之间,强化病灶缩小未达PR或增加未达PD。临床有效率(RR)=(CR+PR)/总例数。统计1年及3年生存率。
1.3.2 免疫因子检测测定术前及术后3月、6月患者血清T淋巴细胞CD3+、CD4+、CD8+的计数,及Th/Ts比值的变化,统计患者术前术后免疫功能的变化。ELISA法测定外周血IL-6、TNF-α、TNF-β、INF-γ含量。
1.3.3 并发症总结术中并发症如疼痛、出血、皮肤冻伤及术后局部水肿、发热、破溃或口腔感染等发生及处理情况。疼痛程度按WHO的VRS法分级,Ⅰ级(轻度疼痛但可忍受,能正常生活,睡眠不受干扰),未行特殊处理;Ⅱ级(疼痛明显,不能忍受,要求用止痛剂,睡眠受干扰),给予盐酸吗啡注射液10 mg皮下注射后逐渐好转;Ⅲ级(疼痛剧烈,不能忍受,睡眠受严重干扰,可伴有自主神经紊乱或被动体位),停止冷冻后,积极给予盐酸吗啡注射液止痛,并短时多次频繁冷冻治疗。
1.4 统计学方法应用SPSS20.0统计软件进行统计学分析,计量资料用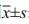
本研究观察组男性20例,女性17例,年龄35~87岁,平均年龄70.35±5.48岁;临床分期:Ⅰ期5例,Ⅱ期8例,Ⅲ期11例,Ⅳ期13例。对照组男性21例,女性14例,年龄36~85岁,平均年龄71.26±5.36岁;临床分期:Ⅰ期6例,Ⅱ期9例,Ⅲ期10例,Ⅳ期10例。两组性别、年龄、临床分期等差异无统计学意义(P > 0.05)。
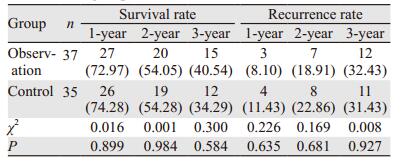
2.2 肿瘤CT评估结果观察组与对照组的治疗有效率分别为56.75%和60.00%,组间差异无统计学意义(P > 0.05),见表 1,图 1。
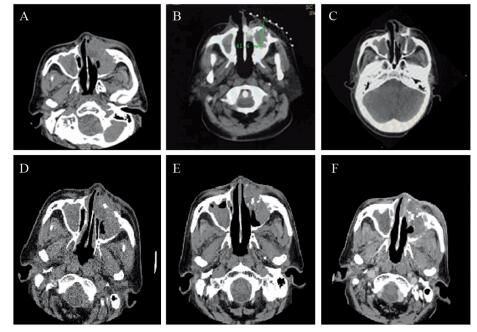
|
| A: preoperative local tumor; B: intraoperative localization, avoiding peripheral blood vessels; C: intraoperative freezing, ice ball covering the whole tumor; D: One month after the operation, tumor necrosis, the tumor was smaller than before; E: Three months after the operation, the tumor was significantly smaller than before; F: 6 months after the operation. 图 1 观察组术中及术后复查肿瘤情况 Figure 1 Intra- and post-operative review of tumors in observation group |
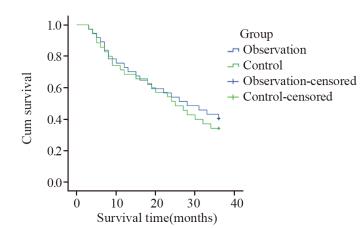
两组1、2、3年生存率及复发率差异无统计学意义(P > 0.05),见表 2,图 2。
|
|
| 图 2 上颌窦癌观察组与对照组生存分析 Figure 2 Survival analysis of two groups |
观察组术中疼痛26例(70.27%),Ⅰ级10例(27.03%),Ⅱ级12例(32.43%),Ⅲ级3例(8.11%),1例因疼痛评分较高,无法耐受,遂停止手术治疗。局部组织轻度肿胀12例,中度肿胀16例,重度组织肿胀9例。消水肿治疗1周后肿胀消退16例,轻度肿胀18例,中度肿胀3例,1月后肿胀均消失。2例(5.4%)患者局部皮肤轻度冻伤,冻伤范围0.5 cm,术后第2天出现局部水泡,给予局部换药后逐渐吸收及恢复。2例(5.4%)患者肿瘤破溃,由于术前肿瘤即已浸透上颌窦后壁,冷冻后肿瘤破溃至口腔,导致感染,积极抗感染及换药等治疗后好转,换药1月后破溃口较前缩小,但仍需长期换药治疗。术后7例(18.92%)体温低于38.5℃,3例(8.11%)体温超过38.5℃,积极给予降温、抗感染治疗后逐渐好转,见表 3。
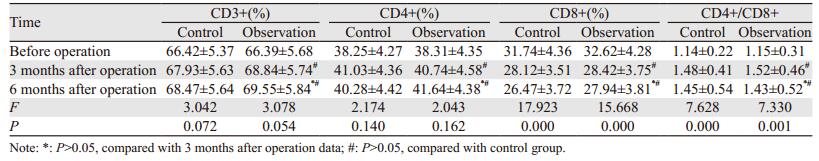
两组手术前后CD3+、CD4+差异无统计学意义,CD8+降低,CD4+/CD8+升高,差异有统计学意义(P < 0.05),治疗后不同时期CD3+、CD4+、CD8+、CD4+/CD8+差异无统计学意义(P > 0.05)。两组之间治疗后相同时期无明显差异(P > 0.05),见表 4。
|
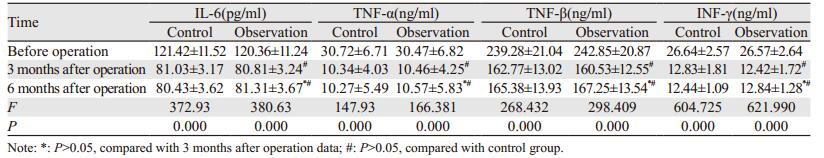
对照组和观察组治疗后不同时期患者血清IL-6、TNF-α、TNF-β、INF-γ含量均较术前下降,差异有统计学意义(P < 0.05),治疗后不同时期差异无统计学意义(P > 0.05)。两组之间相同时期比较无明显差异(P > 0.05),见表 5。
|
氩氦刀靶向冷冻治疗恶性肿瘤的技术当前已广泛应用于多种实体肿瘤的综合治疗[5],具有定位准确、疗效确切的特点,在全身多部位均可使用[6]。由于上颌窦位置的特殊性,手术治疗创伤较大,而氩氦刀冷冻治疗由于其微创性,在上颌窦癌局部治疗中起到重要的作用,大部分冷冻范围内肿瘤细胞无血供,并有显著坏死,从而达到物理靶向治疗效果。本研究显示观察组与对照组的治疗有效率无明显差异,两组1、2、3年生存率与1、2、3年复发率差异无统计学意义。由此可见肿瘤冷冻治疗效果较好,可达到传统手术的治疗效果。
有研究表明,放射疗法可使细胞损伤反应和急性炎性反应增强,这与临床中放疗后出现口腔溃疡、皮肤破溃、组织红肿等急性炎性反应相符合且伴有皮肤损伤、神经损伤、恶心呕吐、口腔及咽喉疼痛、吞咽困难、放射性骨坏死、放射性骨髓炎等不良反应和并发症[7]。本研究中对照组患者也有诸多不良反应和并发症出现,但都属于放疗后的正常反应,不作为本研究的重点观察研究。疼痛是氩氦刀手术并发症之一,由于上颌窦癌位置较浅,周围神经血管较多,局部解剖关系复杂,冷冻时极易发生疼痛及神经损伤等并发症[8],因此氩氦刀靶向冷冻治疗上颌窦癌需要非常精确的术中定位及精细的术中操作。本研究纳入的37例患者,术中疼痛26例(70.27%),由此可见经皮穿刺氩氦刀靶向冷冻治疗上颌窦癌,其主要并发症为术中疼痛,由于头面部局部空间较小,肿瘤向窦壁及周围组织神经侵犯及压迫,极易出现疼痛等情况,而氩氦刀治疗作为冷冻技术,可导致周围组织迅速形成冰球膨胀,压迫症状加重,从而导致患者术中出现疼痛症状[9]。术后局部组织水肿为氩氦刀靶向冷冻治疗上颌窦癌的并发症,术后水肿首先由于冷冻后肿瘤组织水肿所致,其次有肿瘤水肿压迫周围毛细血管及淋巴管等,导致周围组织循环受阻,从而引起面部皮肤水肿[10]。本研究中术后1天均出现不同程度的局部组织水肿,严重水肿者主要出现于肿瘤体积较大、冷冻范围较广者,而Ⅰ期肿瘤较小者术后水肿范围较小、术后恢复较快。水肿虽然导致术后不适,但其为冷冻后短期并发症,经积极处理后均可显著缓解症状[11]。皮肤冻伤是氩氦刀手术常见的并发症,氩氦刀是一个低温冷冻治疗设备,工作时产生-120℃~-165℃的低温,虽然氩氦刀的制冷局限在超冷刀的尖端,距超冷刀杆稍远的区域温度下降比较缓慢,但温度仍在0℃以下易对周围组织造成损伤[12]。因此术前需制定详尽手术方案,术中严格操作,做到精心保护皮肤。本研究中皮肤损伤较小,仅2例患者术中虽给予局部保护但由于肿瘤过于浅表而造成损伤。氩氦刀术后皮肤冻伤皮损后可给予局部烧烫伤类方法治疗,由于面部皮肤血液循环较为丰富,冻伤可逐渐恢复[13]。本研究中,2例患者肿瘤侵蚀穿透上颌窦后壁,冷冻坏死后肿瘤向口腔破溃,且破溃口不易愈合,导致术后患者需长时间换药及抗感染治疗,因此术前CT明确肿瘤是否浸透上颌骨后壁极为重要,且术中定位时尽量减少冷刀穿刺透过口腔黏膜,减少此类并发症的出现[14]。
放射治疗虽然可杀死癌细胞、阻断营养供应、调控抗体及细胞因子的分泌,但在促进机体抗肿瘤免疫力的同时破坏了机体的免疫系统[15-16]。有研究显示冷冻能引导机体产生抗肿瘤抗体并具有组织或器官特异性和种属特异性,能够增强树突状细胞的抗原递呈作用,从而使肿瘤特异性T淋巴细胞的抗肿瘤能力增强[17]。免疫淋巴细胞CD3+、CD4+、CD8+是调控机体免疫能力的重要细胞,CD3+和CD4+的变化具有一致性,而CD4+与CD8+相互制约,CD4+/CD8+保持稳定比例,共同调节免疫功能。CD8+具有抑制机体免疫功能的作用,而癌症患者普遍表现出免疫抑制,即血清CD8+比例升高、CD4+/CD8+比值降低的情况[18]。研究显示IL-6、TNF-α、TNF-β、INF-γ在肿瘤患者血清中呈高表达,IL-6、TNF-α、TNF-β不仅是重要的炎性因子,也在机体免疫活动中发挥作用,与INF-γ一样是高效的抗癌因子。本研究显示患者血清IL-6、TNF-α、TNF-β、INF-γ含量均较术前下降,可能是由于氩氦刀治疗在破坏瘤体后一定程度上解除了肿瘤的免疫抑制,同时由于手术创伤较小,对机体免疫冲击小,使机体免疫功能较术前显著恢复。研究显示,氩氦刀治疗在肺癌、肝癌等领域应用均对患者免疫功能起到提高作用[19],这与本研究结果一致。本研究病例数少,且未进行治疗方法的对比,存在一定的偏倚性,将在后续研究中进行深入分析。
总之,氩氦刀靶向冷冻治疗上颌窦癌控制肿瘤效果显著,并发症少,且能改善患者的免疫功能,但仍存在疼痛及水肿等并发症的发生,因此术中仍需采取积极措施,注意保护皮肤及周围组织结构,术后积极给予对症处理,促进恢复。
作者贡献
郑峥:课题方案设计,数据整理,论文撰写
邹长鹏:查阅文献,方案设计指导
赵丽萍:统计数据
田 博:记录数据
薄常文、李娜:患者随访
安永辉:审核数据
梁献伟:技术指导
郭英:论文指导和修改
| [1] |
Mahmoud AM, Said A, El-dessouky I, et al. Tips and tricks in surgical management of maxillary sinus tumors[J]. Egypt J Ear NoseThroat Allied Sci, 2017, 18(1): 43-48. |
| [2] |
许伦, 王丽, 段晨, 等. 鼻内镜下治疗上颌窦内翻性乳头状瘤(IP)的预后分析[J]. 复旦学报(医学版), 2019, 46(3): 372-377. [Xu L, Wang L, Duan C, et al. Prognosis analysis of endoscopic surgical procedures for treatment of inverted papilloma (IP) of the maxillary sinus[J]. Fu Dan Xue Bao (Yi Xue Ban), 2019, 46(3): 372-377. DOI:10.3969/j.issn.1672-8467.2019.03.013] |
| [3] |
赵丹, 乔炳礼, 李润花, 等. 氩氦刀冷冻消融联合化疗治疗非小细胞肺癌的疗效及对相关癌性疼痛的影响[J]. 实用医学杂志, 2016, 32(21): 3479-3482. [Zhao D, Qiao BL, Li RH, et al. Effectiveness of argon-helium cryoablation on non-small lung cancer and its impact on alleviating pain[J]. Shi Yong Yi Xue Za Zhi, 2016, 32(21): 3479-3482. DOI:10.3969/j.issn.1006-5725.2016.21.005] |
| [4] |
Majchrzak K, Nelson MH, Bailey SR, et al. Exploiting IL-17-producing CD4+ and CD8+ T cells to improve cancer immunotherapy in the clinic[J]. Cancer Immunol Immunother, 2016, 65(3): 247-259. |
| [5] |
Aragaki-Nakahodo AA, Baughman RP, Shipley RT, et al. The complimentary role of transbronchial lung cryobiopsy and endobronchial ultrasound fine needle aspiration in the diagnosis of sarcoidosis[J]. Respir Med, 2017, 131: 65-69. DOI:10.1016/j.rmed.2017.08.003 |
| [6] |
Li J, Qu J, Zhang H, et al. 3.0T MRI for long-term observation of lung nodules post cryoablation: a pilot study[J]. Cancer Imaging, 2017, 17(1): 29. DOI:10.1186/s40644-017-0131-7 |
| [7] |
吕桂梅. 手术治疗法配合定位放射治疗老年口腔颌面部肿瘤[J]. 中国实用医刊, 2016, 43(4): 26-27. [Lyu GM. Clinical observation of operation method with positioning radiotherapy in elderly oral and maxil-lofacial tumors[J]. Zhongguo Shi Yong Yi Kan, 2016, 43(4): 26-27. DOI:10.3760/cma.j.issn.1674-4756.2016.04.013] |
| [8] |
Yan QH, Xu DG, Shen YF, et al. Observation of the effect of targeted therapy of 64-slice spiral CT combined with cryoablation for liver cancer[J]. World J Gastroenterol, 2017, 23(22): 4080-4089. DOI:10.3748/wjg.v23.i22.4080 |
| [9] |
吕佳佳, 丁晓旭, 姜菲菲, 等. 上颌窦癌上颌骨全切除后更换永久性赝复体的语音效果评价[J]. 现代肿瘤医学, 2018, 26(12): 1834-1838. [Lyu JJ, Ding XX, Jiang FF, et al. Speech intelligibility of patients with defect repaired by permanent prosthesis after total re-section of the maxilla in the maxillary sinus cancer[J]. Xian Dai Zhong Liu Yi Xue, 2018, 26(12): 1834-1838. DOI:10.3969/j.issn.1672-4992.2018.12.007] |
| [10] |
Ma Y, Wallace AN, Waqar SN, et al. Percutaneous Image-Guided Ablation in the Treatment of Osseous Metastases from Non-small Cell Lung Cancer[J]. Cardiovasc Intervent Radiol, 2018, 41(5): 726-733. |
| [11] |
查洋, 吕威, 亓放, 等. 上颌窦出血坏死性息肉的CT和MRI特点[J]. 山东大学耳鼻喉眼学报, 2018, 32(4): 37-42. [Zha Y, Lyu W, Qi F, et al. Computed tomography and magnetic resonance imaging features of maxillary hemorrhagic necrotizing polyps[J]. Shandong Da Xue Er Bi Hou Yan Xue Bao, 2018, 32(4): 37-42.] |
| [12] |
Mouli SK, Kurilova I, Sofocleous CT, et al. The Role of Percutaneous Image-Guided Thermal Ablation for the Treatment of Pulmonary Malignancies[J]. AJR Am J Roentgenol, 2017, 209(4): 740-751. DOI:10.2214/AJR.17.18368 |
| [13] |
Pan PJ, Bansal AK, Genshaft SJ, et al. Comparison of Double-Freeze versus Modified Triple-Freeze Pulmonary Cryoablation and Hemorrhage Volume Using Different Probe Sizes in an In Vivo Porcine Lung[J]. J Vasc Interv Radiol, 2018, 29(5): 722-728. DOI:10.1016/j.jvir.2017.11.016 |
| [14] |
王彩娇, 王永刚, 于璐, 等. 上颌窦癌术后即刻修复与延期修复对比研究[J]. 中华肿瘤防治杂志, 2018, 25(15): 1110-1112. [Wang CJ, Wang YG, Yu L, et al. Clinical study of immediate and delayed repair of maxillary sinus cancer[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2018, 25(15): 1110-1112.] |
| [15] |
孔月虹, 涂文勇, 程昌明, 等. 放疗早期对口腔颌面部肿瘤患者免疫功能影响的临床研究[J]. 口腔颌面外科杂志, 2016, 26(2): 110-114. [Kong YH, Tu WY, Cheng CM, et al. Effects of Radiotherapy on the Immune Function in Patients with Oral and Maxillofacial Cancer[J]. Kou Qiang He Mian Wai Ke Za Zhi, 2016, 26(2): 110-114. DOI:10.3969/j.issn.1005-4979.2016.02.007] |
| [16] |
Vroomen LGPH, Petre EN, Cornelis FH, et al. Irreversible electroporation and thermal ablation of tumors in the liver, lung, kidney and bone: What are the differences?[J]. Diagn Interv Imaging, 2017, 98(9): 609-617. DOI:10.1016/j.diii.2017.07.007 |
| [17] |
Choi EJ, Jin GY. Pulmonary Embolism after Percutaneous Cryoablation for Lung Cancer: A Case Report[J]. J Vasc Interv Radiol, 2017, 28(9): 1285-1287. DOI:10.1016/j.jvir.2017.03.018 |
| [18] |
彭振兴, 徐先发, 魏伯俊, 等. 上颌窦癌并发上颌窦真菌性鼻窦炎1例[J]. 中国耳鼻咽喉头颈外科, 2016, 23(1): 59-60. [Peng ZX, Xu XF, Wei BJ, et al. A case of maxillary sinus carcinoma complicated with fungal sinusitis[J]. Zhongguo Er Bi Yan Hou Tou Jing Wai Ke, 2016, 23(1): 59-60.] |
| [19] |
Frenk NE, Daye D, Tuncali K, et al. Local Control and Survival after Image-Guided Percutaneous Ablation of Adrenal Metastases[J]. J Vasc Interv Radiol, 2018, 29(2): 276-284. DOI:10.1016/j.jvir.2017.07.026 |
 2020, Vol. 47
2020, Vol. 47