文章信息
- 皮层肌动蛋白可通过PI3K-AKT通路调控食管鳞癌细胞的增殖和凋亡
- Cortactin Could Regulate Proliferation and Apoptosis of Esophageal Squamous Carcinoma Cells Through PI3K-AKT Pathway
- 肿瘤防治研究, 2020, 47(6): 421-426
- Cancer Research on Prevention and Treatment, 2020, 47(6): 421-426
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1433
- 收稿日期: 2019-11-14
- 修回日期: 2020-03-12
2. 056002 邯郸,河北工程大学附属医院病理科
2. Department of Pathology, Affiliated Hospital of Hebei University of Engineering, Handan 056002, China
食管鳞癌是全球范围内发病率高并且严重威胁人类生命健康的消化道恶性肿瘤之一,我国是世界上食管鳞癌新发病例最多的国家,男性明显多于女性。2018年中国癌症流行病学统计显示食管鳞癌在男性最常见的癌症中位居第5位(9.0%)[1]。众所周知,食管鳞癌预后差、病死率高,并且近年来发病率有逐渐升高的趋势,但是其发病机制尚不清楚。大量研究表明,皮层肌动蛋白(cortactin, CTTN)能调控多种肿瘤的发生发展,如乳腺癌[2]、膀胱癌[3]、头颈部鳞癌[4]等。在我们的前期研究[5]中发现CTTN不仅在食管鳞癌中高表达而且与患者的病理分期、不良预后明显相关。因此本研究通过敲低和过表达CTTN,探讨其对食管鳞癌细胞增殖和凋亡以及PI3K-AKT的影响,旨在阐明CTTN调控食管鳞癌的分子机制。
1 材料与方法 1.1 材料 1.1.1 细胞系人食管鳞癌细胞系EC109、TE1购自中国科学院上海生命科学研究院细胞资源中心。
1.1.2 裸鼠本课题所用的荷瘤模型均为5~6周龄健康雄性BALB/c裸鼠,购于北京维通利华实验动物技术有限公司(许可证号:SCXK(冀)1403088),由河北医科大学第四医院实验动物中心专职人员负责饲养。整个实验过程符合中华人民共和国《实验动物管理条例》及伦理要求。
1.1.3 慢病毒过表达及干扰CTTN的慢病毒载体由上海吉玛制药技术有限公司构建。过表达CTTN的慢病毒采用LV17载体,元件顺序为EF-1a-CMV-luci17-T2A-puromycin,插入载体序列:GGCGAATTCTGATGTGGAAAGCCTCTGC。干扰CTTN的慢病毒采用LV16(U6/Luciferase17 & Puro)载体,元件为U6-CMV-/Luc17-T2A-puromycin,插入序列CCATGGCT ATGGAGGGA AATT。两载体的对照载体插入序列均为:TTCTCCGAACGTGTCACGT。
1.1.4 主要试剂及抗体RPMI 1640培养基、胎牛血清、胰蛋白酶-EDTA溶液、青链霉素购自美国Gibco BRL公司。高效RIPA组织/细胞裂解液、磷酸酶抑制剂盒4×蛋白上样缓冲液均购自北京索莱宝科技有限公司。BCA蛋白浓度测定试剂盒购自美国Thermo Fisher Scientific公司。CCK-8试剂盒购自东仁化学科技(上海)有限公司。兔抗CTTN、PCNA、cleaved-PARP、β-actin单克隆抗体均购自武汉三鹰生物技术有限公司。兔抗cleaved-Caspase3单克隆抗体购自美国Abcam公司。小鼠抗p-PI3K、p-AKT单克隆抗体均购自美国CST公司。兔抗PI3K、AKT多克隆抗体均购自上海斯信生物科技有限公司。荧光标记的羊抗兔二抗、荧光标记的羊抗小鼠二抗均购自美国LI-COR公司。
1.2 方法 1.2.1 细胞培养、传代及冻存EC109、TE1置于含10%FBS、100 u/ml青霉素、100 µg/ml链霉素的RPMI 1640完全培养基中,在5%CO2孵箱中37℃恒温培养。当细胞生长至80%~90%融合度时,常规胰酶消化、传代,取处于对数生长期的细胞用于实验。暂时不用的细胞按常规流程予以冻存。
1.2.2 慢病毒感染实验及稳定细胞株的筛选在食管鳞癌细胞EC109、TE1中敲低、过表达CTTN:根据上海吉玛公司提供的慢病毒使用说明书进行细胞慢病毒感染及后续嘌呤霉素的筛选稳定细胞株。EC109、TE1分别分为四组:过表达组(LV-CTTN)、对照组(LV-NC)和敲低组(LV-sh-CTTN)、对照组(LV-sh-NC)。经嘌呤霉素筛选后的稳定细胞检测过表达和抑制效果。
1.2.3 Western blot检测常规收集细胞、提取总蛋白,为防止磷酸化蛋白的降解,细胞裂解液中需添加PMSF和磷酸酶抑制剂。蛋白采用BCA法定量后组间稀释成相同的合适浓度,加4×上样Buffer 95℃加热8 min。根据蛋白分子量制作合适浓度的SDS-PAGE胶,上样,电泳,采用PVDF膜湿转法转膜,后5%脱脂奶粉封闭PVDF膜。根据抗体说明书用TBST稀释一抗:cleaved-PARP(1:1000)、PCNA(1:3000)、cleaved-Caspase3(1:200)、p-PI3K(1:500)、PI3K(1:1000)、p-AKT(1:500)、AKT(1:800)、β-actin(1:5000),PVEF膜在稀释的一抗中4℃孵育过夜。荧光二抗用TBST按1:20000稀释,室温避光孵育1 h,最后采用Odyssey双色红外激光成像系统进行扫描。
1.2.4 CCK-8实验筛选好的EC109、TE1的稳定细胞株按以上分组接种于96孔板,先饥饿细胞(无血清培养基培养)12。后分别在0、24、48、72和96 h加入CCK-8试剂,培养箱内孵育3 h。用酶标仪测定在450 nm处的吸光度(OD)。
1.2.5 平板克隆形成实验将筛选后的稳定细胞株按以上分组接种于6孔板中,每孔1 000个细胞,在37℃、5%CO2培养箱中培养,待出现肉眼可见的克隆时,终止培养,4%甲醛固定10 min,后Giemsa染液染色20 min,最后流水冲洗,空气干燥。肉眼计数克隆数。
1.2.6 软琼脂克隆形成实验将筛选后的稳定细胞株按以上分组消化离心后用2×完全培养基重悬,调整细胞浓度为2×103个/毫升。底层琼脂的配制:以1:1的比例混合1.2%的琼脂和2×完全培养基,含细胞的上层琼脂的配制:以1:1的比例混合0.6%的琼脂和上述制备好的单细胞悬液,待上层琼脂凝固后,放入孵箱培养。2周后计数克隆数。
1.2.7 裸鼠荷瘤实验选用5~6周龄、18~20 g雄性BALB/c裸鼠10只,随机分为两组:EC109细胞LV-sh-NC组和LV-sh-CTTN组,每组5只;将两组对数生长期的EC109细胞悬液0.2 ml(1×107个)接种于裸鼠右侧腋下皮肤,待肿瘤出现后,用游标卡尺测量记录两组裸鼠皮下肿瘤体积的变化(每2天测量1次,共2周),肿瘤体积V=a×b2×1/6π,a为肿瘤最长径,b为最短径。以每组动物移植瘤体积的均数±标准差来绘制移植瘤生长曲线。
1.3 统计学方法应用SPSS19.0进行统计学分析。计量资料首先进行正态性检验,符合正态性检验的以均数±标准差(x±s)表示,两组间的比较采用两独立样本t检验。两组不同时间点的细胞相对增殖率、移植瘤体积大小比较采用双因素方差分析(two-way ANOVA)。P < 0.05为差异有统计学意义。
2 结果 2.1 慢病毒感染过表达、敲低CTTN效果的验证Western blot结果显示EC109、TE1细胞过表达组(LV-CTTN组)的CTTN表达水平均明显高于对照组(LV-NC组)(8.38±0.28 vs. 4.08±0.35, 7.39±0.29 vs. 3.39±0.31, P=4.12E-04, P=2.28E-04),见图 1A;EC109、TE1细胞敲低组(LV-sh-CTTN组)的CTTN表达水平均显著低于对照组(LV-sh-NC组)(1.07±0.16 vs. 4.16±0.26, 0.84±0.14 vs. 3.46±0.27, P=6.56E-04, P=5.87E-04),见图 1B。
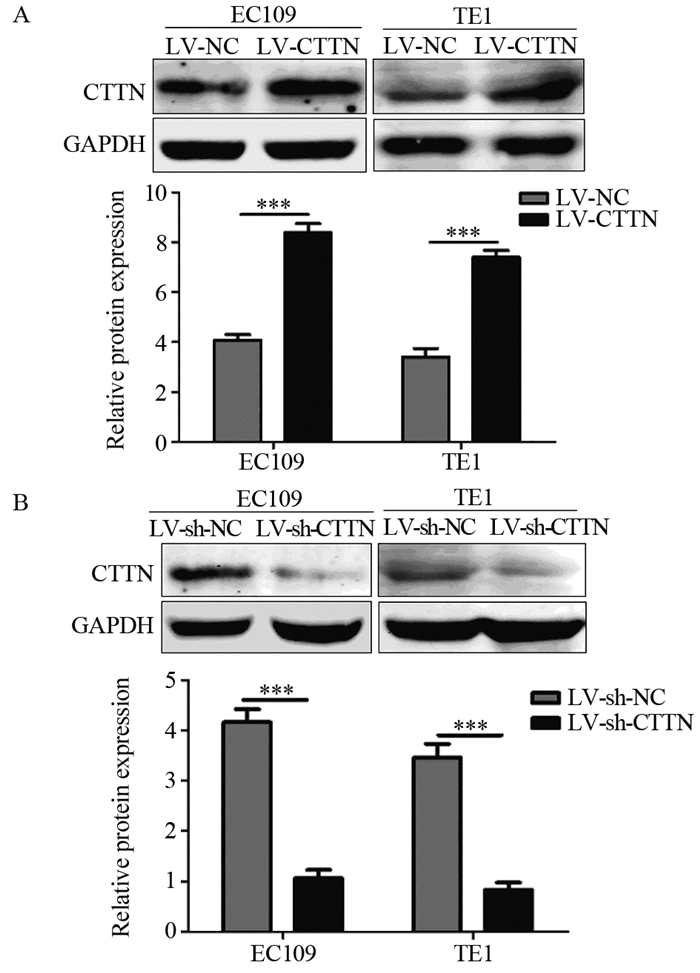
|
| ***: P < 0.001. 图 1 慢病毒LV-CCTN、LV-sh-CCTN在食管鳞癌细胞系中过表达(A)、敲低CTTN(B) Figure 1 Cortactin(CTTN) was overexpressed(A) and down-regulated(B) by lentivirus LV-CCTN and LV-sh-CCTN in ESCC cell lines |
Western blot结果显示,两种食管鳞癌细胞系的LV-CTTN组与其各自LV-NC组相比,细胞核增殖抗原PCNA、PI3K-AKT通路的关键蛋白p-PI3K、p-AKT均明显升高(P=4.143E-04, P=3.11E-04, P=2.15E-04),而凋亡标志蛋白cleaved-Caspase3、cleaved-PARP的表达明显降低(P=1.14E-04, P=2.34E-04),见图 2A、C;与LV-sh-NC组相比,两种食管鳞癌细胞系的LV-sh-CTTN组PCNA、p-PI3K、p-AKT表达均显著下降(P=3.36E-04, P=1.98E-04, P=3.11E-04),同时cleaved-Caspase3、cleaved-PARP代表凋亡的蛋白表达明显升高(P=1.78E-04, P=3.61E-04),见图 2B、D。
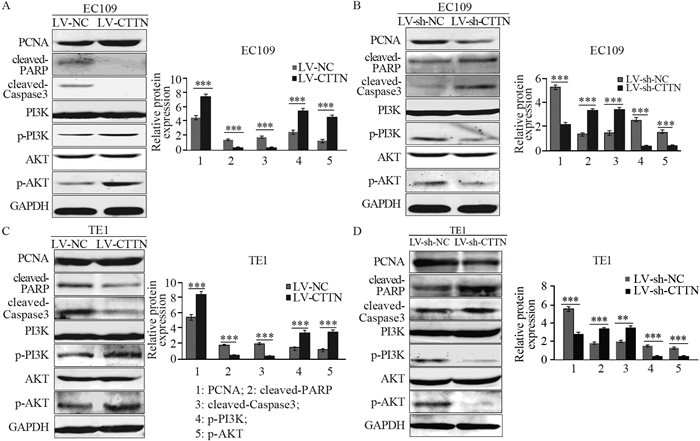
|
| **: P < 0.01, ***: P < 0.001. 图 2 过表达CTTN通过PI3K-AKT通路促进EC109、TE1细胞增殖和凋亡(A, C),敲低CTTN可通过PI3K-AKT通路抑制EC109、TE1细胞增殖和凋亡(B, D) Figure 2 Effect of CTTN overexpression(A, C) and knockdown(B, D) on proliferation and apoptosis of EC109 and TE1 cells through PI3K-AKT pathway |
CCK-8实验结果显示,两种食管鳞癌细胞系EC109、TE1的LV-CTTN组较其各自LV-NC组细胞活力均明显升高(P=9.5E-04,P=8.7E-03);与相应对照组相比,敲低CTTN能显著降低两种食管鳞癌细胞系EC109、TE1的细胞活力(P=8.3E-04, P=6.9E-03),见图 3。
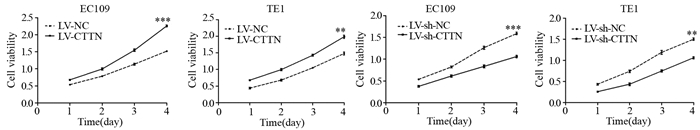
|
| **: P < 0.01, ***: P < 0.001, compared with LV-sh-NC; ESCC: esophageal squamous cell carcinoma. 图 3 CTTN的表达水平调控食管鳞癌细胞系的细胞活力 Figure 3 Effect of CTTN expression on viability of ESCC cell lines |
平板克隆形成实验反映细胞增殖,结果显示:两种食管鳞癌细胞系EC109、TE1的LV-NC组的细胞克隆数分别为39.50±1.90、28.80±2.310,而LV-CTTN组形成的克隆数分别为83.50±1.80、63.2±1.50,显著高于对照组(P=9.32E-05, P=8.21E-04);两种食管鳞癌细胞系EC109、TE1的LV-sh-CTTN组的细胞克隆数分别为15.50±1.00、13.5±1.90,明显低于LV-sh-NC组42.00±2.40、29.80±2.30,差异有统计学意义(P=5.78E-04, P=3.41E-04),见图 4A。
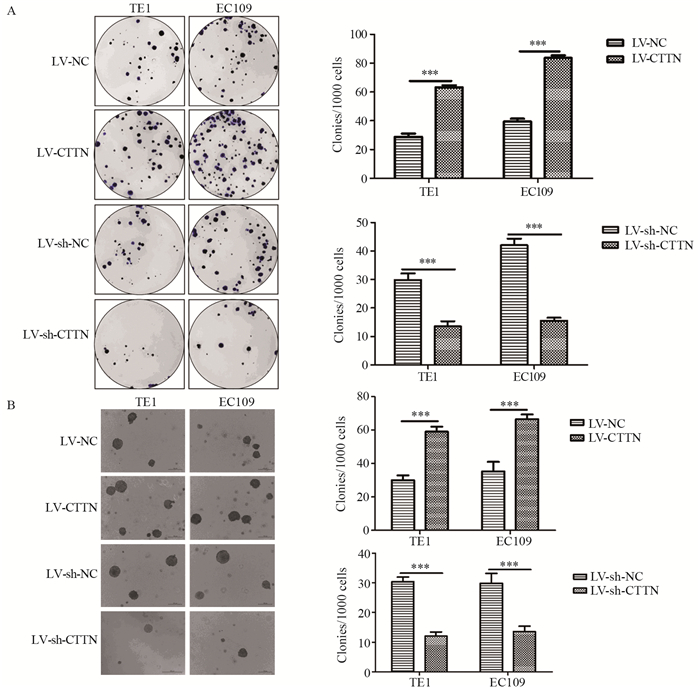
|
| ***: P < 0.001, compared with LV-sh-NC. 图 4 CTTN的表达水平调控ESCC细胞系的克隆形成 Figure 4 Effect of CTTN expression on colony formation of ESCC cell lines |
软琼脂克隆实验评估肿瘤细胞在动物细胞的成瘤性,结果显示:两种食管鳞癌细胞系EC109、TE1的LV-NC组的细胞克隆数分别为35.30±5.60、29.00±2.89,而LV-CTTN组形成的克隆数分别为66.50±2.90、59.00±3.00,显著高于对照组(P=2.81E-04, P=3.61E-04);两种食管鳞癌细胞系EC109、TE1的LV-sh-CTTN组的细胞克隆数分别为13.50±1.87、12.00±1.40,明显低于LV-sh-NC组29.80±3.30、28.8±1.63,差异有统计学意义(P=1.92E-04, P=1.87E-04),见图 4B。
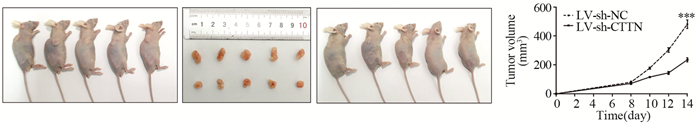
2.3 敲低CTTN抑制裸鼠EC109细胞皮下移植瘤生长基于以上体外实验结果,为进一步验证CTTN促进食管鳞癌细胞生长的作用,我们应用裸鼠荷瘤实验观察敲低CTTN对裸鼠EC109细胞皮下种植瘤生长的影响。LV-sh-CTTN组裸鼠平均肿瘤体积明显小于LV-sh-NC组(P=6.42E-04),见图 5。
|
| ***: P < 0.001, compared with LV-sh-NC. 图 5 敲低CTTN可抑制裸鼠EC109细胞皮下移植瘤生长 Figure 5 CTTN knockdown suppressed growth of transplant subcutaneous tumor of EC109 cells in nude mice |
CTTN是重要的肿瘤调控分子,在多种肿瘤中存在高表达。CTTN易发生酪氨酸和丝氨酸/苏氨酸磷酸化,磷酸化的CTTN促进肿瘤细胞侵袭性伪足成熟和细胞外基质的降解,进而增强肿瘤细胞的侵袭和转移能力,CTTN这种生物学功能近年来已在大量研究中得到证实。例如,有研究报道CTTN通过上调细胞分裂因子1促进结肠癌的侵袭和转移。CTTN在ATM激酶的介导下发生磷酸化和聚合进而促进乳腺癌的侵袭和转移[6]。CTTN这种生物学功能在非小细胞肺癌[7]中也得到了证实。但是CTTN能否促进肿瘤细胞增殖并抑制凋亡在不同的肿瘤中结论不一致。先前有研究报道在NIH3T3细胞中过表达CTTN能促进细胞的运动和迁移能力但并不能促进细胞增殖。然而最近在肝癌和胶质瘤中发现CTTN不仅能促进细胞增殖而且抑制细胞凋亡[8-9]。
PCNA反映细胞DNA合成状态,因此常用作反映细胞增殖的指标[10]。Caspase3[11]介导蛋白酶级联反应引起的细胞程序化死亡是细胞凋亡最重要的途径。Caspase3的底物包括Caspase3自身、PARP(poly ADP-ribose polymerase)、DNA依赖的蛋白激酶以及细胞因子等,Caspase3通过水解这些底物传导凋亡信号,引发细胞凋亡。PARP是与DNA修复密切相关的一种酶,在体外可以被多种Caspase剪切,在体内是Caspase3的主要剪切对象。因此cleaved-Caspase3、cleaved-PARP可以作为反映凋亡的标志蛋白,同时cleaved-PARP也可以作为Caspase3激活的指标[12]。本研究结果显示,过表达CTTN不仅能提高细胞PCNA表达水平,提升细胞活力,而且增加细胞克隆形成;反之,敲低CTTN后PCNA表达水平、细胞活力受到抑制,同时抑制细胞克隆的形成以及裸鼠皮下种植瘤的生长。综合评估,结果均显示CTTN促进食管鳞癌细胞增殖,抑制凋亡。
PI3K-AKT通路调控多种肿瘤的发生发展[13],是经典的细胞通路,发挥促进细胞增殖、抑制凋亡、促进血管生成、促进侵袭转移以及抗化疗等广泛作用。在本课题中,与对照组相比,过表达CTTN上调PI3K-AKT通路的关键蛋白p-PI3K、p-AKT的表达水平,同时与对照组相比,敲低CTTN抑制p-PI3K、p-AKT的表达提示CTTN通过上调PI3K-AKT通路促进食管鳞癌的增殖并抑制凋亡。表明针对CTTN的拮抗剂如siRNA或者抑制剂有望成为食管鳞癌精准治疗的新靶点。
综上所述,本研究从细胞水平和动物实验探究了CTTN对食管鳞癌增殖和凋亡方面的作用及机制,但在食管鳞癌中CTTN是否还发挥其他生物学作用,还有待进一步探讨。
作者贡献
张九娜:细胞和Western blot实验、数据统计分析和论文撰写
翟山:细胞实验、数据统计分析及论文撰写
李校天:论文撰写与修改
| [1] |
Feng RM, Zong YN, Cao SM, et al. Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics?[J]. Cancer Commun (Lond), 2019, 39(1): 22. DOI:10.1186/s40880-019-0368-6 |
| [2] |
Karamanou K, Franchi M, Vynios D, et al. Epithelial-to-mesenchymal transition and invadopodia markers in breast cancer: Lumican a key regulator[J]. Semin Cancer Biol, 2019, pii: S1044-579X(19)30121-X. |
| [3] |
Islam A, Yang YT, Wu WH, et al. Capsaicin attenuates cell migration via SIRT1 targeting and inhibition to enhance cortactin and β-catenin acetylation in bladder cancer cells[J]. Am J Cancer Res, 2019, 9(6): 1172-1182. |
| [4] |
Ramos-García P, González-Moles MÁ, Ayén Á, et al. Prognostic and clinicopathological significance of CTTN/cortactin alterations in head and neck squamous cell carcinoma: systematic review and meta-analysis[J]. Head Neck, 2019, 41(6): 1963-1978. DOI:10.1002/hed.25632 |
| [5] |
张九娜, 李校天, 瞿峰, 等. 食管鳞癌组织中血管内皮生长因子C、皮层肌动蛋白的表达及其临床意义[J]. 中国综合临床, 2016, 32(4): 319-324. [Zhang JN, Li XT, Qu F, et al. VEGF-C and CTTN expression in esophageal squamous cell carcinoma and its clinical significance[J]. Zhongguo Zong He Lin Chuang, 2016, 32(4): 319-324. DOI:10.3760/cma.j.issn.1008-6315.2016.04.010] |
| [6] |
Lang L, Hou Y, Chen Y, et al. ATM-Mediated Phosphorylation of Cortactin Involved in Actin Polymerization Promotes Breast Cancer Cells Migration and Invasion[J]. Cell Physiol Biochem, 2018, 51(6): 2972-2988. DOI:10.1159/000496048 |
| [7] |
Li Y, Zhang H, Gong H, et al. miR-182 suppresses invadopodia formation and metastasis in non-small cell lung cancer by targeting cortactin gene[J]. J Exp Clin Cancer Res, 2018, 37(1): 141. DOI:10.1186/s13046-018-0824-1 |
| [8] |
Li Y, Fu Y, Hu X, et al. The HBx-CTTN interaction promotes cell proliferation and migration of hepatocellular carcinoma via CREB1[J]. Cell Death Dis, 2019, 10(6): 405. DOI:10.1038/s41419-019-1650-x |
| [9] |
Su HY, Lin ZY, Peng WC, et al. MiR-448 downregulates CTTN to inhibit cell proliferation and promote apoptosis in glioma[J]. Eur Rev Med Pharmacol Sci, 2018, 22(12): 3847-3854. |
| [10] |
Chen W, Wu M, Hang T, et al. Structure insights into the molecular mechanism of the interaction between UHRF2 and PCNA[J]. Biochem Biophys Res Commun, 2017, 494(3-4): 575-580. DOI:10.1016/j.bbrc.2017.09.102 |
| [11] |
Jung JH, Shin EA, Kim JH, et al. NEDD9 inhibition by mir-25-5p activation is critically involved in co-treatment of melatonin- and pterostilbene-induced apoptosis in colorectal cancer cells[J]. Cancers (Basel), 2019, 11(11): pii: E1684. DOI:10.3390/cancers11111684 |
| [12] |
Dulaney C, Marcrom S, Stanley J, et al. Poly(ADP-ribose) polymerase activity and inhibition in cancer[J]. Semin Cell Dev Biol, 2017, 63: 144-153. DOI:10.1016/j.semcdb.2017.01.007 |
| [13] |
Aoki M, Fujishita T. Oncogenic roles of the PI3K/AKT/mTOR axis[J]. Curr Top Microbiol Immunol, 2017, 407: 153-189. |
 2020, Vol. 47
2020, Vol. 47


