文章信息
- 重组沙门氏菌VNP20009-M对骨肉瘤的治疗作用
- Therapeutic Effect of Recombinant Salmonella VNP20009-M on Osteosarcoma
- 肿瘤防治研究, 2020, 47(12): 931-935
- Cancer Research on Prevention and Treatment, 2020, 47(12): 931-935
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1407
- 收稿日期: 2019-11-11
- 修回日期: 2020-06-27
2. 510000广州,华南理工大学生物科学与工程学院
2. School of Biology and Biological Engineering, South China University of Technology, Guangzhou 510000, China
骨肉瘤(osteosarcoma, OS)在恶性骨肿瘤中发病率最高,对0~24岁青少年危害最大,且其高发转移,一旦发展为远端转移,5年生存率仅20%~30%[1]。目前尽管使用了一些新的治疗方法如增加化疗时间、提高药物剂量或增加免疫治疗,但均未取得较显著的整体改善[2]。
VNP20009为沙门菌属,是肿瘤靶向治疗领域中研究最广泛的细菌,具有较高安全性,目前已应用于多种小鼠荷瘤模型中,如黑色素瘤、肺癌、结肠癌等[3]。甲硫氨酸(Met)依赖性几乎表现在所有恶性肿瘤细胞中,而正常细胞不存在Met依赖性[4]。甲硫氨酸酶(L-methioninase)可以特异性地将甲硫氨酸分解,但外源性给予有一定的不良反应[5]。
本研究利用沙门氏菌的肿瘤靶向性以及骨肉瘤细胞甲硫氨酸代谢异常的特性,以VNP20009为载体,制备了高表达甲硫氨酸酶的减毒沙门氏菌VNP20009-M,利用代谢的手段在细胞和动物水平评估VNP-M对骨肉瘤的治疗作用及其机制。
1 材料与方法 1.1 细菌与细胞株VNP20009(YS1646)购自美国ATCC公司。MNNG-HOS、U2OS、SaoS-2购自中国科学院典型培养物保藏委员会细胞库。
1.2 质粒、载体和酶活性PSV-SPORT质粒购自美国Invitrogen公司;pRlenti-CAG-MCS-IRES2-EGFP,MEGL CDS质粒购自上海生工公司。通过电穿孔用质粒PSV-SPORT或PSV-SPORT-L-methioninase转染鼠伤寒沙门氏菌衍生物VNP20009,构建对照菌株VNP20009-V(VNP-V)和目的菌株VNP20009-M(VNP-M)。甲硫氨酸酶活性的测定基于Sun等建立的方法[6]。
1.3 主要试剂与仪器试剂:MEM、McCoy’s 5A、胎牛血清和胰酶均购自美国Gibco公司;E.Z.N.A. Total RNA Kit Ⅰ购自美国OMEGA公司;Power SYBR Green PCR Master Mix购自诺唯赞(南京)公司;引物由上海生工生物有限公司合成;迁移小室(24室直径8.0 μm)购自美国Corning公司。
仪器:AC2-4S1型二级生物安全柜(ESCO,新加坡);CLM-170B-8-NF型CO2培养箱(ESCO,新加坡);TDZ5-WS型多管架自动平衡离心机(上海卢湘仪离心机仪器有限公司);ChemiDoc+XRS化学发光凝胶成像系统(Bio-Rad,美国);Leica倒置显微镜(Leica德国);CMAXPLUS+酶标仪(MD,美国);-80℃冰箱(中国美菱公司)。
1.4 菌液PCR与质粒PCR将生长至对数期的VNP-V与VNP-M菌液各取1 μl稀释于100 μl无菌超纯水中,98℃金属浴5 min作为菌液PCR模板;按照质粒中提试剂盒(Thermo Fisher K210005)说明书抽提生长至对数期的VNP-V与VNP-M质粒,并稀释至1 ng/μl作为质粒PCR模板;PCR试剂盒(中国南京诺唯赞生物科技有限公司P131-03)。
1.5 骨肉瘤细胞培养MNNG-HOS细胞培养在含MEM和10%FBS的培养基中,Saos-2细胞培养于McCoy’s 5A+20%FBS的培养基中,U2OS细胞培养于McCoy’s 5A+10%FBS的培养基中,所有细胞均于37℃、5%CO2培养箱中培养。待细胞生长至培养皿70%~80%时进行传代。
1.6 骨肉瘤细胞凋亡、增殖和迁移能力检测将骨肉瘤细胞与对照菌株和携带甲硫氨酸酶的目的菌株于37℃共培养4 h,PBS洗涤后置于补充有链霉素和卡那霉素的培养基中培养。膜联蛋白V-FITC细胞凋亡检测试剂盒(BD 556547)检测癌细胞凋亡,流式细胞术分析结果;CCK-8测定法测量癌细胞活力;将细胞接种至Transwell上室,下室中20%FBS作为吸引剂,用棉签去除非侵入细胞,结晶紫染色入侵细胞,显微镜拍摄图像并定量。
1.7 实时定量PCR检测提取细胞总RNA使用Vazyme(中国)反转录试剂盒反转RNA得到cDNA,随后以反转cDNA为模版,加入Power SYBR Green PCR Master Mix以及相应基因引物对目的基因进行RT-PCR。反应条件:50℃ 2 min,95℃ 30 s,95℃ 15 s,58℃ 30 s,72℃ 30 s为一个循环,共40个循环。引物核酸序列为: MEGL-F: 5’-ATGCGCGACTCCCATAAC-3’; MEGL-R: 5’-TCATGCACACACGCCTCCAA-3’。
1.8 病理学分析使用10%福尔马林固定肿瘤组织,石蜡包埋,苏木精和伊红(H & E)染色,Nikon显微镜拍摄图像。
1.9 质粒转染细胞利用对照质粒pRlenti-CAG-MCS-IRES2-EGFP(EGFP)与携带甲硫氨酸酶基因的目的质粒:MEGL CDS(MEGL)瞬时转染骨肉瘤细胞,得到对照组(EGFP)与高表达甲硫氨酸酶基因的实验组(MEGL),同时实验使用PBS代替转染试剂设置完全对照组(CON)。
细胞转染实验前一天以每室2×105个细胞接种至6孔板中,待细胞生长密度至40%~60%后准备转染;使用赛默飞(中国)Lipo2000转染试剂。将配置好的转染试剂加入6孔板中,轻轻晃动,使脂质体混合均匀,37℃、5%CO2培养。
1.10 动物实验6~7周龄的雌性无胸腺裸鼠(BALB/c nu/nu)购自南京大学动物实验中心,饲养于广东药科大学实验动物中心,实验方案严格遵循广东药科大学动物护理委员会(批号:GOPUSPF2017048)制定的动物护理方针。接种之前,胰蛋白酶消化收获肿瘤细胞,并通过细胞过滤器去除细胞聚集体,洗涤细胞,计数,并稀释至6.5×104/μl PBS中进行皮下接种。
实验分组及设计:待肿瘤体积达到60~80 mm3时,将荷瘤裸鼠随机分为5组,每组8只。采用瘤内注射方式给药一次。低剂量组分别注射浓度为2×103 cfu/μl PBS的两种基因工程菌;高剂量组分别注射浓度为2×105cfu/μl PBS的两种基因工程菌;完全对照组注射10 μl PBS。随后连续测量小鼠体质量,观察其活动状态并定期通过游标卡尺测量肿瘤大小,计算肿瘤体积,绘制肿瘤生长曲线。
1.11 统计学方法采用GraphPad5软件进行数据整理和统计分析,计量资料以(x±s)表示,P < 0.05为差异有统计学意义。除了图注中指出采用特殊的统计方法以外,两两之间比较采用双尾Student’s t检验,多组比较采用单因素方差分析和Tukey’s检验。
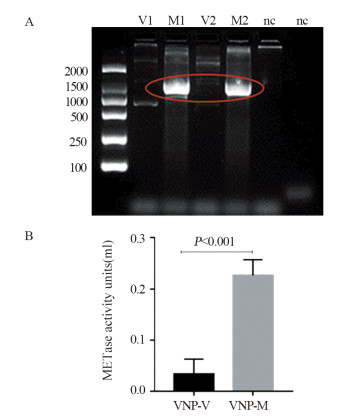
2 结果 2.1 构建表达甲硫氨酸酶的基因工程菌VNP-M菌液PCR与质粒PCR实验结果显示,VNP-M的菌液和质粒在1 200 bp处有特异性条带(甲硫氨酸酶基因L-methioninase全长1 200 bp),携带甲硫氨酸酶基因的基因工程菌构建成功,见图 1A。与目的基因(L-methioninase)比对,VNP-M中的甲硫氨酸酶基因序列测序正确。比色法检测结果进一步显示,VNP-M甲硫氨酸酶的活性显著高于VNP-V(P < 0.001),见图 1B。
|
| A: PCR and extracted plasmid PCR showed that the target band only presented in the constructed bacteria VNP-M. (PSV-SPORT-L-methioninase sequence length was 1200 bp.). B: The methioninase activity in VNP-M was significantly higher than that in VNP-V. 图 1 VNP20009-M菌株中甲硫氨酸酶基因及活性检测 Figure 1 Detection of methioninase gene and activity in VNP20009-M |
结果显示,VNP-M与VNP-V均可诱导癌细胞凋亡,且VNP-M促凋亡效果更显著(Annexin-V阳性细胞比例为:VNP-V:VNP-M为13.39% : 56.19%),见图 2。

|
| MNNG-HOS cells were treated with different bacteria. VNP-M significantly induced cell apoptosis. 图 2 VNP20009-M对骨肉瘤细胞凋亡的影响 Figure 2 Effect of VNP20009-M on apoptosis of osteosarcoma cells |
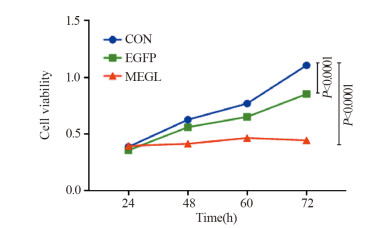
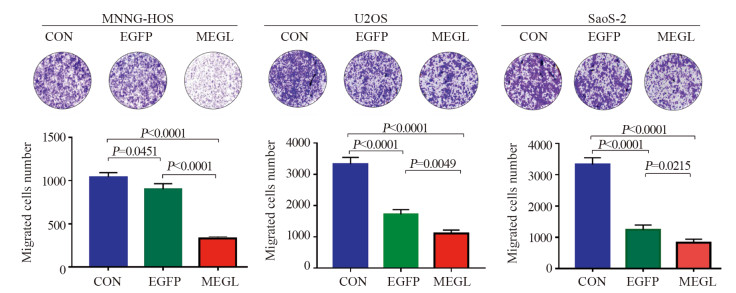
高表达甲硫氨酸酶基因能显著抑制骨肉瘤细胞株MNNG-HOS的增殖能力,见图 3;高表达甲硫氨酸酶显著抑制MNNG-HOS、U2OS及SaoS-2细胞的迁移能力,见图 4。
|
| CON: control; EGFP: pRlenti-CAG-MCS-IRES2-EGFP plasmid; MEGL: MEGL CDS plasmid. 图 3 过表达甲硫氨酸酶对MNNG-HOS细胞增殖的影响 Figure 3 Effect of methioninase overexpression on proliferation of MNNG-HOS cells |
|
| 图 4 过表达甲硫氨酸酶对骨肉瘤细胞迁移能力的影响 Figure 4 Effect of methioninase overexpression on migration ability of osteosarcoma cells |
骨肉瘤皮下异种移植瘤模型瘤内分别给予高低剂量药物后,荷瘤鼠的活动、进食无明显差别,体质量呈稳定趋势。
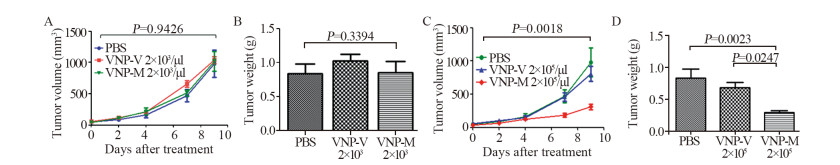
与对照组相比,VNP-V及VNP-M低剂量组小鼠肿瘤体积均无显著性差异,见图 5A~B;而VNP-M高剂量治疗后,骨肉瘤生长速度明显放缓(P < 0.01),见图 5C~D,其瘤体重量约为对照组的1/3。给药治疗10天后,高剂量VNP-M治疗后肿瘤体积与瘤重均显著低于对照组,进一步证实较高浓度VNP-M能够有效抑制在体骨肉瘤的生长。
|
| 图 5 基因工程菌治疗对小鼠肿瘤体积和瘤重的影响 Figure 5 Effect of genetically engineered bacteria treatment on tumor volume and tumor weight in mice |
甲硫氨酸依赖性地存在于绝大部分肿瘤细胞内[7],已有研究表明在患者饮食中限制甲硫氨酸的摄入可以有效减少包括胰腺癌、肾癌等肿瘤的生长[5],但长期的甲硫氨酸缺失在一定程度上会造成患者营养不良,反而加重病情。有研究证明通过腹腔注射重组甲硫氨酸酶能有效遏制裸鼠吉田肉瘤与肺部肿瘤[8],但由于哺乳动物本身不表达甲硫氨酸酶,外源性地给予甲硫氨酸酶具有一定风险[9]。早在1868年,德国医生Busch首次使用化脓性链球菌感染恶性肉瘤患者,并得到一定的治疗效果。而后德国医生Fehleisen和美国医生William B.Coley先后报道了利用化脓性链球菌完全治愈恶性肉瘤患者的病例[10]。目前肿瘤的细菌疗法已经成为研究热门,其中减毒沙门氏菌VNP20009是迄今为止靶向肿瘤领域中研究最广泛的细菌[11],具有出色的安全性,包括遗传减毒力(purI基因缺失)、败血性休克潜力降低(msbB基因缺失)和抗生素敏感度[12]。在对日本40例原发性骨肉瘤患者肿瘤组织研究后发现,骨肉瘤患者普遍缺乏甲硫腺苷磷酸化酶(一种甲硫氨酸补偿途径中重要的激酶,用于内源性合成甲硫氨酸)[13],这意味着骨肉瘤患者相比健康人群来说更依赖于外源性甲硫氨酸的补给。
本研究使用基因工程手段,利用微生物载体携带特异性消耗甲硫氨酸的酶构建VNP20009-M,通过阻断氨基酸的需求以达到杀伤肿瘤和阻断扩散的目的。为了进一步研究,我们选用的骨肉瘤细胞系MNNG-HOS、SaoS-2及U2OS均属于恶性程度高且在临床上缺乏有效药物的肿瘤细胞,以这三种细胞进行细胞学实验,并用MNNG-HOS建立裸鼠皮下荷瘤模型来评估VNP20009-M对骨肉瘤的治疗作用及其机制。VNP-M与骨肉瘤细胞共培养时表现出较好的促凋亡作用。为了进一步研究VNP-M对骨肉瘤治疗作用的机制,我们在不同的骨肉瘤细胞系里过表达甲硫氨酸酶基因,结果显示细胞生长和迁移均显著受到抑制,提示VNP-M可能通过表达甲硫氨酸酶来抑制骨肉瘤细胞的增殖迁移能力。动物实验中,通过瘤内注射不同剂量的VNP-M来治疗骨肉瘤皮下肿瘤,接受低剂量VNP-M治疗的小鼠肿瘤体积跟VNP-V和对照组相比差异无统计学意义;而较高剂量VNP-M治疗后小鼠肿瘤生长被显著抑制,表明VNP-M对骨肉瘤的治疗作用可能具有剂量依赖性。骨肉瘤预后不良和高复发转移率与肿瘤干细胞相关,Wang等[14]指出剥夺甲硫氨酸对肿瘤干细胞造成不可逆转的伤害,提示VNP-M可能对阻断骨肉瘤转移有潜在的效果。后续工作中,我们将研究VNP-M影响骨肉瘤细胞及小鼠肿瘤生长的分子机制,同时进一步模拟真实的发病情况,如构建尾静脉全身转移模型与原位转移模型来探索VNP-M的治疗效果及其分子机制。
综上所述,本研究利用减毒沙门氏菌作为载体携带甲硫氨酸酶基因,在体内靶向肿瘤并表达高活性的甲硫氨酸酶基因,在破坏肿瘤微环境激活肿瘤局部免疫反应的同时,特异性消耗肿瘤内部的甲硫氨酸水平。VNP20009-M在体外可明显诱导骨肉瘤细胞凋亡,显著抑制骨肉瘤细胞增殖和迁移能力,在体内可明显抑制骨肉瘤生长,具有潜在的临床应用价值。
作者贡献
张馨丹:实验实施与可行性分析,数据分析,论文撰写及修订
赵正刚、周素瑾、穆云萍:数据分析,论文修订
李美蓉、赖运浩:数据收集、整理与分析
萧耿苗:数据分析
李芳红、赵子建:实验实施与可行性分析,文章质量控制及审查
| [1] |
Chen S, Li Y, Zhi S, et al. WTAP promotes osteosarcoma tumorigenesis by repressing HMBOX1 expression in an m6A-dependent manner[J]. Cell Death Dis, 2020, 11(8): 659. DOI:10.1038/s41419-020-02847-6 |
| [2] |
Lin YH, Jewell BE, Gingold J, et al. Osteosarcoma: Molecular Pathogenesis and iPSC Modeling[J]. Trends Mol Med, 2017, 23(8): 737-755. DOI:10.1016/j.molmed.2017.06.004 |
| [3] |
Mi Z, Feng ZC, Li C, et al. Salmonella-Mediated Cancer Therapy: An Innovative Therapeutic Strategy[J]. J Cancer, 2019, 10(20): 4765-4776. DOI:10.7150/jca.32650 |
| [4] |
Hoffman RM. Methionine Dependency Determination of Human Patient Tumors in Gelfoam((R)) Histoculture[J]. Methods Mol Biol, 2018, 1760: 125-131. |
| [5] |
Cavuoto P, Fenech MF. A review of methionine dependency and the role of methionine restriction in cancer growth control and life-span extension[J]. Cancer Treat Rev, 2012, 38(6): 726-736. DOI:10.1016/j.ctrv.2012.01.004 |
| [6] |
Sun XH, Yang ZJ, Li SK, et al. In vivo efficacy of recombinant methioninase is enhanced by the combination of polyethylene glycol conjugation and pyridoxal 5'-phosphate supplementation[J]. Cancer Res, 2003, 63(23): 8377-8388. |
| [7] |
Mecham JO, Rowitch D, Wallace CD, et al. The metabolic defect of methionine dependence occurs frequently in human tumor cell lines[J]. Biochem Biophys Res Commun, 1983, 117(2): 429-434. DOI:10.1016/0006-291X(83)91218-4 |
| [8] |
Hoffman RM. Development of recombinant methioninase to target the general cancer-specific metabolic defect of methionine dependence: a 40-year odyssey[J]. Expert Opin Biol Ther, 2015, 15(1): 21-31. DOI:10.1517/14712598.2015.963050 |
| [9] |
Gao X, Sanderson SM, Dai ZW, et al. Dietary methionine influences therapy in mouse cancer models and alters human metabolism[J]. Nature, 2019, 572(7769): 397-401. DOI:10.1038/s41586-019-1437-3 |
| [10] |
Ashu EE, Xu JP, Yuan ZC. Bacteria in Cancer Therapeutics: A Framework for Effective Therapeutic Bacterial Screening and Identification[J]. J Cancer, 2019, 10(8): 1781-1793. DOI:10.7150/jca.31699 |
| [11] |
Clairmont C, Lee KC, Pike J, et al. Biodistribution and Genetic Stability of the Novel Antitumor Agent VNP20009, a Genetically Modified Strain of Salmonella typhimurium[J]. J Infect Dis, 2000, 181(6): 1996-2002. DOI:10.1086/315497 |
| [12] |
Pangilinan CR, Lee CH. Salmonella-Based Targeted Cancer Therapy: Updates on A Promising and Innovative Tumor Immunotherapeutic Strategy[J]. Biomedicines, 2019, 7(2): 36. DOI:10.3390/biomedicines7020036 |
| [13] |
Miyazaki S, Nishioka J, Shiraishi T, et al. Methylthioadenosine phosphorylase deficiency in Janpanese osteosarcoma patients[J]. Int J Oncol, 2007, 31(5): 1069-1076. |
| [14] |
Wang ZX, Yip LY, Lee JHJ, et al. Methionine is a metabolic dependency of tumor-initiating cells[J]. Nat Med, 2019, 25(5): 825-837. DOI:10.1038/s41591-019-0423-5 |
 2020, Vol. 47
2020, Vol. 47


