文章信息
- 新型高通量体外药敏检测技术在复发难治性急性髓系白血病患者个体化用药中的应用
- Clinical Application of A New In Vitro High-throughput Drug Sensitivity Screening Technology in Individualized Medication of Relapsed Refractory Acute Myeloid Leukemia Patients
- 肿瘤防治研究, 2020, 47(6): 462-465
- Cancer Research on Prevention and Treatment, 2020, 47(6): 462-465
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1364
- 收稿日期: 2019-11-01
- 修回日期: 2020-03-16
2. 230088 合肥,中国科学院合肥物质科学研究院
2. Hefei Institute of Material Science, Chinese Academy of Sciences, Hefei 230088, China
精准医疗时代,肿瘤靶向功能基因图谱和抗癌药物敏感度之间的关联大数据对肿瘤治疗发挥着重要作用,其中抗癌药物敏感度数据较难获取。传统的药敏实验以及类器官(patient derived organoid, PDO)、异种移植瘤小鼠模型(patient derived xenograft, PDX)等单次只能检测5~10种药物,培养成功率低,不足以克服临床肿瘤患者耐药的问题。新型高通量体外药敏实验(high-throughput drug sensitivity, HDS)是一种基于改良型细胞条件重编程技术(conditional reprogramming, CR)的可再生原代癌细胞药敏检测技术,一次可检测上百种药物,为精准治疗提供了一个有利的工具。近年来,新型原代癌细胞培养技术的相关临床研究成为热点,美国哈佛大学、芬兰赫尔辛基大学、新加坡中央医院、韩国首尔三星医疗中心、瑞典乌普萨拉大学等都在研究相关技术体系[1-4]。
复发难治性急性髓系白血病(acute myeloid leukemia, AML)整体化疗缓解率较低,临床治疗策略十分有限,指南多推荐加入临床试验或采用新型的组合方案进行挽救性化疗,然而盲目试药效果往往差强人意,最终导致不良预后。如何制定复发难治性AML个性化用药方案来提高治疗缓解率是临床热点探讨并亟待解决的难题。Tyner等[5]对562例AML患者进行122种药物的原代细胞体外药敏检测,证明药敏检测可用于指导AML临床用药,并建立Vizome数据库,为AML的治疗提供了新的工具。本研究旨在探讨HDS技术在复发难治性AML患者个性化用药治疗中的临床指导意义。
1 资料与方法 1.1 病例选择及一般资料患者入选标准:(1)经过标准方案诱导治疗两个疗程无效的初诊病例;(2)完全缓解后经过巩固强化治疗,12月内复发者;(3)12月后复发经常规化疗无效者;(4)两次或多次复发者;(5)髓外白血病持续存在者。共纳入19例患者,均签署知情同意书。
1.2 标本采集与处理无菌条件下采集骨髓4 ml置于EDTA抗凝管,于2℃~8℃冷藏保存运输至中科普瑞昇实验室。样本接收后采用密度梯度离心法分离单核细胞,采用中科普瑞昇完全培养液(complete medium, CM)于37℃、5%CO2培养箱中培养24 h,CM重悬后调整细胞浓度为2×105/ml。
1.3 高通量药板制作将待测药物溶于DMSO中,按照相关临床剂量对应的100%血浆峰浓度PPC配置药物,储存于24×16的384孔透明药板(Corning, USA),同时采用同等体积的DMSO溶剂作为空白对照。待测药物与临床剂量及对应的检测浓度(实验具体数据请扫描本文OSID码查看附件)。
1.4 试剂与仪器Celltiter-Glo细胞增殖荧光检测试剂(Promega, USA);白血病细胞完全培养基(中科普瑞昇)。PerkinElmer自动移液工作站;PerkinElmer Envision酶标仪;BioTek自动分液系统;Corning 384孔细胞培养板;Beckman高速离心机。
1.5 HDS高通量体外药敏检测实验步骤参考文献[6]。取对数生长期细胞(1 500个/孔)接种于24×16的384孔白色不透明细胞培养板(Corning 3570, USA),每孔加细胞培养液50 μl,37℃、5%CO2培养箱中培养24 h。采用高通量自动移液系统(JANUS@automated workstation)给细胞板加药(每孔0.1 μl),37℃、5%CO2培养箱中孵育72 h后,加入10 μl CellTiter-Glo细胞增殖荧光检测试剂,静置10 min,酶标仪Envision Plate-Reader读数,得出对应的每孔荧光值RLU。待测化合物原始数据RLUDrug与DMSO对照组RLUDMSO进行预处理,即扣除背景荧光值后进行归一化处理,计算待测药物对癌细胞的生长抑制率,抑制率(%)=(1-药物筛选组肿瘤细胞存活数目/空白对照组肿瘤细胞存活数目)×100%。
1.6 结果判定参考根据药物抑制率,分为高度敏感(+++):抑制率≥80%;中度敏感(++):抑制率50%~80%;低度敏感(+):抑制率20%~ < 50%;不敏感(-):抑制率 < 20%。临床化疗疗效评判标准参考文献[7],根据骨髓象缓解情况,分为完全缓解(CR)、部分缓解(CR)、未缓解(NR)。
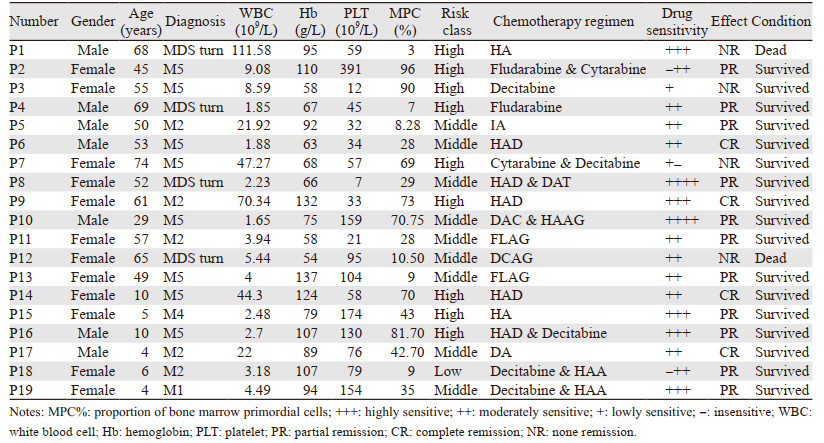
2 结果 2.1 临床疗效分析19例患者对32种药物和方案的敏感度见图 1,可见不同的患者对肿瘤药物的敏感度存在较大差异,这与肿瘤的生物学特性、患者个体差异、药物本身的不良反应等因素有关,而这些因素靠经验治疗具有一定的盲目性,因此,在化疗前针对不同的患者进行体外药敏筛查来提高用药有效性十分必要。本研究利用新型高通量药敏检测技术,对19例复发难治性AML患者进行体外药敏检测,根据检测结果选择敏感方案进行个性化用药治疗并观察临床效果,见表 1,其中4例未缓解(NR),4例完全缓解(CR),11例部分缓解(PR),总缓解率ORR为78.94%。
|
| 图 1 32种药物/方案对19例AML患者的抑制率和敏感分级 Figure 1 Inhibition rate and sensitivity grade of 19 AML patients to 32 drugs and regimens |
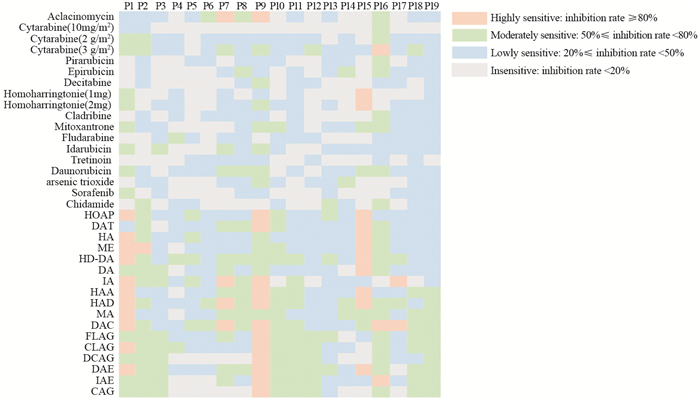
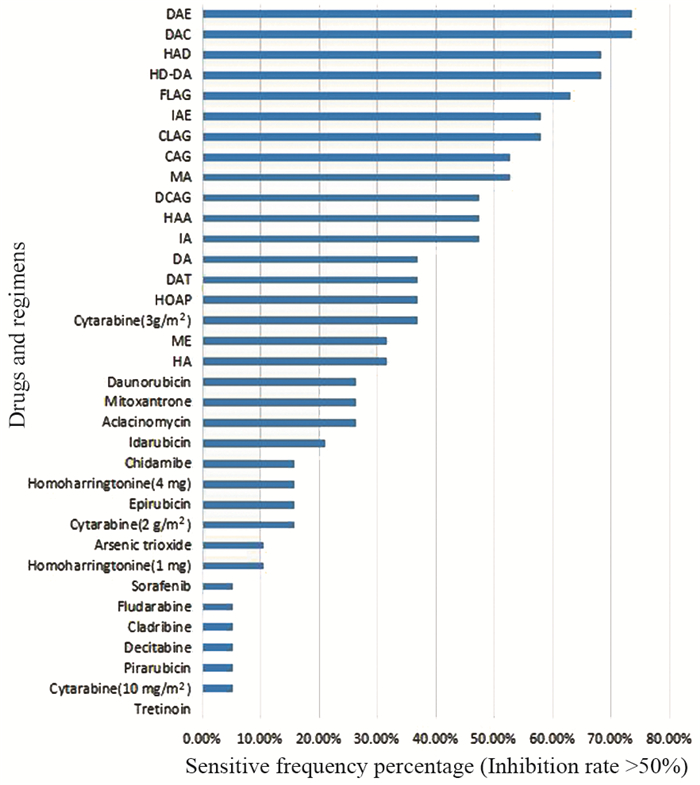
在中高度敏感等级里,化疗方案DAE、DAC、HAD、HD-DA以及单药高剂量阿糖胞苷、柔红霉素、米托蒽醌等出现频次较多。DAE、DAC、HAD、HD-DA方案敏感频次在68%以上,见图 2,值得进一步探讨这些方案单独以及联合靶向治疗在复发难治性AML患者中的临床治疗价值。低剂量阿糖胞苷(10 mg/m2)、高三尖杉酯碱(1 mg)、全反式维甲酸、地西他滨、索拉菲尼、CAG等药物和方案均不敏感,见图 3,其中低剂量阿糖胞苷与高三尖杉酯碱对复发难治性AML患者存在剂量依赖性。综上所述,高通量药敏检测结果能够为特殊癌种患者在缺乏循证医学证据下提供用药参考,减少无效用药,并对敏感频次较高的方案进行进一步剂量探讨和临床试验。
|
| 图 2 19例患者对32种药物和方案中、高度敏感(抑制率≥50%)频次的百分比 Figure 2 Moderate to high sensitivity(inhibition rate ≥50%) frequency percentage of 19 patients to 32 drugs and regimens |
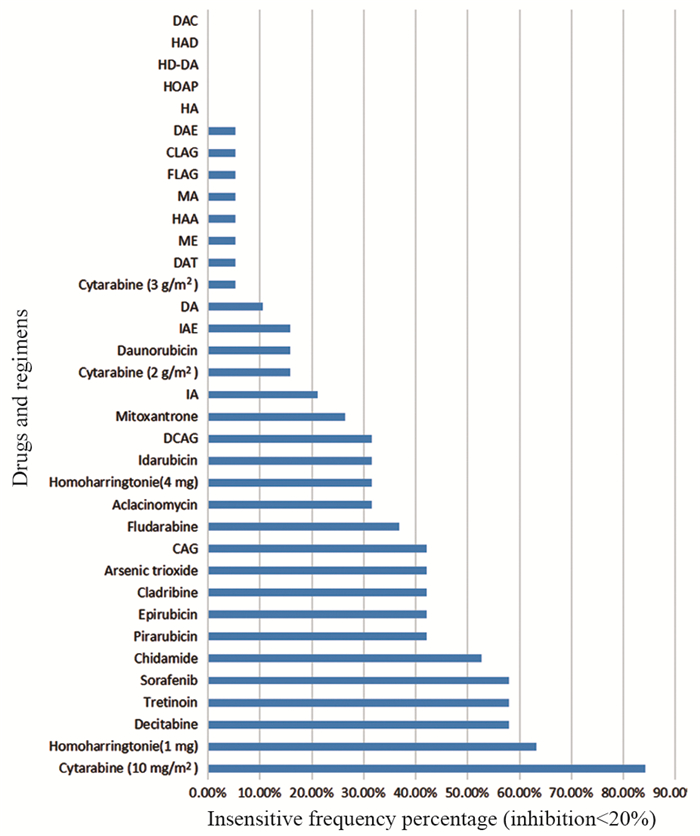
|
| 图 3 19例患者对32种药物和方案不敏感(抑制率 < 20%)频次的百分比 Figure 3 Insensitive(inhibition rate < 20%) frequency percentage of 19 patients to 32 drugs and regimens |
随着2003年人类基因组计划的完成,基于基因检测技术的临床诊疗已经历了十多年的发展,尤其为肿瘤诊疗领域带来了一场基因靶向治疗的变革。美国统计了2006~2018年涵盖38种癌症的基因靶向治疗获益情况,结果显示仅8.33%的患者适合基因检测,而整体获益率不到5%[8],为了应对基因检测技术在可靠性、重复性、有效性方面的不足,后基因组时代,人们开始尝试将体外药敏检测、蛋白质组学技术等表型筛选技术引入到精准医疗解决方案中。2019年CSCO年会上,贺福初院士的开场主题报告展示了利用蛋白质组学和PDX药敏技术发现“老药新用”[9]可解决癌症“缺药”的难题,呼吁打破基因组和转录组的“迷阵”,重视多组学交叉发展,特别是表型筛选领域技术在临床上的应用[10]。杜亚楠等[11-12]通过将肿瘤细胞系、人源肿瘤异种移植模型(PDX)或肿瘤患者源的原代细胞接种到3D微阵列上,经培养形成3D微肿瘤阵列,与高通量仪器匹配,实现高通量药物筛选和个体化敏感高检测,为临床用药提供新的技术支持。刘青松等[13]利用改良型条件重编程技术[14]开发了高通量药物敏感度检测体系。
无论是临床科学研究还是临床转化应用,精准医学正朝着多组学交叉融合发展迈进,而不仅仅是基因检测。如何利用离体肿瘤模型进行实时肿瘤药物应答监测与评估将是后基因组时代重点探讨的技术领域。一个好的药敏检测技术需要具备以下几点:(1)高通量,即单个周期内检测的药物数量足够多,只有解决了通量的问题,才能有望应对肿瘤耐药、复发难治的问题;(2)成本低;(3)操作成功率高;(4)周期短;(5)体内外一致性好。目前,小鼠移植肿瘤模型[15]和类器官[16]尚需解决通量和成本问题,基于PDC的药敏检测是当下较可行的方法。新型高通量药敏检测克服了传统药敏细胞培养困难和剂量换算的难题,是一种有效的2D筛选体系。本次研究发现高通量药敏检测可以有效指导复发难治性AML患者的个体化药物治疗,较经验治疗能大大提高用药有效率,但本研究样本数有限,需更多临床数据验证。
作者贡献
吴海兵:标本搜集、协助临床药板制定及文章撰写
赵晓燕、沈明芳:收集病例资料、随访
黄瑞:药敏数据分析、文献查阅
陈程:原代细胞培养
任涛:高通量药物药板剂量设置和药板制定
沈旸:项目总负责、质量控制
| [1] |
Garnett MJ, Edelman EJ, Heidorn SJ, et al. Systematic identification of genomic markers of drug sensitivity in cancer cells[J]. Nature, 2012, 483(7391): 570-575. DOI:10.1038/nature11005 |
| [2] |
Pemovska T, Kontro M, Yadav B, et al. Individualized Systems Medicine Strategy to Tailor Treatments for Patients with Chemorefractory Acute Myeloid Leukemia[J]. Cancer Discov, 2013, 3(12): 1416-1429. DOI:10.1158/2159-8290.CD-13-0350 |
| [3] |
Crystal AS, Shaw AT, Sequist LV, et al. Patient-derived models of acquired resistance can identify effective drug combinations for cancer[J]. Science, 2014, 346(6216): 1480-1486. DOI:10.1126/science.1254721 |
| [4] |
Chia S, Low JL, Zhang X, et al. Phenotype-driven precision oncology as a guide for clinical decisions one patient at a time[J]. Nat Commun, 2017, 8(1): 435. DOI:10.1038/s41467-017-00451-5 |
| [5] |
Tyner JW, Tognon CE, Bottomly D, et al. Functional genomic landscape of acute myeloid leukaemia[J]. Nature, 2018, 562(7728): 526-531. DOI:10.1038/s41586-018-0623-z |
| [6] |
Pemovska T, Kontro M, Yadav B, Edgren H, et al. Individualized systems medicine strategy to tailor treatments for patients with chemorefractory acute myeloid leukemia[J]. Cancer Discov, 2013, 3(12): 1416-1429. DOI:10.1158/2159-8290.CD-13-0350 |
| [7] |
Creutzig U, Kaspers GJ. Revised recommendations of the International Working Group for diagnosis, standardization of response criteria, treatment outcomes, and reporting standards for therapeutic trials in acute myeloid leukemia[J]. J Clin Oncol, 2004, 22(16): 3432-3433. DOI:10.1200/JCO.2004.99.116 |
| [8] |
Marquart J, Chen EY, Prasad V. Estimation of the Percentage of US Patients With Cancer Who Benefit From Genome-Driven Oncology[J]. JAMA Oncol, 2018, 4(8): 1093-1098. DOI:10.1001/jamaoncol.2018.1660 |
| [9] |
Jiang Y, Sun A, Zhao Y, et al. Proteomics identifies new therapeutic targets of early-stage hepatocellular carcinoma[J]. Nature, 2019, 567(7747): 257-261. DOI:10.1038/s41586-019-0987-8 |
| [10] |
Friedman AA, Letai A, Fisher DE, et al. Precision medicine for cancer with next-generation functional diagnostics[J]. Nat Rev Cancer, 2015, 15(12): 747-756. DOI:10.1038/nrc4015 |
| [11] |
Yan X, Zhou L, Wu Z, et al. High throughput scaffold-based 3D micro-tumor array for efficient drug screening and chemosensitivity testing[J]. Biomaterials, 2019, 198: 167-179. DOI:10.1016/j.biomaterials.2018.05.020 |
| [12] |
朱路, 勾越阳, 鄢晓君, 等. 基于病人自体肿瘤细胞体外培养模型的个体化精准用药[J]. 中国医疗设备, 2016, 31(6): 13-18, 35. [Zhu L, Gou YY, Yan XJ, et al. Precise medicine in cancer treatmentvia patient derivedin vitro tumor model[J]. Zhongguo Yi Liao She Bei, 2016, 31(6): 13-18, 35. DOI:10.3969/j.issn.1674-1633.2016.06.003] |
| [13] |
刘飞扬, 黄瑞, 任涛, 等. 肿瘤精准用药治疗的技术体系[J]. 高科技与产业化, 2016, 242: 50-52. [Liu FY, Huang R, Ren T, et al. Technology system of cancer Precision medicine[J]. Gao Ke Ji Yu Chan Ye Hua, 2016, 242: 50-52.] |
| [14] |
Liu X, Ory V, Chapman S, et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells[J]. Am J Pathol, 2012, 180(2): 599-607. DOI:10.1016/j.ajpath.2011.10.036 |
| [15] |
Almosailleakh M, Schwaller J. Murine Models of Acute Myeloid Leukaemia[J]. Int J Mol Sci, 2019, 20(2): pii: E453. DOI:10.3390/ijms20020453 |
| [16] |
Mazzocchi AR, Rajan SAP, Votanopoulos KI, et al. In vitro patient-derived 3D mesothelioma tumor organoids facilitate patient-centric therapeutic screening[J]. Sci Rep, 2018, 8(1): 2886. DOI:10.1038/s41598-018-21200-8 |
 2020, Vol. 47
2020, Vol. 47